【ASCO 2024】洞察诊疗前沿,看晚期HCC免疫联合治疗新进展
2024-07-22 消化界 消化界 发表于上海
本文聚焦晚期HCC,系统性梳理和总结2024年ASCO年会上公布的相关研究成果,旨在为临床实践提供具有参考价值的见解与启示。
导语
2024年美国临床肿瘤学会(ASCO)年会于2024年5月31日至6月4日在美国芝加哥圆满落幕,尽管会议已告一段落,但其产生的学术影响依然深远。在肝细胞癌(HCC)治疗领域,本次年会所发布的研究成果不仅为HCC的治疗提供了新的视角,同时也为HCC精准治疗的未来发展注入了新的动力。本文聚焦晚期HCC,系统性梳理和总结2024年ASCO年会上公布的相关研究成果,旨在为临床实践提供具有参考价值的见解与启示。
LBA4008:双免联合方案头对头比较一线靶向治疗方案
CheckMate 9DW是一项全球多中心、随机对照、开放标签的III期研究,在未接受系统治疗的不可切除HCC患者中比较纳武利尤单抗联合伊匹木单抗一线治疗与仑伐替尼或索拉非尼的疗效和安全性。共纳入668例既往未经治疗的晚期HCC患者,1:1随机分组,一组接受纳武利尤单抗(1 mg/kg)联合伊匹木单抗(3 mg/kg)治疗最多4个周期,随后两年每4周接受纳武利尤单抗(480 mg);另一组接受每日两次400 mg索拉非尼或每日一次8 mg或12 mg仑伐替尼[1]。
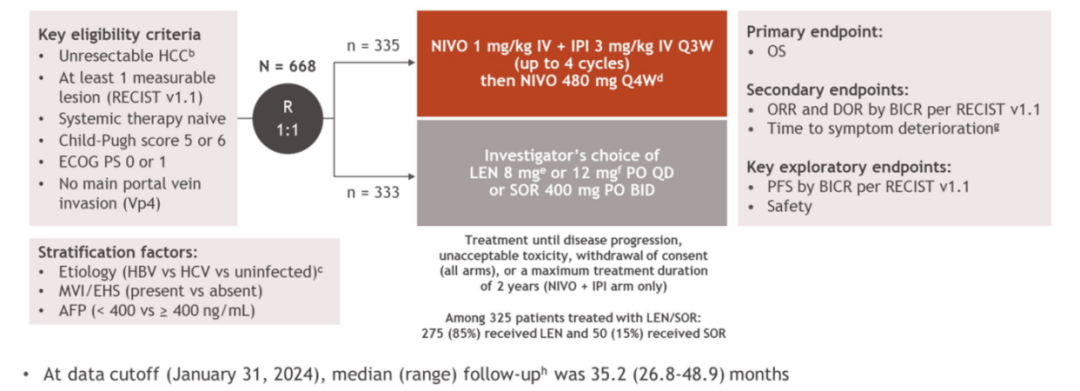
图1. CheckMate 9DW研究设计
截至2024年1月31日,中位随访时间35.2个月时,达到主要研究终点。纳武利尤单抗联合伊匹木单抗组的中位总生存期(OS)相比仑伐替尼或索拉非尼组具有统计学和临床意义的显著差异,降低死亡风险21%(23.7个月 vs 20.6个月,HR=0.79,P=0.018)。两组的3年OS率分别为38%和24%,考虑到免疫治疗的拖尾效应,可能预示着联合组将取得更长的生存数据。另外,对照组52%的患者在一线治疗进展后接受了免疫治疗,即使如此,纳武利尤单抗联合伊匹木单抗组的中位OS也具有显著优势。
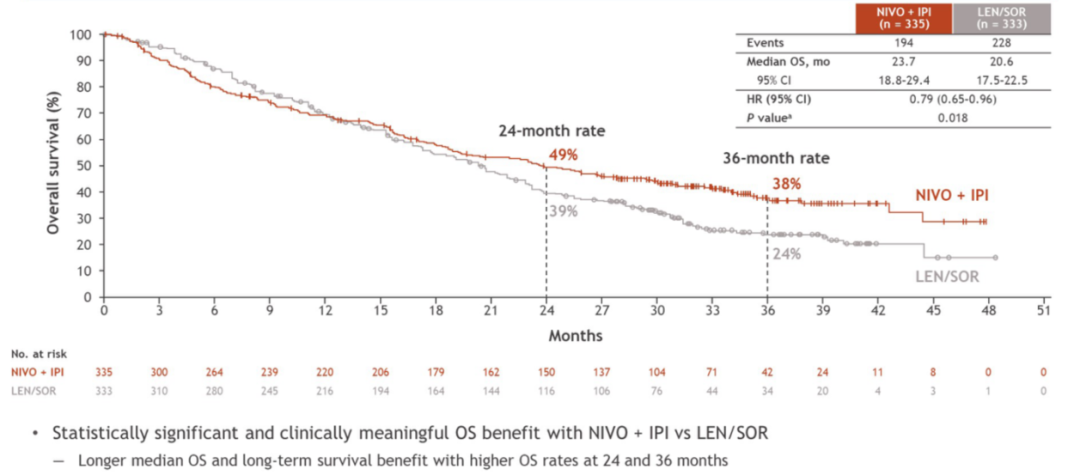
图2. 纳武利尤单抗联合伊匹木单抗组的中位OS相比仑伐替尼或索拉非尼组显著延长
在疾病缓解方面,与仑伐替尼或索拉非尼组相比,纳武利尤单抗联合伊匹木单抗组的客观缓解率(ORR,36% vs 13%)大幅提高,中位缓解持续时间(DOR)高达30.4个月,而中位至缓解时间(TTR)仅2.2个月,这意味着纳武利尤单抗联合伊匹木单抗治疗能够使肿瘤快速缓解,并且缓解能够持久维持。
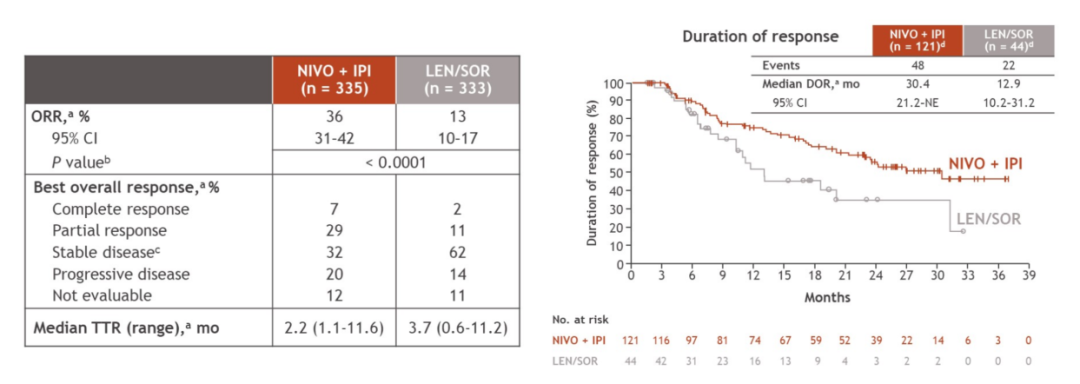
图3. CheckMate 9DW研究的肿瘤缓解结果
在安全性方面,纳武利尤单抗联合伊匹木单抗组中最常见的治疗相关不良事件(TRAE)包括瘙痒、AST升高、ALT升高和皮肤反应。联合组中TRAEs导致治疗中止的发生率为18%,而对照组为10%。免疫相关的AE多为1/2级,属于可管理范围,并未导致治疗停止。总之,纳武利尤单抗联合伊匹木单抗一线治疗不可切除晚期HCC患者展现出具有统计学和临床意义的OS获益,且安全性可控,可作为晚期HCC的新一线治疗选择。
4111:靶免联合方案对比单独靶向药物一线治疗的真实世界研究结果
该项真实世界研究纳入了2018年8月至2022年8月在加拿大两个医疗中心接受阿替利珠单抗联合贝伐珠单抗(n=159)或仑伐替尼(n=294)一线治疗的453例晚期HCC患者,两组患者多数基线特征相似,但仑伐替尼组ECOG PS评分为2的比例更高(11% vs.5%;P=0.047),HBV占比较低(12% vs 19%;P=0.047),HCV占比更高(36% vs 25%;P=0.03)[2]。
总人群的中位OS为15.4个月,靶免联合组为19.7个月,仑伐替尼组为14.4个月(HR=0.72,P=0.021)。三类患者的中位PFS分别为6.9个月、8.3个月和6.3个月(HR=0.85;P=0.20);ORR分别为29.0%。阿替利珠单抗联合贝伐珠单抗治疗失败后86%的患者使用仑伐替尼作为二线治疗方案;而仑伐替尼治疗进展后,46%的患者使用瑞戈非尼二线治疗,仅21%接受阿替利珠单抗联合贝伐珠单抗治疗。该研究提供了西方国家晚期HCC患者使用阿替利珠单抗联合贝伐珠单抗或仑伐替尼一线治疗的直接比较结果,与仑伐替尼相比,阿替利珠单抗联合贝伐珠单抗可能与更好的OS相关,但PFS和ORR似乎相似。
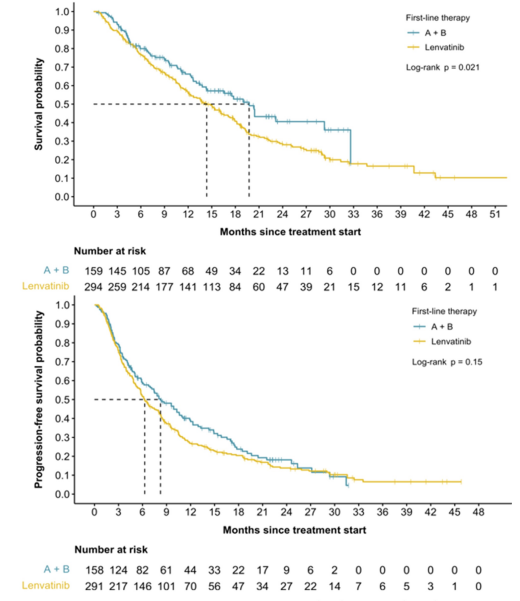
图4. 阿替利珠单抗联合贝伐珠单抗对比仑伐替尼一线治疗的PFS和OS结果
4007:靶免联合方案用于ICI治疗进展的晚期HCC患者
一项开放标签、II期研究纳入了既往使用ICI治疗进展的晚期HCC患者,评估瑞戈非尼联合帕博利珠单抗的疗效和安全性。根据既往治疗情况分为两个队列:队列1的患者既往接受阿替利珠单抗+贝伐珠单抗方案;队列2的患者使用任何其他ICI方案(单独或联合)[3]。
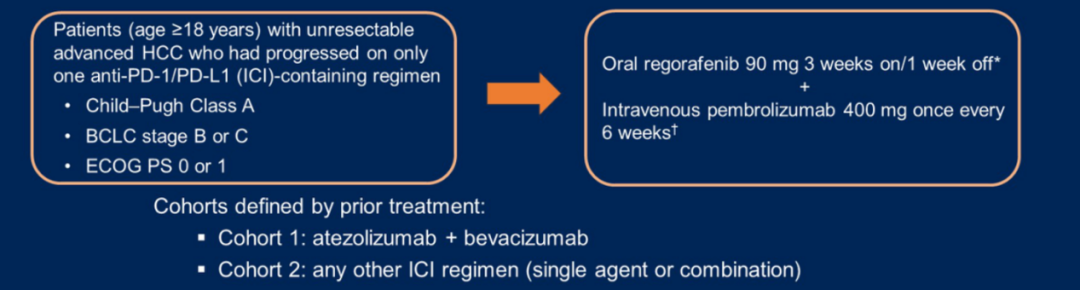
图5. 研究设计
共纳入95例患者,队列2似乎有更有利的疾病特征,既往治疗最常用的ICI是度伐利尤单抗(30%)、纳武利尤单抗(30%)、伊匹木单抗(22%)和帕博利珠单抗(19%)。中位随访时间为7.1个月,队列1中瑞戈非尼/帕博利珠单抗治疗的中位持续时间更短较短(队列1:11.0周/9.4周;队列2:21.4周/24.1周)。
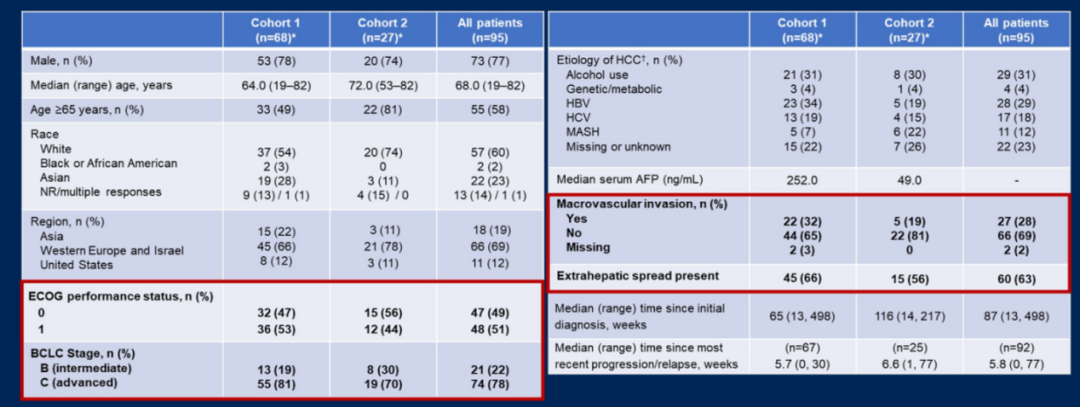
图6. 入组患者基线特征
两个队列的ORR分别为5.9%和11.1%,疾病缓解率(DCR)分别为48.5%和63.0%,中位PFS分别为2.8个月和4.2个月;中位OS均未达到。
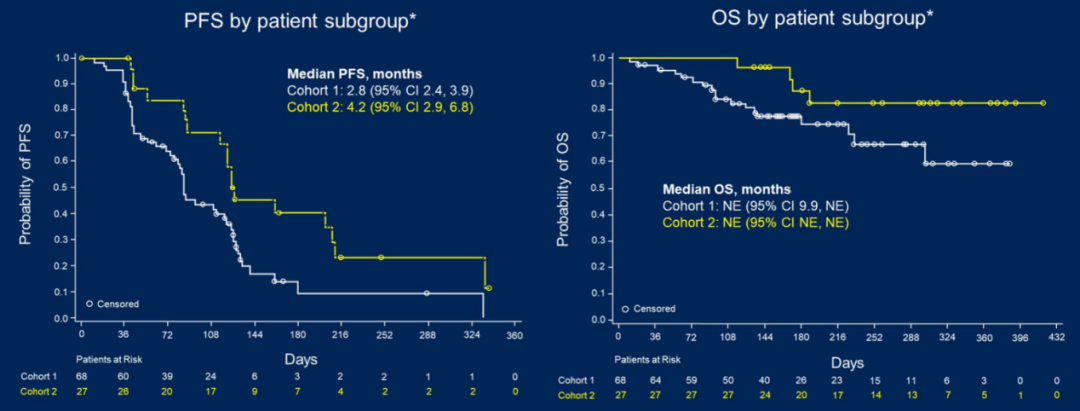
图7. 中位PFS和OS结果
该研究在ICI一线治疗进展的晚期HCC患者中评估了激酶抑制剂联合免疫检查点抑制剂的可行性,瑞戈非尼+帕博利珠单抗在ICI经治患者中展现一定抗肿瘤活性,联合方案的安全性与单药治疗的安全性一致。未来仍需继续探索ICI经治晚期HCC患者的最佳二线治疗方案。
4123:靶免联合局部治疗用于初始不可切除HCC患者的转化治疗
PLATIC是一项在中山大学肿瘤防治中心进行的单臂、Simon两阶段、II期研究,入组患者先接受TACE-HAIC治疗,随后接受信迪利单抗(200 mg)联合仑伐替尼(体重<60 kg者8 mg qd,体重≥60 kg者12 mg qd)治疗。主要终点是转化切除率。在2021年5月19日至2023年8月20日期间,共入组57例患者。在中位3个周期的转化治疗后,转化切除率达到了77.2%[4]。
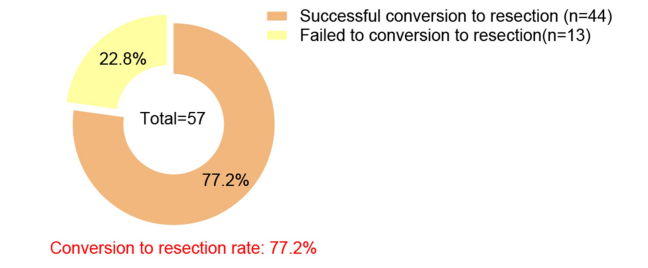
图8. TACE-HAIC及靶免联合治疗的转化切除率
按照mRECIST评估标准,ORR为80.7%,而根据RECIST 1.1评估的ORR为42.1%。中位DOR为11.5个月,中位PFS为14.3个月。在44例成功接受手术的患者中,病理学完全缓解(pCR)率为29.5%,中位PFS为15.3个月,12个月PFS率为59.4%。安全性方面,37例(64.9%)患者报告了3/4级TRAEs,其中最常见的是γ-谷氨酰转肽酶升高(36.8%),其次是腹痛(19.3%);未发生TRAEs引起的治疗停止或中断。这些研究成果表明,信迪利单抗联合仑伐替尼和TACE-HAIC为初始不可切除肝细胞癌患者提供了非常有前景的转化切除率,且安全性可控。
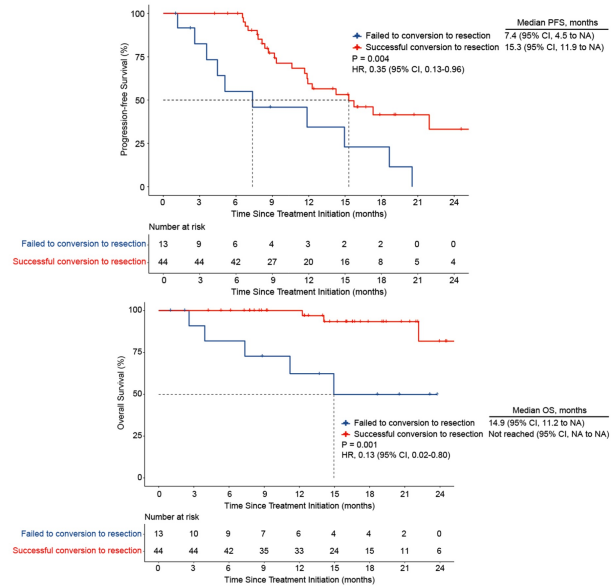
图9. TACE-HAIC及靶免联合治疗转化失败和成功患者的中位PFS结果
总结与思考
1 靶免、双免联合方案一线治疗新增诸多循证
随着基础免疫学、现代分子生物学、细胞学的兴起,基因工程技术和合成生物学的不断推陈出新,新的有效治疗靶点的不断被发现,晚期肝细胞癌的治疗亦是不断涌现新的成果,从靶向治疗到现在的多种免疫治疗,以及靶免、双免联合治疗模式的突破性进展,为中晚期肝癌患者带来了明显的生存获益,应用前景极其广阔。靶免联合的“T+A”组合(阿替利珠单抗联合贝伐珠单抗)、“双达”组合(信迪利单抗联合贝伐珠单抗生物类似物)和“双艾”组合(卡瑞利珠单抗联合阿帕替尼),以及双免方案度伐利尤单抗联合替西木单抗已获得《CSCO原发性肝癌诊疗威廉亚洲博彩公司 2022》推荐用于晚期肝癌的一线治疗[5]。
本次ASCO大会中公布的III期CheckMate 9DW研究证实了纳武利尤单抗联合伊匹木单抗一线治疗相比单独靶向药物的显著OS获益;西方真实世界研究证实,与仑伐替尼相比,“T+A”组合可能与更长的OS获益相关;另外,本次大会中还公布了CARES-310研究的最终OS结果,“双艾”组合的中位OS达23.8个月,相比索拉非尼组的15.2个月延长了8.5个月;这些研究成果进一步夯实了靶免、双免联合治疗模式在晚期HCC的一线治疗地位。
2 免疫经治HCC患者的二线治疗方案仍有待继续探索
随着靶免或双免联合方案成为晚期HCC的一线标准治疗选择,二线治疗中将面临越来越多的免疫检查点抑制剂(ICI)治疗进展的患者。然而现有的I/II期二线系统治疗相关临床研究入组标准多为一线索拉非尼或FOLFOX4治疗进展的患者,并不足以指导免疫经治HCC患者的二线治疗决策。本次ASCO大会中的一项II期研究初步证实了瑞戈非尼联合帕博利珠单抗在免疫经治患者的有效性。但目前针对免疫经治HCC患者,尚无标准二线治疗方案推荐,且缺乏高级别循证证据。
《肝细胞癌免疫联合治疗多学科中国专家共识(2023版)》指出,在一线免疫联合治疗失败后,需区别对待疾病进展的方式以及一线具体方案的应用,在兼顾二线治疗方案的抗癌机制和疗效证据以及安全性和耐受性的前提下合理选择相应的新方案[6]。
3 3.1+1+1+1>4,不可切除肝癌转化治疗新突破
肝癌首选治疗方法为手术,也是唯一能使患者获得长期生存甚至治愈的方法。但我国绝大多数肝癌患者在确诊时已处于中晚期,错失手术良机。转化治疗是将不可切除的晚期肝癌或者潜在可切除转化为可根治性切除,故成为晚期肝癌治疗研究的热点。
随着外科手术技术的不断创新,系统治疗与局部治疗手段的日益丰富和完善,多模式综合治疗策略为肿瘤转化治疗提供了广阔空间,使得患者能够重新获得手术治疗的机会,同时有效降低术后复发转移率,从而实现患者长期生存获益。II期PLATIC研究证实,转化治疗的中位疗程仅为3个周期时,TACE-HAIC联合信迪利单抗及仑伐替尼四联方案的转化切除率高达77.2%,手术切除患者的pCR率高达29.5%,这为不可切除HCC的转化治疗开辟了新的治疗思路。
总结
随着新的研究成果的不断涌现,靶免、双免联合方案在晚期HCC一线治疗中的地位得到了持续巩固,同时也有力推动了HCC转化治疗的规范化发展进程。然而,williamhill asia 必须意识到,针对二线治疗方案,尤其是免疫经治患者的有效治疗策略,仍需进一步深入探索。williamhill asia 坚信,通过不断引进新技术、新理念,并加强国际合作与交流,williamhill asia 能够共同推动晚期HCC治疗领域的持续进步与发展。
参考资料:
[1]Galle PR, Decaens T, Kudo M, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs lenvatinib (LEN) or sorafenib (SOR) as first-line treatment for unresectable hepatocellular carcinoma (uHCC): First results from CheckMate 9DW. 2024 ASCO. LBA4008.
[2]Freeman M, Krishnan T, LEE CL, et al. Atezolizumab + bevacizumab versus lenvatinib as first-line systemic therapy for treatment of hepatocellular carcinoma in a real-world population: Outcomes from the HCC CHORD database. 2024 ASCO. 4111.
[3]El-Khoueiry AB, Kim TY, Blanc JF, et al. International, open-label phase 2 study of regorafenib plus pembrolizumab in patients with advanced hepatocellular carcinoma (HCC) previously treated with immune checkpoint inhibitors (ICI). 2024 ASCO. 4007
[4]Yuan Y, Qiu J, Huang Z, et al. PD-1 inhibitor (sintilimab) and lenvatinib plus TACE-HAIC as conversion therapy for initially unresectable HCC: A single-arm, phase 2 clinical trial (PLATIC). 2024 ASCO. 4123.
[5]CSCO原发性肝癌诊疗威廉亚洲博彩公司 2022.
[6]肝细胞癌免疫联合治疗多学科中国专家共识(2023版).
[7]肝癌转化治疗中国专家共识(2021年).
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#肝细胞癌# #HCC# #免疫联合治疗#
48