浙大一院王杭祥教授/郑树森院士:三重组合的免疫原性纳米囊泡重塑肿瘤微环境以增强对临床前癌症模型的化疗/免疫治疗
2023-05-15 BioMed科技 BioMed科技 发表于上海
作者成功构建了一种三重组合的免疫原性纳米治疗平台,其中包含聚合共轭 GEM 前药,用于协同递送多种治疗药物,包括化疗药物、ICB 抑制剂和 STING 激动剂。
免疫检查点阻断(ICB)疗法对癌症治疗产生了巨大影响。然而,大多数患者的肿瘤微环境 (TME) 免疫原性较差,对 ICB治疗表现出耐受性。为了应对这些挑战,迫切需要采用化疗和免疫刺激剂的组合方案。
近期,浙江大学医学院附属第一医院王杭祥教授/郑树森院士团队报道了一种能够联合化疗/免疫治疗的三重组合纳米囊泡。该三重组合纳米囊泡可诱导强大的抗肿瘤免疫,使得大肿瘤模型持久消退并减少转移。该囊泡为同步递送STING 激动剂、PD-L1 抗体和化疗前药用以治疗ICB无反应性肿瘤中产生化疗/免疫治疗效果提供了新思路。相关研究以Triple-Combination Immunogenic Nanovesicles Reshape the Tumor Microenvironment to Potentiate Chemo-Immunotherapy in Preclinical Cancer Models为题发表于Advanced Science上。

癌症免疫疗法已显示出作为治疗晚期或转移性癌症复发患者的治疗的巨大潜力。靶向细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA4) 或程序性细胞死亡1/程序性细胞死亡配体1 (PD-1/PD-L1) 的免疫检查点阻断 (ICB) 抗体以被证明是一种有效的治疗方案,并且可以在癌症患者中产生完整和持久的免疫反应。尽管有着显著的临床效果,但很大一部分癌症患者并未受益于ICB 抗体治疗。越来越多的临床研究表明,这与高度免疫抑制的肿瘤微环境 (TME) 相关,其特征是肿瘤组织中大量存在的免疫抑制细胞亚型以及缺乏浸润性淋巴细胞(主要是CD8 + T 细胞)。这种免疫抑制性TME会阻碍CD8+ T 细胞介导的抗肿瘤效果,并导致对 ICB 疗法的耐受。因此,为了提高对 ICB 疗法的反应率,能够将低免疫原性TME转化为免疫原性TME的解决方案亟待提出。
干扰素基因刺激物 (STING) 是另一类独立的先天免疫感受器,已成为癌症免疫治疗中一个有希望的靶点。STING 的激活会导致 I 型干扰素 (IFN) 和其他促炎细胞因子的产生。这些分子可以进一步促进树突状细胞 (DC) 等抗原呈递细胞 (APC) 的成熟,以促进体内CD8+ T细胞的激活与免疫反应,从而实现 TME 的重塑以。在这种情况下,已有报道尝试利用环状二核苷酸 (CDN) 或非核苷酸 STING激动剂来刺激先天免疫反应并提高 ICB的疗效。然而,在目前的临床试验中,基 CDN的STING药物通常通过瘤内注射给药,这限制了它们在实体肿瘤中的应用。除了这些 CDN 激动剂之外,基于二氨基苯并咪唑 (diABZI) 的化合物(例如diABZI-3)也是最近发现的合成非核苷酸 STING 激活剂。尽管具有强大的活性,但水溶性差阻碍了它们进一步的临床应用。此外,小分子 STING 激动剂的静脉内给药导致这些药物在健康组织中的分布和TME中的累积不足。因此,需要合理的设计递送系统来同时提高 STING 激动剂的功效和安全。
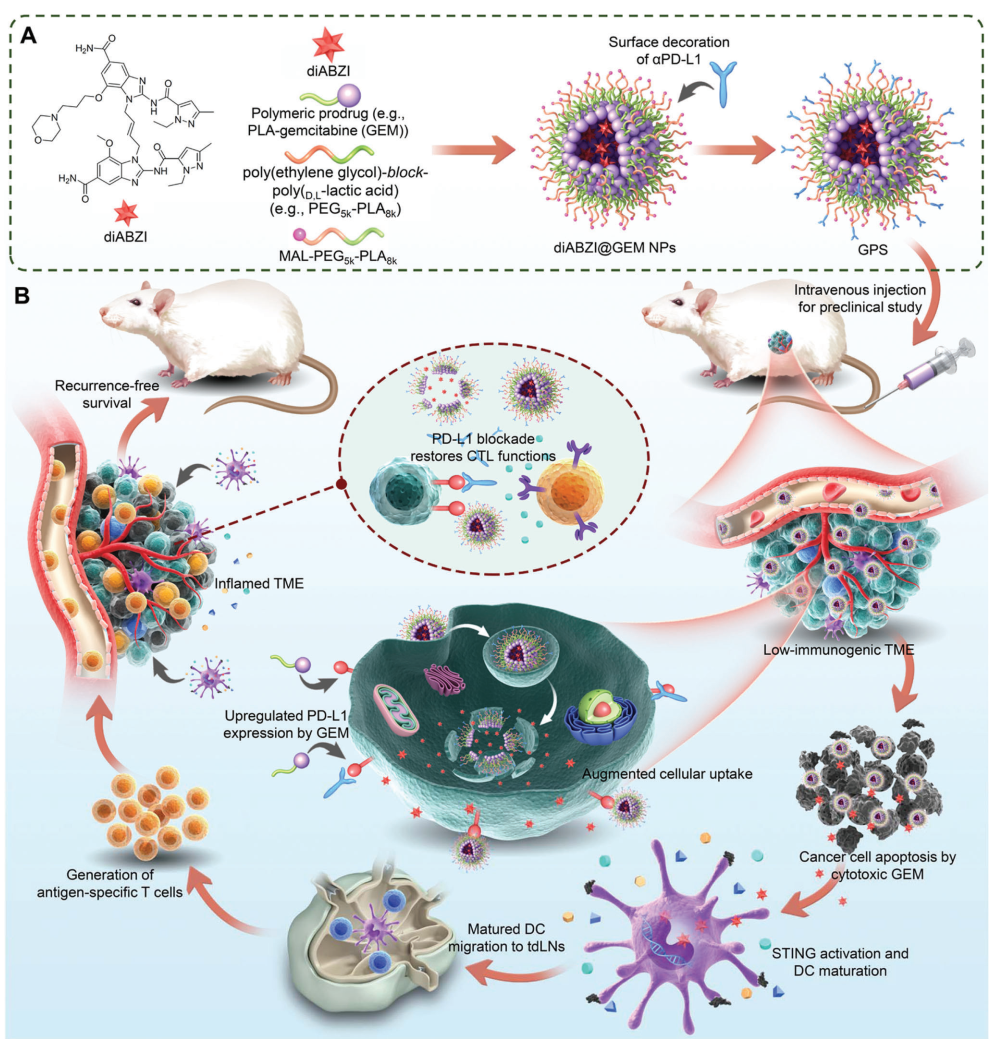
图1.用于癌症化疗/免疫治疗的三重组合免疫原性纳米囊泡。
基于以上问题,作者设计了一种三重组合的纳米颗粒 (NP)支架,它克服了ICB 耐药性并具有术后无复发生存的效果。作者首先设计了一种聚丙交酯 (PLA)共轭吉西他滨(GEM)的大分子前药,以增强其代谢稳定性并延长其给药后的循环半衰期。GEM 是一种脱氧胞苷类似物,广泛用于治疗多种形式的晚期胰腺癌、肺癌、乳腺癌、卵巢癌和膀胱癌。然而,GEM由于其快速失活和代谢而导致的循环半衰期短、耐药性和全身毒性,极大的影响了其治疗效果。在聚合物胶束中封装大分子GEM偶联物将有利于体内递送。此外,GEM治疗会上调肿瘤细胞中的 PD-L1 的表达,因此使用表面修饰PD-L1 抗体能够进行肿瘤特异性靶向递送,同时结合 PD-L1 阻断以改善整体功效。此外,作者将 STING 激动剂整合到载有 GEM的NP中,以生成三重组合免疫原性纳米囊泡,用以联合重塑 TME。在临床前小鼠模型中,全身给药的三重组合免疫原性纳米囊泡不仅有效地根除了已形成的大型原发性肿瘤,而且还能够持久抑制术后肿瘤复发(图1A)。
【图文导读】
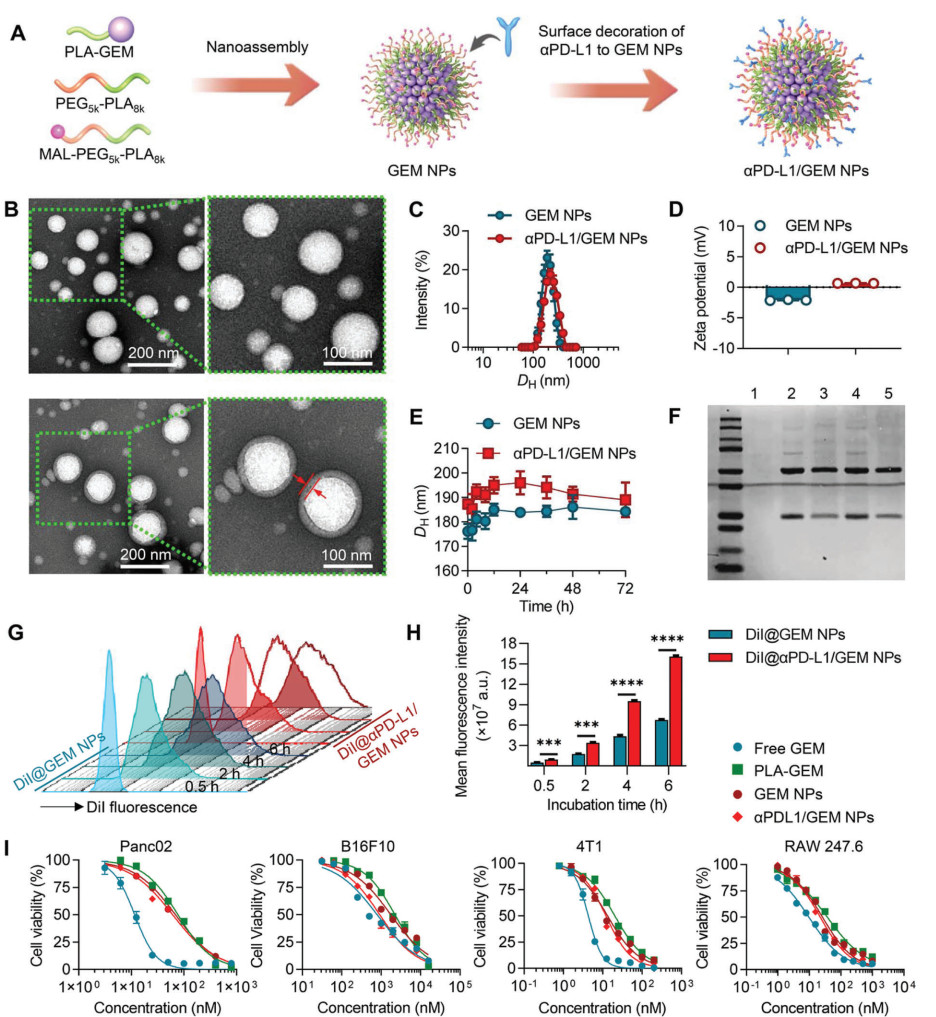
图 2. 三重组合免疫原性纳米囊泡的制备和表征。
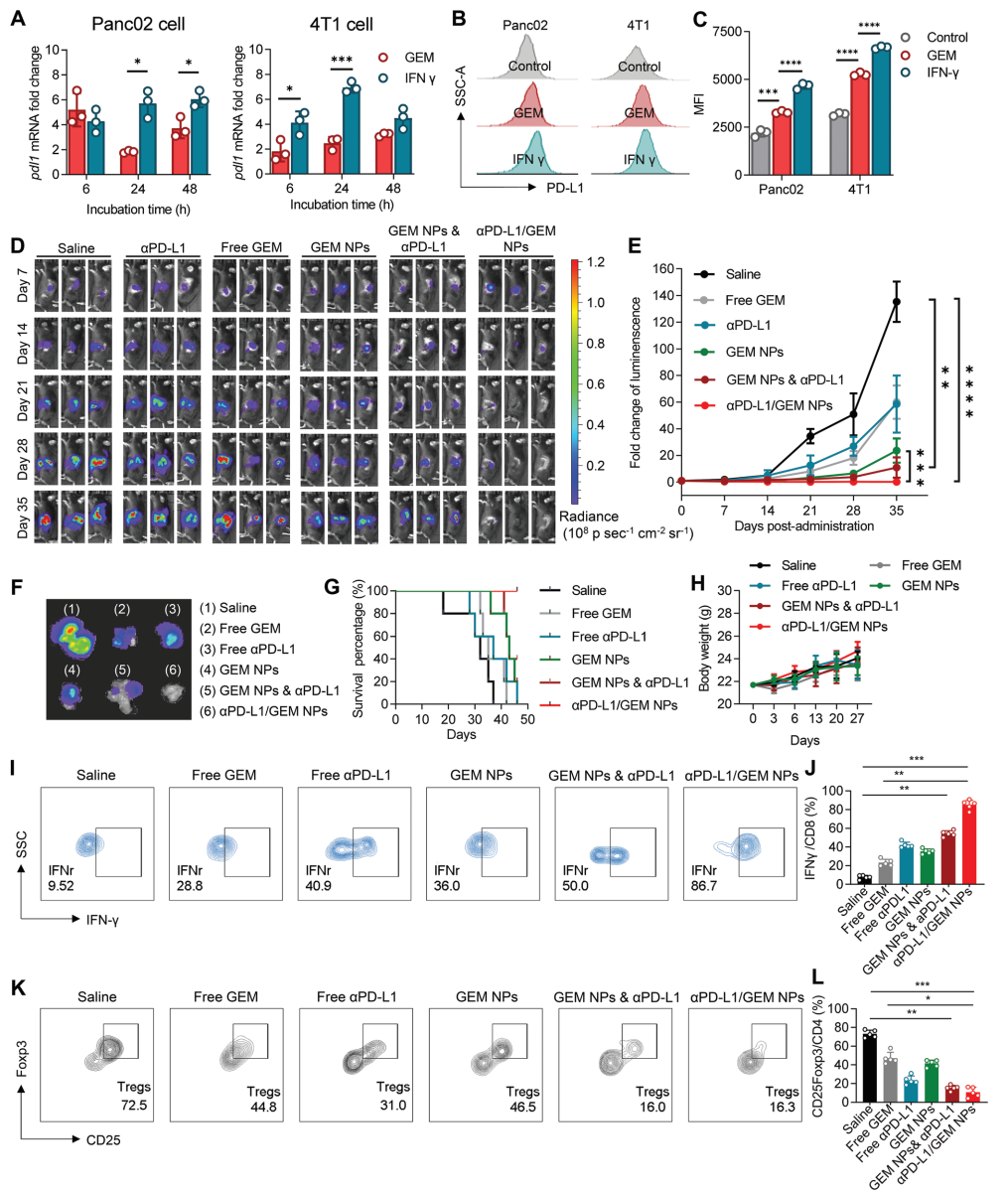
图 3. αPD-L1/GEM NPs 在原位胰腺癌模型中的抗肿瘤功效和免疫活性。

图 4. GPS治疗的设计和表征。

图5. GPS 疗法重塑TME,并在三阴性乳腺癌模型中实现了无复发生存。
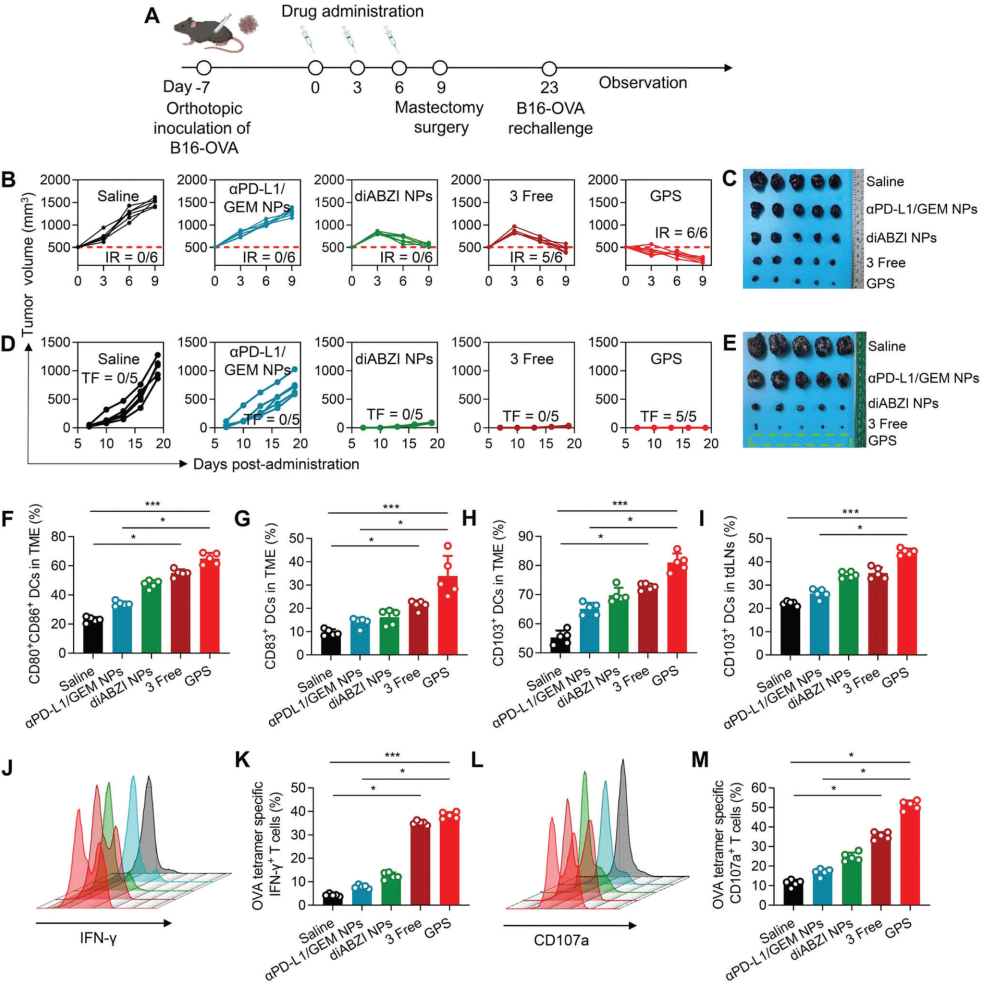
图 6. GPS 治疗根除大肿瘤并在黑色素瘤模型中引发肿瘤特异性免疫反应。
【总结】
作者成功构建了一种三重组合的免疫原性纳米治疗平台,其中包含聚合共轭 GEM 前药,用于协同递送多种治疗药物,包括化疗药物、ICB 抑制剂和 STING 激动剂。基于 GEM 治疗上调癌细胞中 PD-L1 表达,化疗剂 GEM 和αPD-L1 在单个纳米颗粒中进行合理设计,以增强细胞摄取和肿瘤内递送以及激活CTL。为了进一步克服对 ICB 的耐药性并提高肿瘤免疫原性,将 STING 激动剂结合起来形成三重组合 GPS 纳米递送系统,以协同先天免疫和适应性免疫。GPS 的应用诱导了肿瘤内 DC 的成熟,并上调了启动抗肿瘤 T 细胞反应所必需的免疫刺激细胞因子和趋化因子。此外,GPS治疗有效促进CD103+ DC从 TME 到 tdLNs的浸润和迁移,这一过程被认为是先天免疫和适应性免疫之间的桥梁。在 B16-OVA 再接种模型中,GPS 预处理的小鼠表现出对再接种肿瘤细胞的完全排斥,离体实验表明这些小鼠的脾脏 T 细胞可以产生特异性免疫响应。因此,GPS 疗法在根除原发性肿瘤和实现多种肿瘤模型的无复发生存方面具有良好的疗效。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202204890
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












认真学习了
63