ISME J:大连医科大学吴广圳/陈峰发现肠道微生物群对宿主癌症的潜在影响的综述
2023-08-31 iNature iNature 发表于上海
作者通过回顾总结近年来的研究进展,收集到肠道微生物群在各种人类癌症中的重要关联和明确的实验证据,重点介绍了肠道微生物群在抗肿瘤治疗中的应用和可能面临的挑战。
寄生在人体内的共生细菌及其产生的代谢物长期影响着宿主局部和全身的生理病理过程,其中肠道菌群对包括癌症在内的一系列人类疾病的影响越来越被人们所认识,它可能在许多类型癌症的发生、进展、治疗和预后中发挥关键作用。了解肠道微生物群在癌症中的功能作用对于个性化医疗时代的发展至关重要。
2023年8月8日,由大连医科大学附属第一医院吴广圳教授、陈峰教授共同通讯,大连医科大学硕士研究生孙嘉傲为第一作者在The ISME Journal 杂志在线发表了题目为“Potential effects of gut microbiota on host cancers: focus on immunity, DNA damage, cellular pathways, and anticancer therapy”的论文。
该杂志中科院SCI期刊分区一区,影响因子11.0。作者通过回顾总结近年来的研究进展,收集到肠道微生物群在各种人类癌症中的重要关联和明确的实验证据,重点介绍了肠道微生物群在抗肿瘤治疗中的应用和可能面临的挑战。最重要的是,作者还揭示了肠道菌群影响人类癌症的多方面机制,为未来的临床研究提供了方向和思路。
该综述不仅探究了肠道菌群通过影响宿主局部免疫微环境、DNA损伤以及癌症相关细胞通路活性,进而在癌症发生发展中的重要作用,还将癌症免疫治疗等抗癌治疗与肠道菌群联系起来。

近年来,越来越多的研究关注肿瘤免疫学与微生物的关系,尤其是非致病性微生物群,它们往往不是某些疾病的直接原因,而是影响局部和远处的病理过程,其中肠道微生物群与免疫系统具有复杂而关键的相互作用机制。在先天免疫过程中,核梭杆菌可以抑制宿主自然杀伤细胞(NK)并在感染部位募集髓源性抑制细胞(MDSCs),从而间接促进癌症的发生。这一过程由细菌毒力因子FAP2介导,FAP2结合并阻断NK受体TIGIT,从而抑制NK介导的免疫系统对肿瘤细胞的攻击。同样在结直肠癌小鼠模型中,梭杆菌通过招募肿瘤浸润免疫细胞和操纵先天免疫系统来抑制T细胞反应,产生有利于结直肠肿瘤进展的免疫微环境。
在适应性免疫中,肠道菌群及其代谢物以抗原呈递方式引发宿主特异性T细胞反应,例如脆弱拟杆菌分泌的毒素通过快速、强烈、选择性地激活STAT3,促进Th17反应,同时伴随着MAPK和NF-kB信号的激活,显著增加结肠肿瘤的形成。
此外,免疫细胞是肿瘤免疫微环境的重要成员,作者还发现肠道菌群与DC细胞、Tfh细胞和Th9细胞间存在联系,例如在黑色素瘤小鼠模型中,双歧杆菌通过TLR4介导的信号通路激活DC,然后DC在肿瘤微环境中扩增CD8+ T细胞应答,暴露于葡萄球菌肠毒素B (ETB)的Th9细胞也显著促进肿瘤细胞凋亡(图1)。
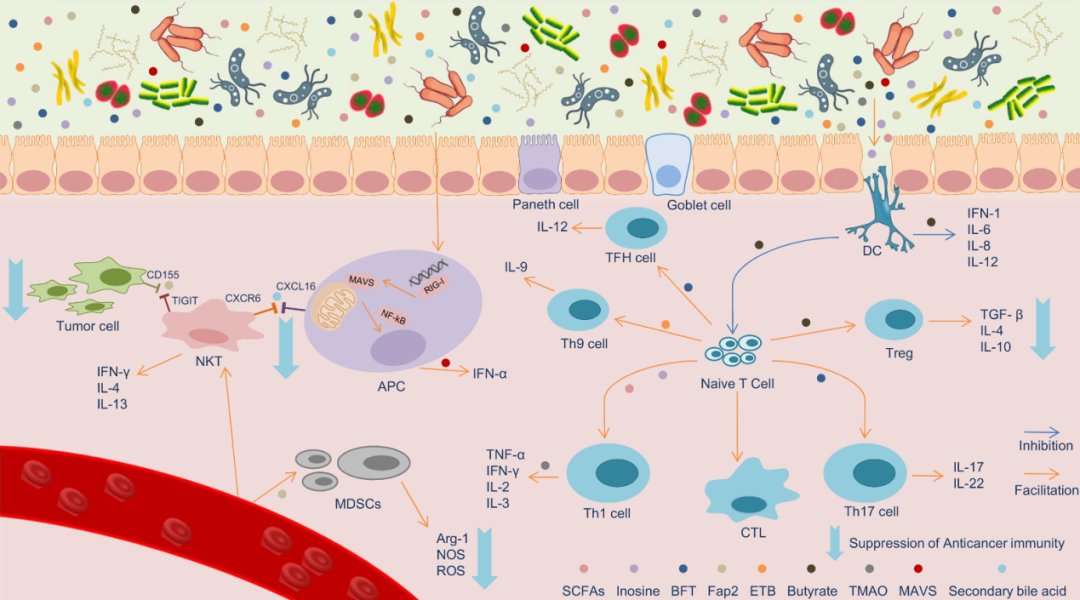
图1,肠道菌群及其代谢物与癌症相关免疫微环境的调控网络
之后作者还针对肠道菌群与宿主细胞DNA损伤进行了探索,这部分包括DNA的损伤和变异、染色体稳定性、表观基因组变化和microRNA调控(图2)。首先,肠道菌群释放的基因毒素表现出DNA酶活性。一旦在胃肠道上皮细胞附近释放,这些毒素会导致宿主上皮细胞中的双链DNA断裂,导致细胞周期短暂停滞,例如大肠杆菌素可以通过烷基化DNA中的腺嘌呤残基诱导双链断裂,导致直接突变,从而引发结直肠癌。其次,环境氧化是DNA损伤的重要原因,粪肠球菌等菌群定殖后所产生的氧化环境,增加宿主细胞DNA突变的可能性。此外,一些转录因子也是肠道菌群调控DNA损伤的重要一环,例如p53作为一种肿瘤抑制转录因子,可以结合特定的DNA序列激活转录,调节不平衡的细胞周期,修复缺陷基因,一些常见的致癌p53突变也是由肠道菌群产生的代谢物介导的。最后,作者还总结了肠道菌群在调控染色体稳定性、表观基因组变化和microRNA中的一系列作用。
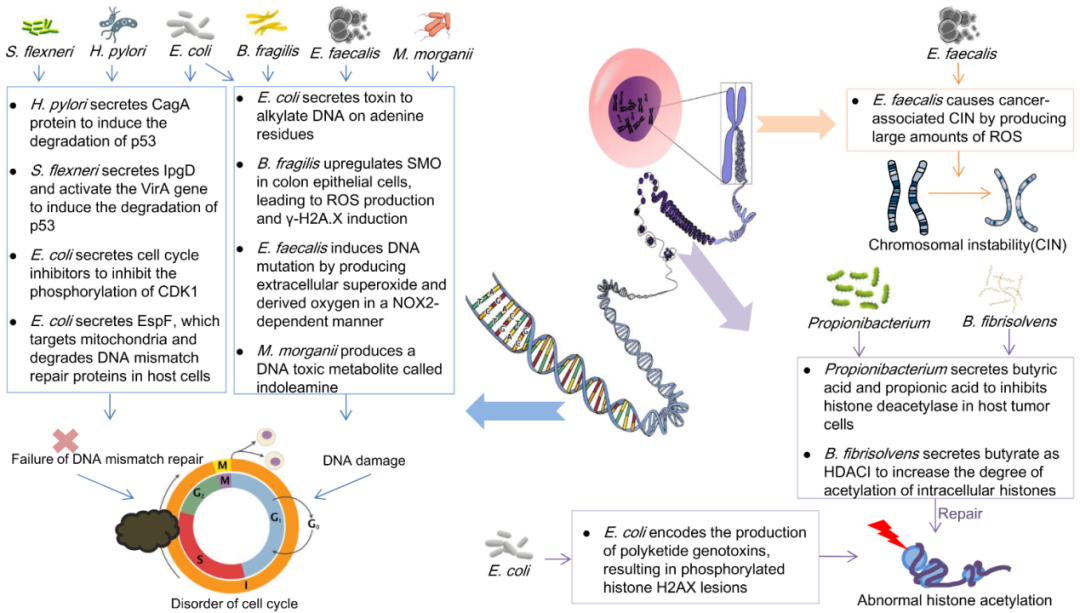
图2,肠道菌群与宿主细胞遗传物质的调控关系
除了参与免疫反应和DNA损伤外,肠道菌群与宿主之间的通信可以通过更多种机制发生,包括受体配体介导的信号传导和肠上皮屏障功能的调节,这往往导致癌症的进展。作者试图探索肠道菌群在肿瘤相关信号通路中的作用,促进和抑制癌症(图3)。此外,肠道菌群的成分和分泌产物,如LPS和SCFAs,也参与了肿瘤的发生和发展,这一部分作者也做了单独的详细描述。
炎性小体是一类在免疫细胞和上皮细胞中表达的多蛋白胞内复合物,在炎症和应激等病理条件下诱导细胞死亡,其紊乱可导致多种疾病,包括自身免疫性疾病和癌症。作者还发现,通过激活炎性小体,肠道菌群与免疫细胞和肠上皮细胞相互作用,产生既可以抑制癌症又可以预防癌症的结果。例如,在稳态状态下,肠道共生菌激活NLRP3炎性小体产生IL-18,调节适应性免疫,这对于维持肠道屏障的完整性和防止菌群失调至关重要。
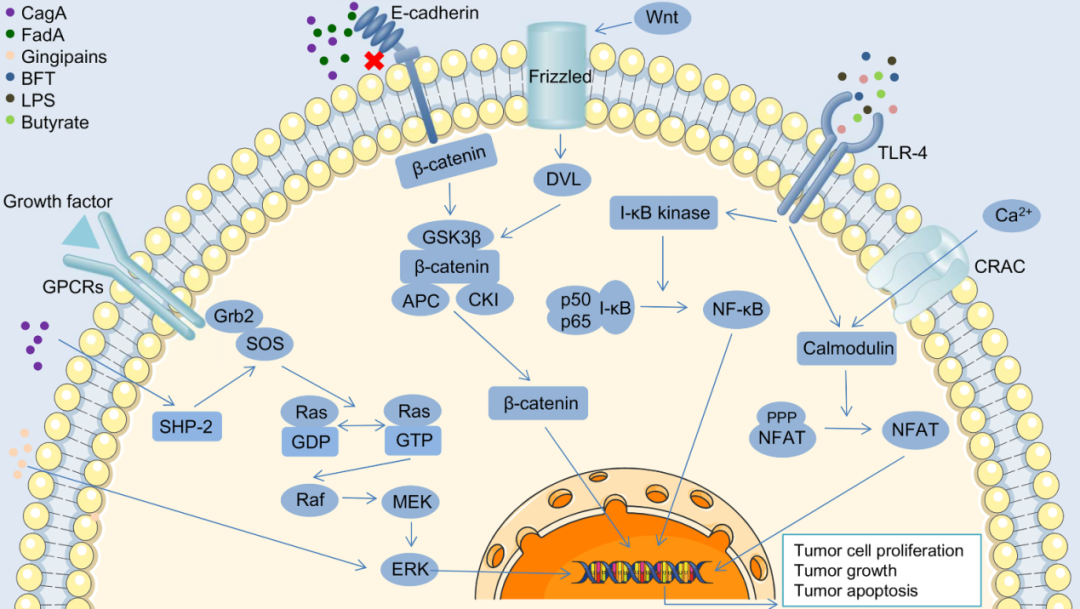
图3,肠道菌群及其代谢物参与调节肿瘤相关细胞通路
微生物与抗癌治疗的结合早在19世纪就开始了,以往的研究表明,微生物制剂直接注射到肿瘤组织或口服给药可对肿瘤细胞产生直接的细胞毒作用或刺激机体局部的抗肿瘤免疫反应。近年来的研究发现,传统的放疗、化疗、免疫治疗会改变患者的肠道菌群,而菌群的组成会深刻影响这些治疗的疗效和副作用,包括癌症复发、耐药、对机体的附带损害等,作者对这部分内容进行了详细的分析。此外,益生菌、益生元和粪便菌群移植(FMT)也在临床抗肿瘤治疗中取得了一定的临床疗效,作者也进行了详细讨论。
作者首先讨论了在放疗、化疗、免疫治疗中,治疗手段与肠道菌群的相互作用,包括它们对肠道菌群多样性的影响以及特殊的肠道菌群组分对抗癌治疗的疗效、预后和毒副作用的意义。例如对于放疗,辐照会使小鼠肠道菌群中拟杆菌门丰度增加,而艰难梭菌丰度下降;梭状芽孢杆菌衍生的免疫抑制代谢物对肿瘤病变的放射治疗有抵抗作用,而万古霉素通过增加DC的抗原呈递和CD8+ t细胞活化来逆转这一现象;肠道中的益生菌鼠李糖乳杆菌可将肠干细胞迁移至基底部,从而保护肠道免受辐射诱导的细胞损伤。
除了肠道菌群与抗癌治疗的关系,作者还探究了肠道菌群在癌症的诊断和预后中的重要价值,例如2017年的一项研究提出了结直肠癌粪便微生物组的宏基因组分析,以识别和验证不同种族队列中的细菌生物标志物,据此作者提出肠道菌群谱可能成为早期发现癌症的一种新的有效标志物。在预后方面,作者也收集资料并证明肠道菌群可能是癌症的潜在预后标志物,例如在结直肠癌患者中高危患者中拟杆菌门和放线菌门的相对丰度低于低危患者。
肠道菌群是肠道微生态的重要组成部分,就微生物群的组成和代谢功能而言,饮食可能是最强大的调节剂,作者还分析了不同的饮食模式对肠道菌群参与调控癌症发展的影响,例如富含菊粉的饮食改变了肠道微生物群,显著促进了双歧杆菌的生长,并且基于γδT淋巴细胞肿瘤浸润过程,还促进了小鼠模型中黑色素瘤、纤维肉瘤和CRC肿瘤生长的免疫控制。
作者认为,肠道菌群在癌症发展中起双重作用,利用肠道菌群与传统的抗肿瘤治疗策略相结合,以及使用益生菌、FMT、饮食控制等,可以提高抗癌治疗的疗效,同时减少副作用的发生,改善预后。同时,肠道菌群对癌症患者的诊断和预后的价值也逐渐被证实。总之,肠道菌群的人工控制可以促进癌症治疗体系朝着预期的方向发展,为制定更有效的抗癌治疗方案和推进精准医疗提供科学依据。
原文链接:
https://www.nature.com/articles/s41396-023-01483-0
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言











