一文读懂非小细胞肺癌脑转移治疗策略最新总结!
2024-05-16 williamhill asia 肿瘤新前沿 MedSci原创 发表于上海
非小细胞肺癌脑转移成为治疗的一大挑战。过去十年,尽管许多新型疗法提高了非小细胞肺癌患者的生存期,但脑转移仍是一个不容忽视的问题,特别是对于那些晚期肺癌患者而言。
非小细胞肺癌脑转移成为治疗的一大挑战。过去十年,尽管许多新型疗法提高了非小细胞肺癌患者的生存期,但脑转移仍是一个不容忽视的问题,特别是对于那些晚期肺癌患者而言。由于脑转移细胞存在于具有生理特殊性的保护性脑屏障内,因此需要采取不同的治疗策略。
最新的研究显示,针对驱动基因的靶向疗法,如第三代EGFR TKI奥西替尼,第四代ALK TKI洛拉替尼等,已经给携带特定驱动基因的非小细胞肺癌患者带来了显著的脑部疗效。此外,先进的影像技术、分子测序技术等的发展也为非小细胞肺癌脑转移的诊断和治疗提供了新的可能。
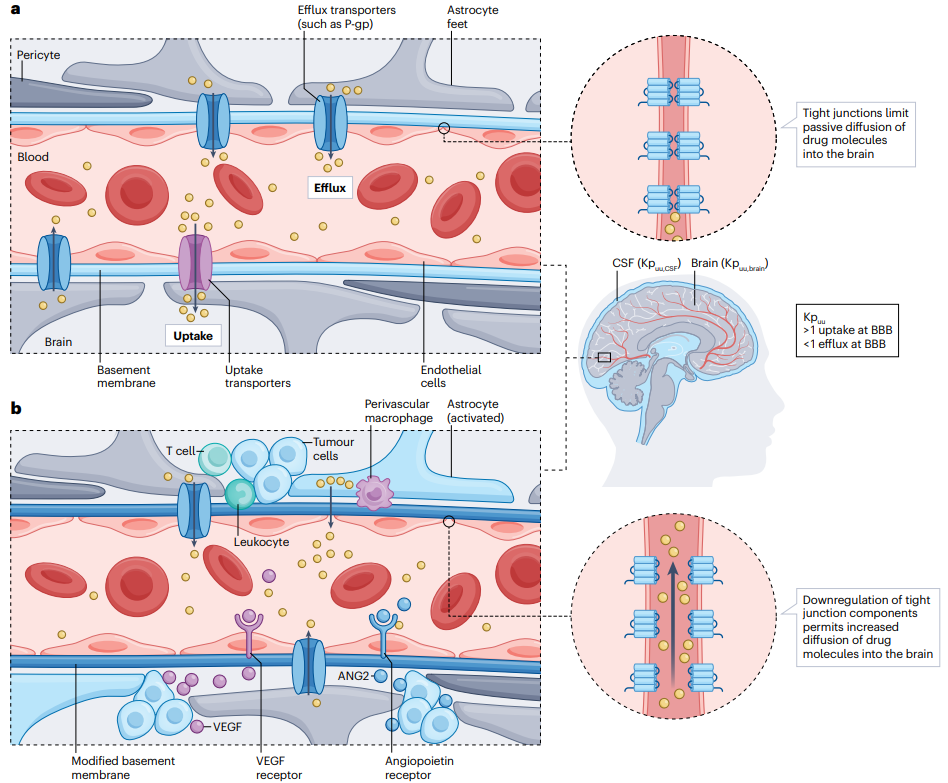
图1 | 血脑屏障和血肿瘤屏障的示意图。
血脑屏障(BBB)由衬覆在脑血管上的内皮细胞组成,这些细胞通过紧密连接相连,并能与星形胶质细胞、周细胞和微神经节相互作用(图1a)。
紧密连接通常限制大多数分子通过细胞间扩散进入中枢神经系统。内皮细胞上表达的极化转运蛋白能够选择性地转运一系列底物,包括信号蛋白、碳水化合物、脂肪酸、氨基酸和离子,从而保护大脑免受病原体和毒素的侵害,同时确保对必需营养素的获取。
通过各种转运蛋白,包括ATP结合盒转运体家族的成员,进行主动运输,或者通过其他分子的浓度梯度逆向移动。对于缺乏特定转运蛋白的小分子,它们必须通过细胞间或跨细胞扩散被动地穿越BBB,这受到紧密连接对大多数分子的限制。
某些分子能够通过内皮细胞的被动跨细胞扩散穿越BBB。大分子(>400 Da)需要通过载体介导的转运穿越BBB。在细胞内化后,分子通过位于内皮、基底膜、淋巴系统或通过酶代谢的主动转运体(如P-糖蛋白)上的外排泵从大脑排出。在脑转移患者中,保护性的BBB会受到破坏并转变为具有修改和更可变通透性的血肿瘤屏障(BTB)。
在BTB的内皮中通常会看到BBB紧密连接的丧失,这是由于肿瘤细胞分泌的血管内皮生长因子增加和缺氧诱导的血管生成,导致血管窗孔增多和血管通透性增加。周细胞和星形胶质细胞通常也会丢失,跨细胞运输成分的表达被下调(图1b)。
这种屏障功能的丧失使得某些大分子能够比完整的BBB进行更大的内吞穿透,这些大分子可能包括HER2靶向的抗体-药物偶联物(ADCs)和化疗药物,在鼠异种移植模型中已经观察到。
来自此类模型的数据表明,在脑内不同转移性病变之间,甚至同一病变的不同区域,药物浓度都有所不同,这很可能是由于细胞间通透性的变化。
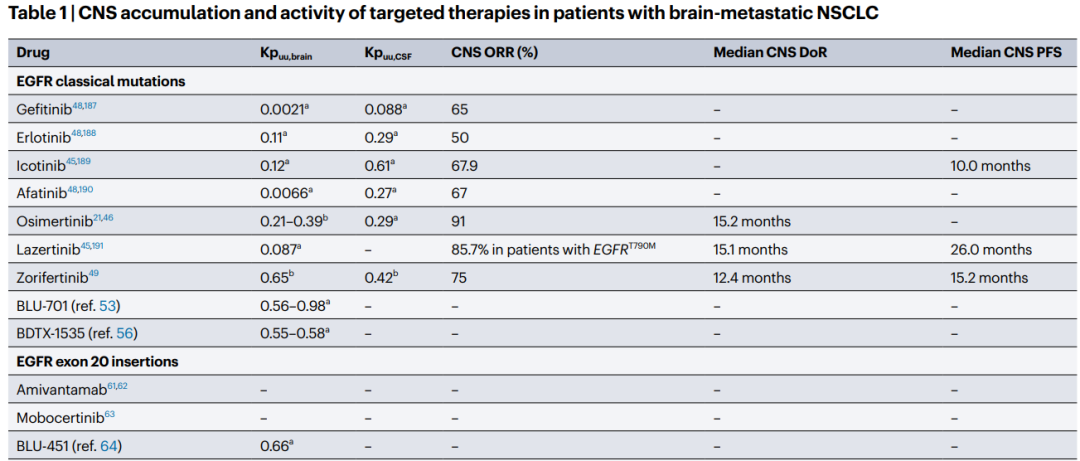
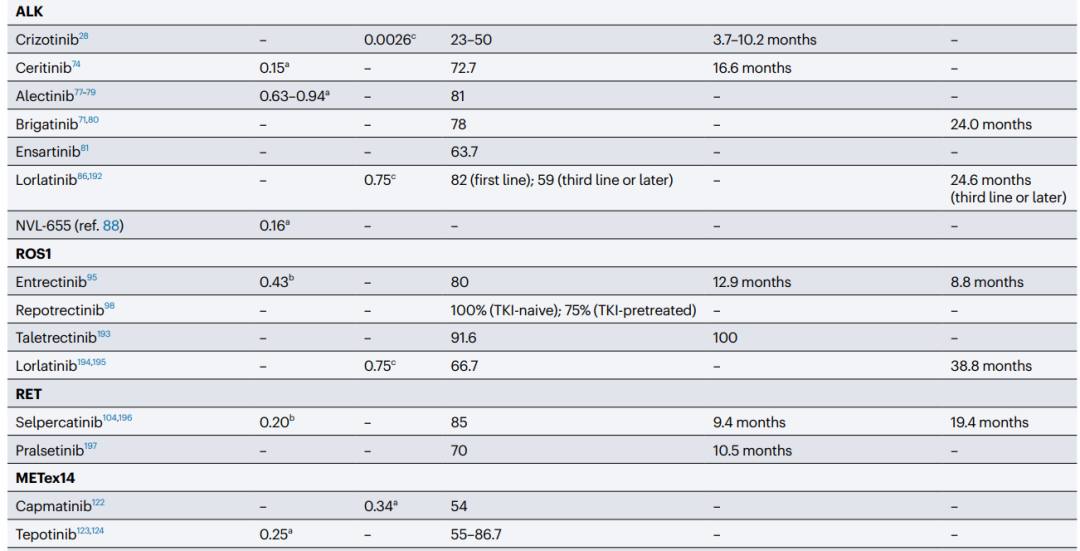
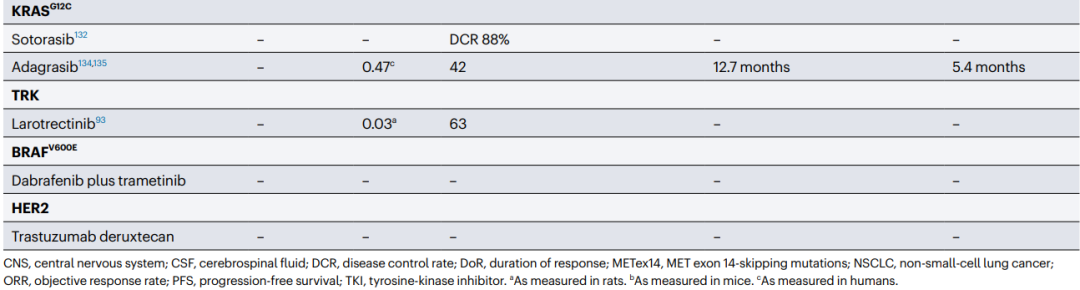
Table1 展示了在脑转移性非小细胞肺癌患者中,靶向治疗药物在中枢神经系统中的积累和活性。
- Kpuu,即未结合的分配系数,越来越多地被用于定量研究中的药物积累。
- Kpuu,brain,表示脑-血浆未结合分配比,定义为脑实质中游离药物浓度与稳态时血浆中相同药物的游离浓度的比值。
- Kpuu,CSF,即脑脊液(CSF)-血浆比,表示CSF中未结合药物浓度与血浆在平衡时的比值。
CSF药物浓度可以较好地估计脑外细胞液中的浓度,但不是精确的脑实质药物积累的测量,因为Kpuu,CSF值通常略高于Kpuu,brain。这种差异被认为反映了BBB上的主动外排转运体从脑实质清除药物。
尽管CSF是最容易取样的CNS样本,但Kpuu,CSF可能并不完全代表脑实质内的药物浓度。Kpuu值大于0.3反映了BBB穿透性的高水平。
随着新一代TKI在中枢神经系统中的疗效达到前所未有的水平,现在为某些亚型NSCLC患者的脑转移提供了非常好的系统性治疗选择。这些药物包括针对经典EGFR突变(奥希替尼)、ALK重排(阿来替尼、布利格替尼和洛拉替尼)、RET重排(塞普卡替尼)和ROS1或NTRK重排(恩特瑞替尼)的靶向药物,每种患者人群的中枢神经系统客观缓解率(ORR)均可达到或超过80%。奥希替尼是一种第三代EGFR TKI,对T790M变异体和经典激活突变具有活性,其BBB穿透性优于早期TKI。奥希替尼目前是转移性EGFR突变型NSCLC患者的首选一线治疗标准。奥希替尼是P-糖蛋白的弱底物,因此具有较低的BBB流入:流出比,从而具有较高的CNS穿透性。来自预临床研究的数据支持这一观察,Kpuu,brain为0.21-0.39。
实际上,第二代ALK TKI阿来替尼、布利格替尼似乎比克唑替尼或系统性化疗具有更好的CNS穿透性。阿来替尼在III期ASCEND-4试验中与化疗相比,在中枢神经系统中的疗效要优越得多(表1)。这可能可以解释为阿来替尼的CNS穿透性优于色瑞替尼(Kpuu,brain为0.63-0.94),反映了该药物不是P-糖蛋白的底物。来自III期ALEX试验的数据证实了阿来替尼在有无症状可测量脑转移或LMD的患者中的令人印象深刻的颅内活性,颅内ORR为81%。2020年的一项更新报道,阿来替尼的中位PFS为25.4个月,而克唑替尼为7.4个月。布利替尼在有基线可测量脑转移且无LMD的患者中,与阿来替尼相比,具有相似的全身和颅内活性,正如在该人群中布利替尼的中位PFS为24.0个月,而克唑替尼为5.6个月所示。
作为P-糖蛋白的弱底物,恩特瑞替尼具有良好的CNS穿透性,这由其低顶端外排比和Kpuu,brain为0.43所指示。ALKA-372-001、STARTRK-1和STARTRK-2试验的综合分析确认了在基线时有可测量CNS疾病的患者中持续的颅内活性(颅内ORR 55%;颅内反应持续时间中位数为12.9个月)。雷帕替尼和塔雷替尼都是下一代ROS1 TKI,临床数据显示,它们在颅内活性方面令人印象深刻,包括颅内ORR分别为100%(特别是对TKI初治患者)和91.6%,尽管是在患者样本量较小的队列中。

Box 1. 评估转移性癌症患者中中枢神经系统(CNS)药物的FDA建议:
1 患者群体:中枢神经系统(CNS)的反应率应该在整体疾病负担的背景下进行评估,无论试验人群中CNS转移的发生率如何。可能不适用于CNS特定的批准。
2 可用的治疗方案:对于特定原发肿瘤类型的转移性疾病(如ALK重排非小细胞肺癌),已获得批准的疗法(如ALK抑制剂)将被优先考虑。
3 以前的疗法:尝试收集以前干预的信息,包括中枢神经系统定向手术、立体定向放射外科和全脑放疗的时间和反应率。指定中枢神经系统定向治疗完成与研究入组之间允许的间隔长度(通常至少为12周)。包括一个额外的分层因素来最小化偏见。
4 CNS转移的评估:使用实体瘤反应评价标准(RECIST)或神经肿瘤学脑转移反应评估。
5 研究终点:首选终点是时间到事件和全因死亡率。应使用客观缓解率或无进展生存期(PFS)作为终点,不仅包括客观缓解率或无进展生存期(PFS),还包括中枢神经系统特异性的终点形式,并由独立专家进行盲法审查。还应规定中枢神经系统PFS与全身PFS的进展,以防止 censoring。
6 脑膜疾病:脑膜疾病应通过MRI和/或脑脊液分析进行确认和监测,以进行反应评估。
参考文献
Pan et al. Emerging therapeutics and evolving assessment criteria for intracranial metastases in patients with oncogene-driven non-small-cell lung cancer. Nat Rev Clin Oncol. 2023 Oct.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#非小细胞肺癌# #脑转移#
28