治疗慢性淋巴细胞白血病,双特异性γδ T细胞结合抗体LAVA-051获得FDA孤儿药认证
2021-10-16 Allan MedSci原创
临床阶段生物技术公司LAVA Therapeutics NV今天宣布,美国食品和药品监督管理局(FDA)已授予该公司靶向CD1d的LAVA-05的孤儿药认证(ODD)。
临床阶段生物技术公司LAVA Therapeutics NV今天宣布,美国食品和药品监督管理局(FDA)已授予该公司靶向CD1d的LAVA-05的孤儿药认证(ODD),用于治疗慢性淋巴细胞白血病(CLL)。
CLL是一种惰性淋巴组织增生性疾病,其特征是异常淋巴细胞在外周血、骨髓和淋巴组织中进行性积累,其中单克隆B淋巴细胞 (>5 x 10⁹/L [>5 x 10³/μL]) 主要见于外周血中(图1)。如果这些癌细胞主要见于淋巴结中,则该疾病被称为小淋巴细胞性淋巴瘤。
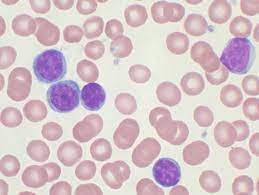
图1.外周血中的单克隆B淋巴细胞
LAVA-051是一种双特异性抗体,通过优先激活 Gamma Delta T 细胞和 1 型自然杀伤 T (NKT) 细胞,以招募免疫系统来攻击表达 CD1d 的癌细胞。LAVA-051 由两个单域抗体组成,它们通过一个短的五个氨基酸的甘氨酸-丝氨酸接头连接。CD1d 是一种糖蛋白,参与向不同的 T 细胞群(包括 1 型 NKT 细胞)呈递(糖)脂质抗原,并且可以表达在多种血液系统恶性肿瘤(包括 CLL、MM 和 AML)细胞中。
该公司的开放标签、多中心、I/IIa期临床试验正在进行招募患者,用于治疗复发性和/或难治性 CLL、多发性骨髓瘤 (MM) 以及急性髓系白血病 (AML)( NCT04887259)。该试验于2021年7月启动,旨在评估LAVA-051的安全性、耐受性、药代动力学、药效学、免疫原性和初步抗肿瘤活性。该研究I期剂量递增阶段的数据预计将在2022年上半年公布,IIa期扩展队列的顶级临床数据预计将于 2022 年下半年公布。
LAVA Therapeutics 总裁兼首席执行官 Stephen Hurly 说:“williamhill asia 很高兴收到 FDA 对 LAVA-051 的第一个孤儿药认证,这一指定将有助于加强williamhill asia 与 FDA 就开发 LAVA-051的沟通”。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#特异性#
40
#淋巴细胞白血病#
51
#淋巴细胞#
41