传统与现代、体内与体外多角度结合:党参抑制肝癌分子机制
2024-03-29 网络 网络 发表于上海
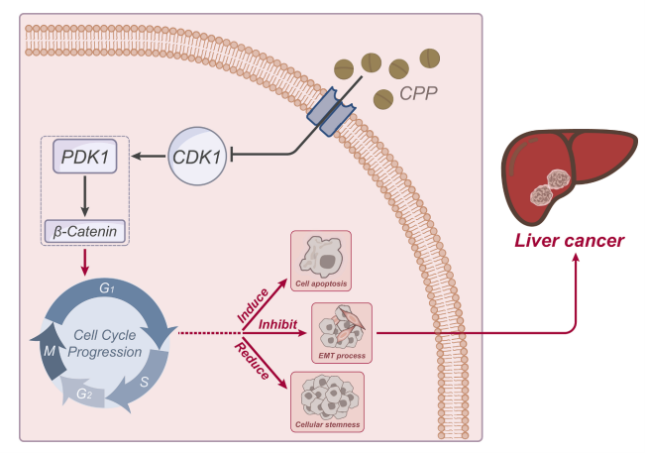
传统中药具有多靶点和广泛的治疗作用,已成为治疗各种肿瘤的潜在方法。党参作为一种草药,因其多方面的药理特性(包括抗炎和抗氧化作用)而备受关注。

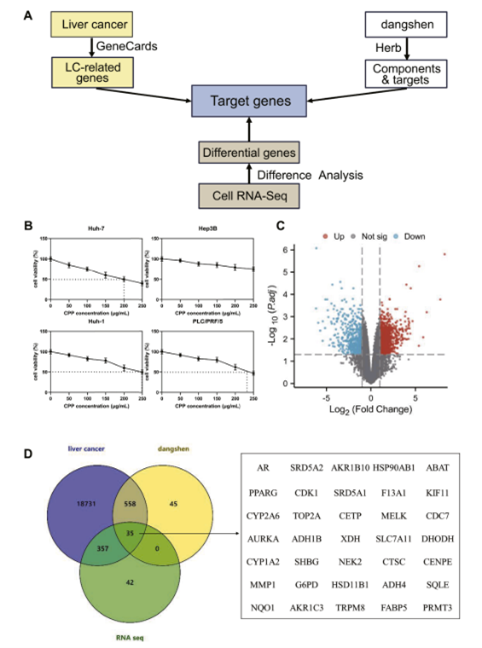
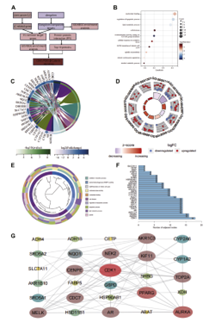
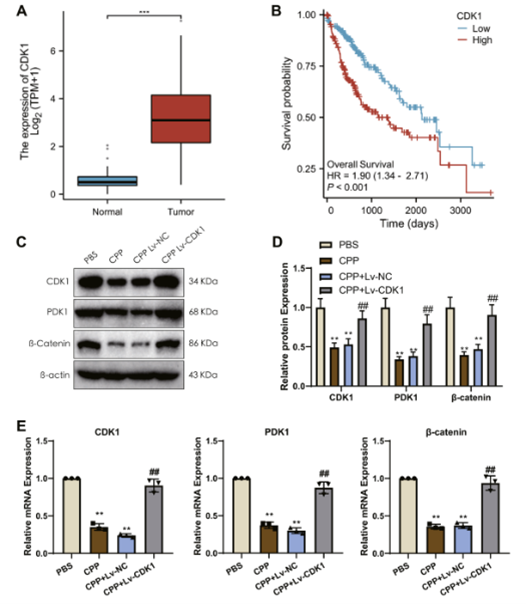
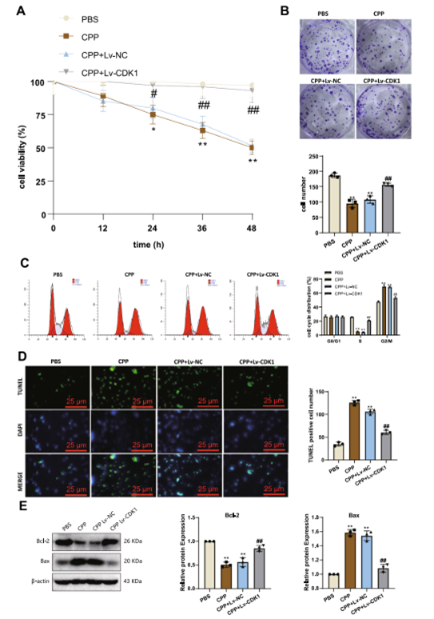
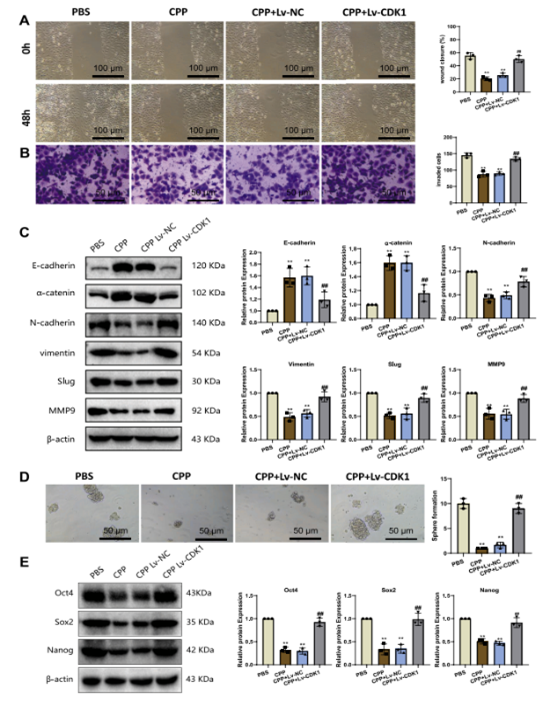
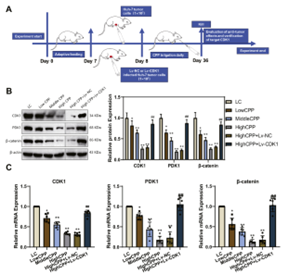
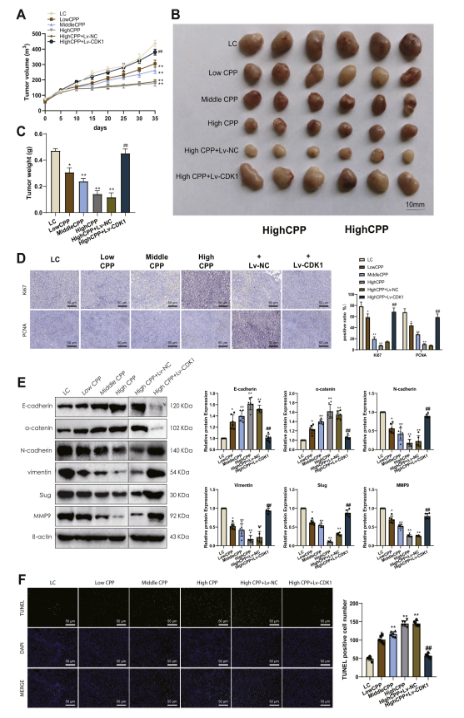
图5 CPP 对Huh-7 细胞增殖、细胞周期和凋亡的影响
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#肝癌# #党参#
36