预防性输注供者来源CD19 CAR-T细胞可减少高危B-ALL异基因移植后复发
2024-04-23 聊聊血液 聊聊血液 发表于上海
天津市第一中心医院赵明峰教授团队开展一项研究,首次探索了高危B-ALL患者allo-HSCT后预防性输注CAR-T细胞,发现可显著降低复发率且不良事件可控。研究结果近日发表于《Leukemia》。
ALL移植后CAR-T
复发是高危B细胞急性淋巴细胞白血病(B-ALL)移植失败的关键原因,但对于高危B-ALL患者,特别是Ph阴性B-ALL患者,用于预防异基因造血干细胞移植(allo-HSCT)后复发的维持治疗还没有很好的措施。供者来源抗CD19 CAR-T细胞疗法已经成为B-ALL患者allo-HSCT后的一种成功挽救治疗或抢先治疗策略,因此,在allo-HSCT后预防性输注CAR-T细胞可能是消除高危B-ALL患者残留白血病细胞的潜在策略,从而在完全免疫重建之前降低复发风险。
天津市第一中心医院赵明峰教授团队开展一项研究,首次探索了高危B-ALL患者allo-HSCT后预防性输注CAR-T细胞,发现可显著降低复发率且不良事件可控。研究结果近日发表于《Leukemia》。

研究结果
共23例高危B-ALL患者在allo-HSCT后接受预防性供者来源CAR-T细胞输注(ChiCTR 2000041025和ChiCTR-ONN-16009862)(称为CAR-T组),此外还回顾性纳入44例未接受移植后维持治疗的高危B-ALL患者作为对照组。主要终点为CAR-T细胞治疗的安全性,次要终点为累积复发率、无进展生存期(PFS)和总生存期(OS)。
CAR-T组中位细胞输注剂量为2.0×106/kg(范围1.0-4.9 ×106/kg),从移植到CAR-T细胞治疗的中位时间为122天(65-315)。其中16例(69.6%)在诊断时具有高危细胞遗传学或分子谱,7例为Ph+ B-ALL。CAR-T组中有7例(30.4%)患者在接受allo-HSCT时存在可检测到的微小残留病(MRD)或活动性疾病,而对照组中有11例患者存在MRD;这部分患者allo-HSCT后复发的风险很高。CAR-T治疗组和对照组患者的主要临床特征具有可比性(表1)。
与CAR-T细胞治疗相关的毒性见下表。细胞因子释放综合征(CRS)是主要的非血液学毒性,47.8%的患者发生1/2级CRS,没有3-4级CRS。CRS发作的中位时间为1天(0-6天),中位持续时间为2天(1-10天)。针对CRS, 3例患者需要升级类固醇治疗方案,2例接受托珠单抗治疗;没有患者需要入住ICU。此外,CAR-T细胞治疗后未发生ICANS。

血液学毒性是最常见和最严重的不良事件,95.7%的患者在CAR-T细胞输注后28天内至少出现单系血细胞减少。血细胞减少的中位发作时间为1.5天(1-9天),分别有65.2%、43.5%和21.7%的患者发生3-4级白细胞减少、血小板减少和贫血,与其他CD19 CAR-T细胞治疗的报告一致。大多数(13/22)血液学毒性可通过造血生长因子和支持治疗逆转,但9例患者在CAR-T细胞治疗后呈持续性血细胞减少,所有患者在强的松剂量增加后都表现出血细胞减少显著改善。干预后,66.7%(6/9)的患者白细胞计数恢复正常,55.6%(5/9)的患者血小板和血红蛋白水平恢复正常;白细胞减少、贫血和血小板减少的中位恢复时间(完全恢复或改善到2级)分别为12天(2-81天)、11天(2-98天)、22天(6-147天)。
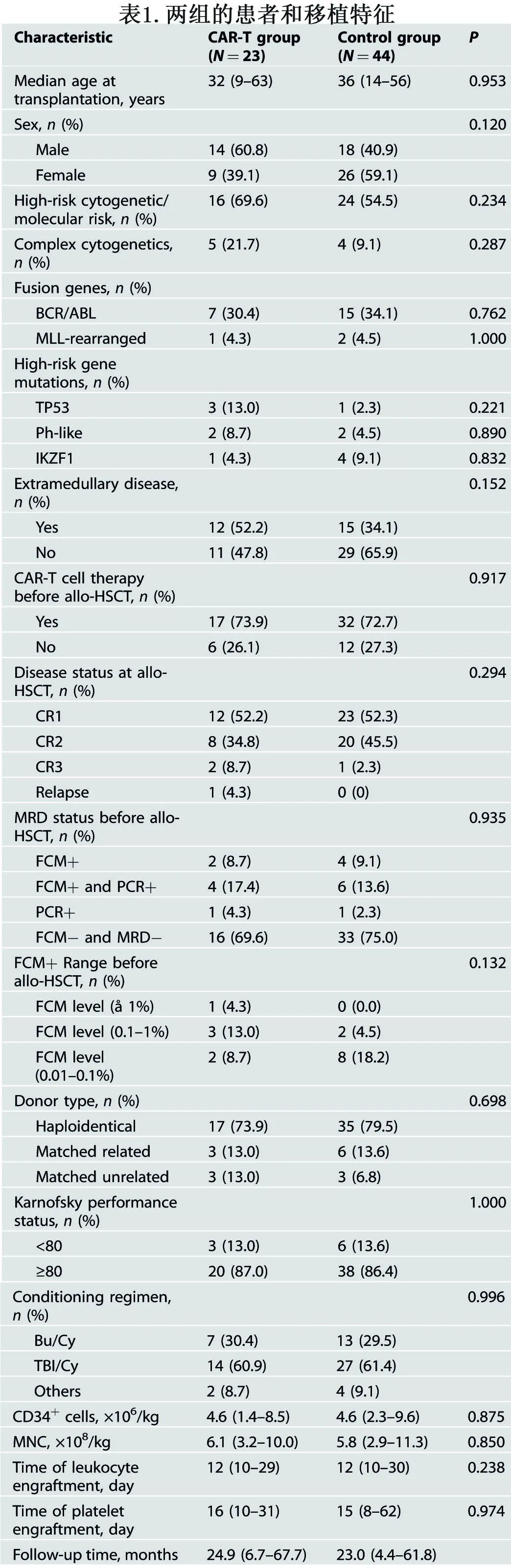
除了常规并发症,急性移植物抗宿主病(aGVHD)也是异基因CAR-T细胞治疗的主要关注点,有研究报道供者来源CD19 CAR-T细胞的aGVHD的发生率较低。在本研究中,3例患者在CAR-T细胞输注后发生aGVHD:2例为2级,1例为3级。CAR-T细胞输注后的中位发作时间为20天(7-25天)。奇怪的是,三例aGVHD患者中有两例在CAR-T细胞输注前已经停止基础泼尼松龙治疗(它可能导致发生aGVHD)。感染是另一个严重问题,有三例患者死于各种感染(真菌、败血症和COVID-19)。然而,CAR-T治疗组和对照组的2年非复发死亡率相当(10.3% vs. 14.4%,P=0.847;下图)。
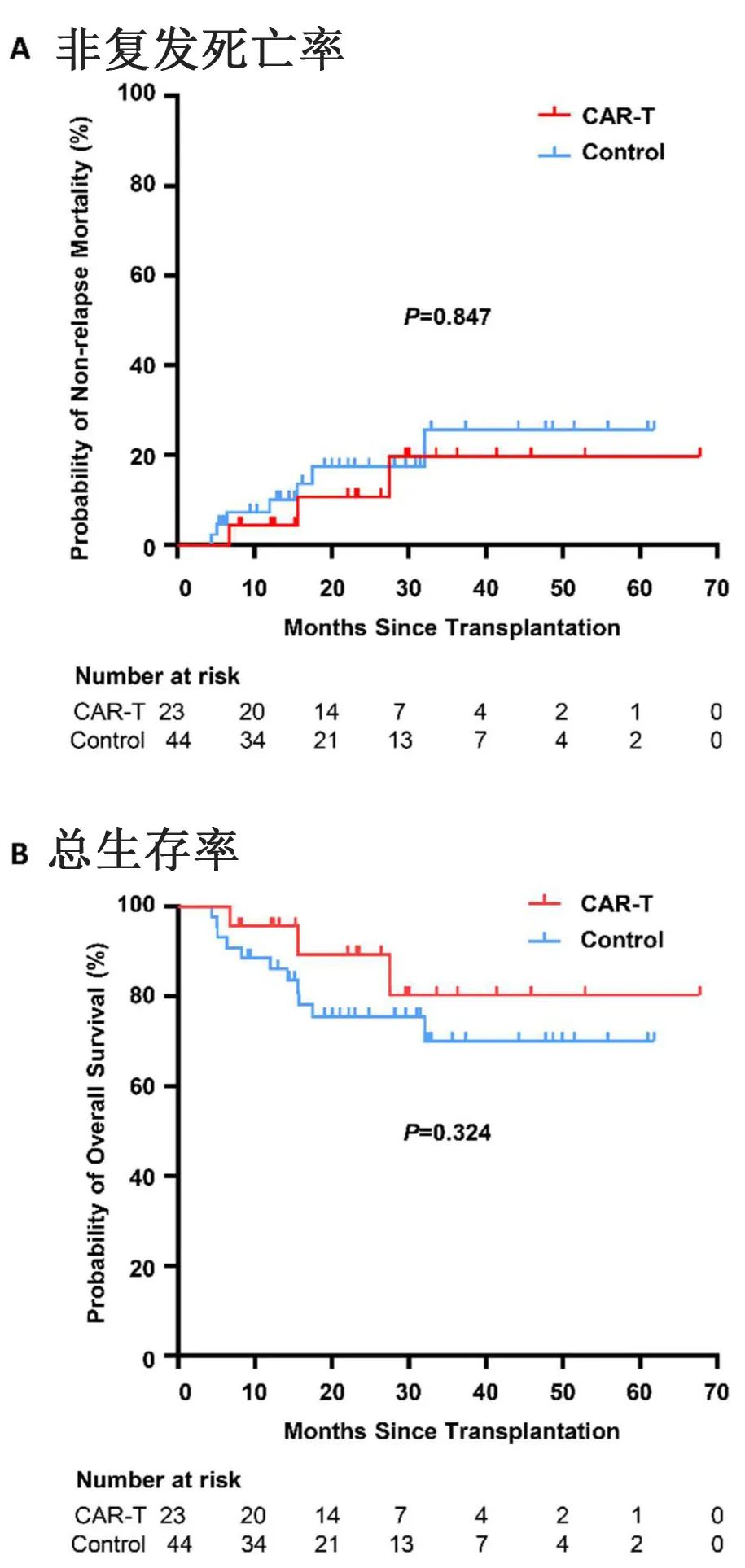
末次随访时,CAR-T组只有1例患者出现髓外复发,2年累计复发率显著低于对照组(5.6% vs 28.8%,P=0.026,图1A, B)。值得注意的是,复发时患者的骨髓和脑脊液均处于缓解状态,因此CAR-T治疗后髓外复发的原因需要进一步研究。此外,CAR-T组的2年PFS率更高(84.0% vs. 57.3%,P=0.042,图1C),但两组的2年OS率无统计学差异(89.3% vs. 75.4%,P=0.324;上图),可能是由于该研究的样本量较小;此外大多数复发患者接受了先进的挽救性治疗,如挽救性CAR-T细胞治疗、抗CD22抗体和抗CD38抗体,可能是另一个因素。过渡到这些创新挽救治疗可能需要更长的随访期,以充分了解预防性CAR-T细胞治疗对总生存率的影响。

作者选择预防性CAR-T细胞治疗7例Ph+ ALL患者,而非传统TKI治疗,是因为2例患者对TKI耐药或发生不良反应,以及CD19 CAR-T细胞在根除难治性和残余白血病细胞方面的疗效。患者严格监测MRD、CAR-T持久性和B细胞发育不全(aplasia),如果CAR-T和B细胞发育不全消退,建议补充TKI治疗以降低复发风险。所有7例接受移植后单纯CAR-T细胞维持治疗的Ph+ B-ALL患者都保持持久缓解,表明CAR-T可能是移植后Ph+ ALL患者TKI的替代方案。
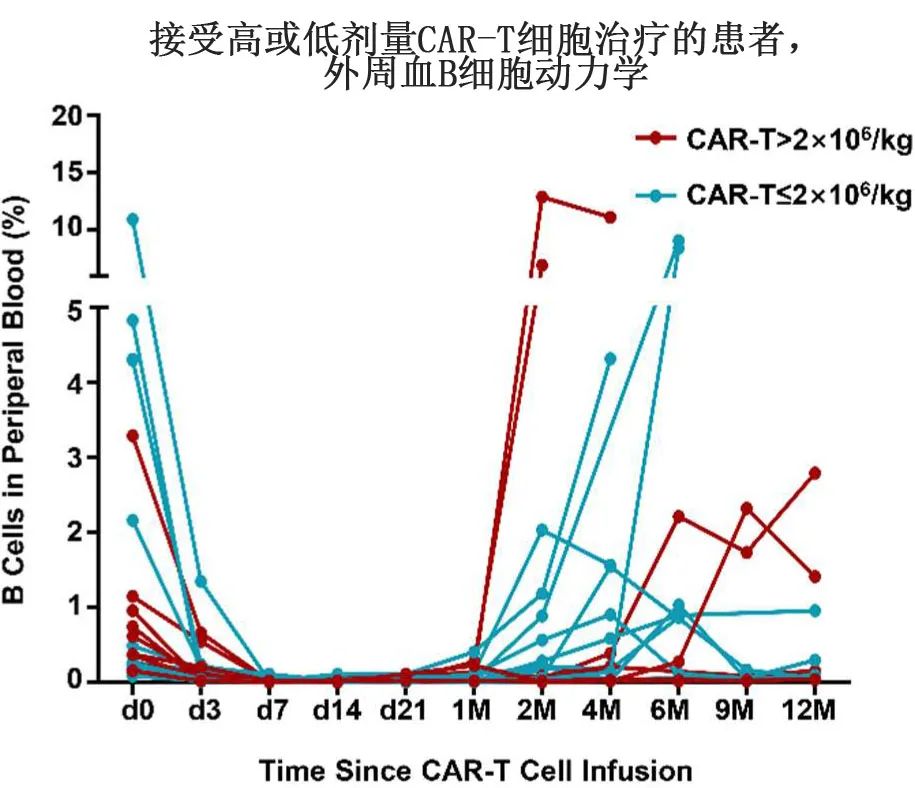
作者进一步监测了患者体内CAR-T细胞和相关生物标志物的动力学。如图1D所示,CAR-T细胞扩增的中位峰出现在第7天(3-14),大多数在第28天无法检测。重要的是,未观察到CAR-T细胞的增殖和持久性在剂量>和≤2×106/kg之间的差异(图1D);且血清IL-6和CRP的峰值水平没有明显差异,表明输注细胞剂量与CAR-T细胞的增殖以及细胞因子反应之间不存在相关性(图1E、 F)。
Oink蛋白质组学分析进一步揭示了CAR-T细胞输注后血清中SIT1、CD28和IL2RB蛋白水平的显著上调。KEGG分析显示差异表达蛋白与JAK-STAT和PI3K-AKT通路相关。这些数据表明,移植后预防性输注供者来源CAR-T细胞也可能激活重要的免疫信号通路。

CAR-T细胞输注后的B细胞发育不全中位持续时间为233天(39-995天),或可间接反映出CD19 CAR-T细胞的疗效。
总结
该研究首次在高危B-ALL中探索allo-HSCT后预防性输注供者来源CAR-T细胞,证明是一种可行的策略,可以实现持久缓解,且治疗相关毒性可接受。该策略值得在更大规模的前瞻性随机多中心研究中进一步验证,以支持预防性CAR-T细胞治疗在高危B-ALL患者中的应用,特别是对于异基因造血干细胞移植之前或之后MRD阳性的患者。
参考文献
Lu, W., Lyu, H., Xiao, X. et al. Prophylactic donor-derived CD19 CAR-T cell infusion for preventing relapse in high-risk B-ALL after allogeneic hematopoietic stem cell transplantation. Leukemia (2024). https://doi.org/10.1038/s41375-024-02251-5
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#急性淋巴细胞白血病# #B-ALL# #CAR-T细胞#
34