重庆医科谢国明教授/王力博士ACS Nano:结直肠癌KRAS突变检测新方法
2024-05-10 BioMed科技 BioMed科技 发表于上海
研究了两种获得活性双链的方法:阻碍基团介导的PCR和可裂解单元介导的PCR,并将其直接用于SNV的检测。
KRAS基因突变:结直肠癌的关键密码
结直肠癌(CRC)是全球第二常见癌种,在我国位居恶性肿瘤的第3位。且约40%的患者确诊时已表现为转移性结直肠癌(mCRC)。CRC的特殊驱动基因突变包括了KRAS、BRAF和TP53基因突变,其中KRAS的突变与下游多种通路的激活息息相关,包括RAF-MEK-ERK通路、PIK3/mTOR信号通路等,与CRC的发生、发展、治疗和预后密切相关。KRAS突变是抗EGFR疗效有效性的预测标志物。CRC患者约80%的KRAS突变发生于密码子12、13和61。G12D和G12V是CRC中最常见的两种突变亚型。针对KRAS突变CRC的治疗一直充满挑战。KRAS上游信号调节会因其突变而中断,从而导致该类患者对受体酪氨酸激酶抑制剂产生耐药,如针对EGFR的单克隆抗体西妥昔单抗和帕尼单抗的耐药。总之,KRAS突变在结直肠癌中扮演着关键角色,影响着其发生、发展、治疗和预后,尤其在抗EGFR疗效预测和治疗方面具有重要意义。
双链DNA中的突变检测
基因序列中的单核苷酸变异(SNV)是多种癌症发生、发展和诊断的关键驱动因素,也是精准医学的重要标志物。准确检测SNV可以为患者提供最佳的个性化治疗。沃森-克里克碱基配对的自然性质使DNA成为一种强大而独特的工程材料,互补核酸之间的特异性杂交使单碱基变化得以识别。在作者前期的研究工作中,作者发现基于双链链置换的策略,可以最小化环境中其他核酸的干扰,并且可以同时识别正义链和反义链上形成的错配气泡。然而,PCR 产物通常是双链 DNA并且处于非活性状态,不能直接与探针杂交。因此,最大限度地保存临床样本中的信息完整性并实现双链 DNA 中突变的直接检测具有重要的意义。
阻碍基团与可裂解单元介导的PCR
近日,重庆医科大学检验医学院谢国明教授与重庆医科大学附属第一医院分子检测中心王力博士合作,提出了两种获得活性双链的方法:阻碍基团介导的PCR和可裂解单元介导的PCR,并将其直接用于SNV的检测。相关研究成果以“Modified Unit-Mediated Strand Displacement Reactions for Direct Detection of Single Nucleotide Variants in Active Double-Stranded DNA”为题发表在ACS Nano。
【文章要点】
首先,作者在toehold和分支迁移区域之间引入了C3和SS或用RNA替换Toehold区域的DNA(图1)。通过研究阻碍基团对单链链置换和双链链置换的影响,作者发现阻碍基团对于ssSDR的影响较小,而对于dsSDR的影响较大。随后,作者测试了它们对于三种不同位置突变的鉴别能力。结果显示与单链链置换反应相比,双链链置换反应表现出优越的特异性,这个结论在不同的突变位置和温度下都成立。通过探讨toehold长度对阻碍基团介导的SDR的影响,作者发现toehold长度对于C3和SS修饰介导SDR的动力学和热力学会有更显著影响。
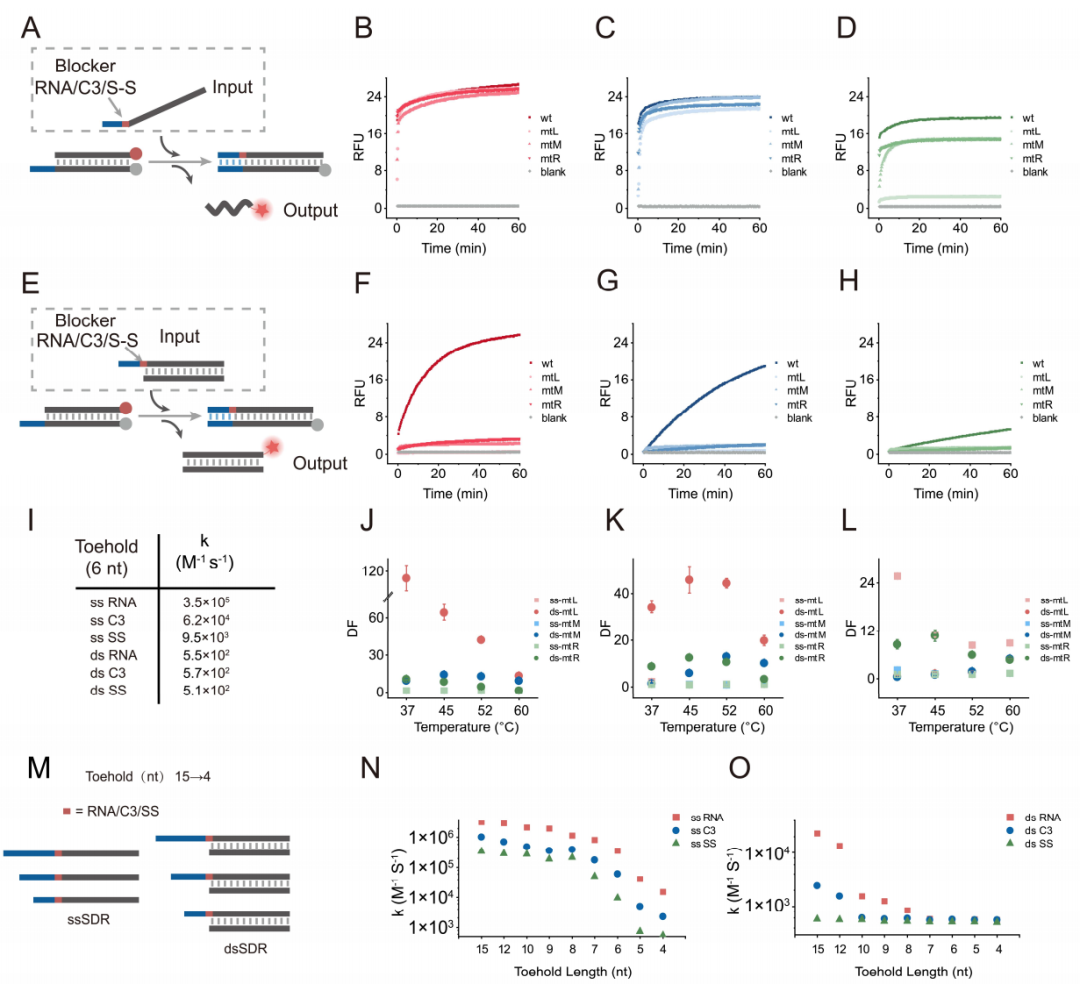
图1 阻碍基团介导的SDR。
对于可切割单元,作者选择了UDG和Nickase进行概念验证(图2)。同样地,作者也测试了它们在不同温度下对三种不同位置突变的特异性。与阻碍基团介导SDR类似,在不同温度和突变类型下,dsSDR的特异性比ssSDR的特异性更佳。为了进一步展示dsSDR的优越性,作者在不同的toehold长度和不同突变位置上探索了其特异性,得出了类似的结论。以上结果都表明,即使在没有热力学微调的情况下,修饰单元介导的dsSDR在区分SNVs方面表现更佳。
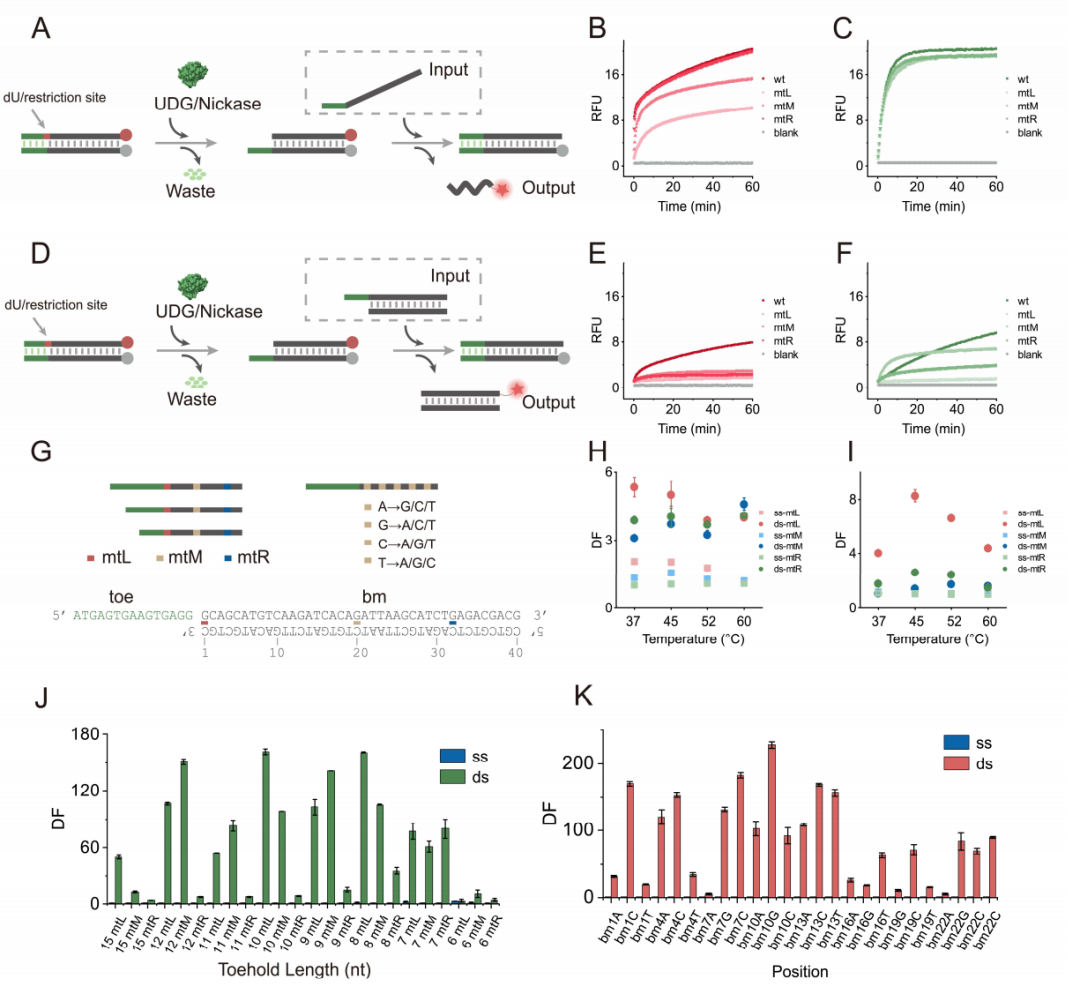
图2 可切割单元介导的SDR。
在确认修饰单元对SDR的影响后,作者进一步将修饰单元嵌入至引物中,构建修饰引物介导的PCR(MU-PCR)(图3)。在存在阻碍基团的情况下,聚合酶无法识别,导致在toehold区域(蓝色)扩增终止。因此,直接产生活性双链。当存在可切割单元时,修饰单元不会阻碍聚合酶的延伸,允许PCR扩增。扩增后,使用UDG来消化dU碱基或使用Nickase来消化切割酶序列,暴露toehold区域,从而产生活性双链产物。两种策略都是在引物中的非靶标结合区域设置修饰单元,其序列从靶标序列中独立,因此,PCR后产生的toehold区域的长度与序列能够被自由控制。鉴于使用C3和S-S所需的温度更高,作者选择了RNA、UDG和Nickase进行后续的dsSDR实验。在对关键参数进行了优化后,作者将其用于突变丰度的检测。结果显示即使初始模板混合物中仅存在0.1% 的预期目标等位基因,仍然可以观察到荧光信号的统计学显著差异。因此,作者证明了修饰单元可以与PCR扩增进行集成,生产含有活性toehold的双链复合物并用于后续的dsSDR。
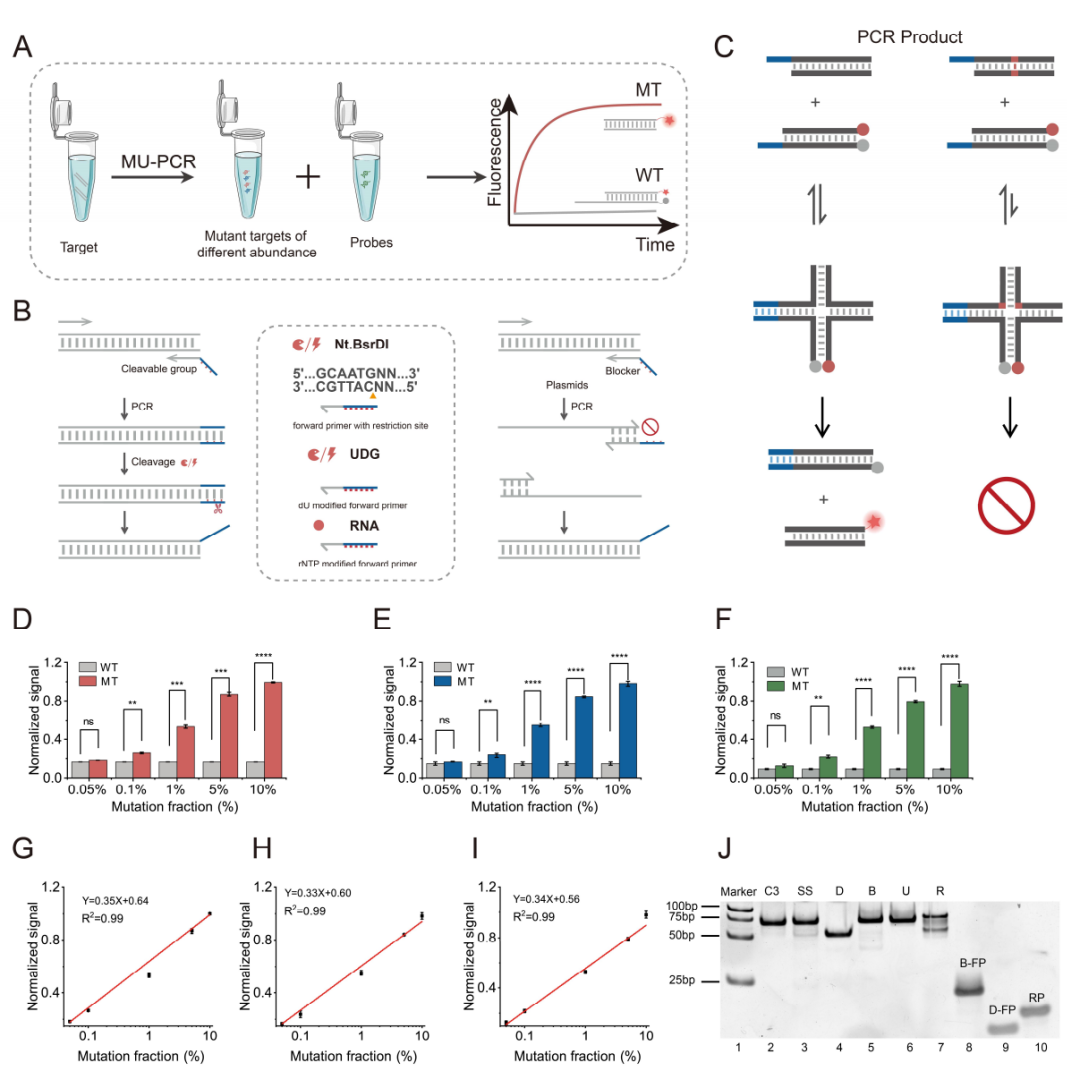
图3 修饰单元分析策略用于SNVs检测。
准确诊断KRAS突变可以帮助为特定患者选择最合适的个体化抗癌治疗,因此作者选择了KRAS基因作为作者的模型基因。用该策略对合成的KRAS突变和野生型的质粒进行正交性测试(图4)。结果表明,三种不同引物介导的PCR和随后的dsSDR都能够准确识别突变类型,表现出良好的正交性,且与Sanger测序结果一致。这表明了作者的方法在实际样本检测中的潜力。
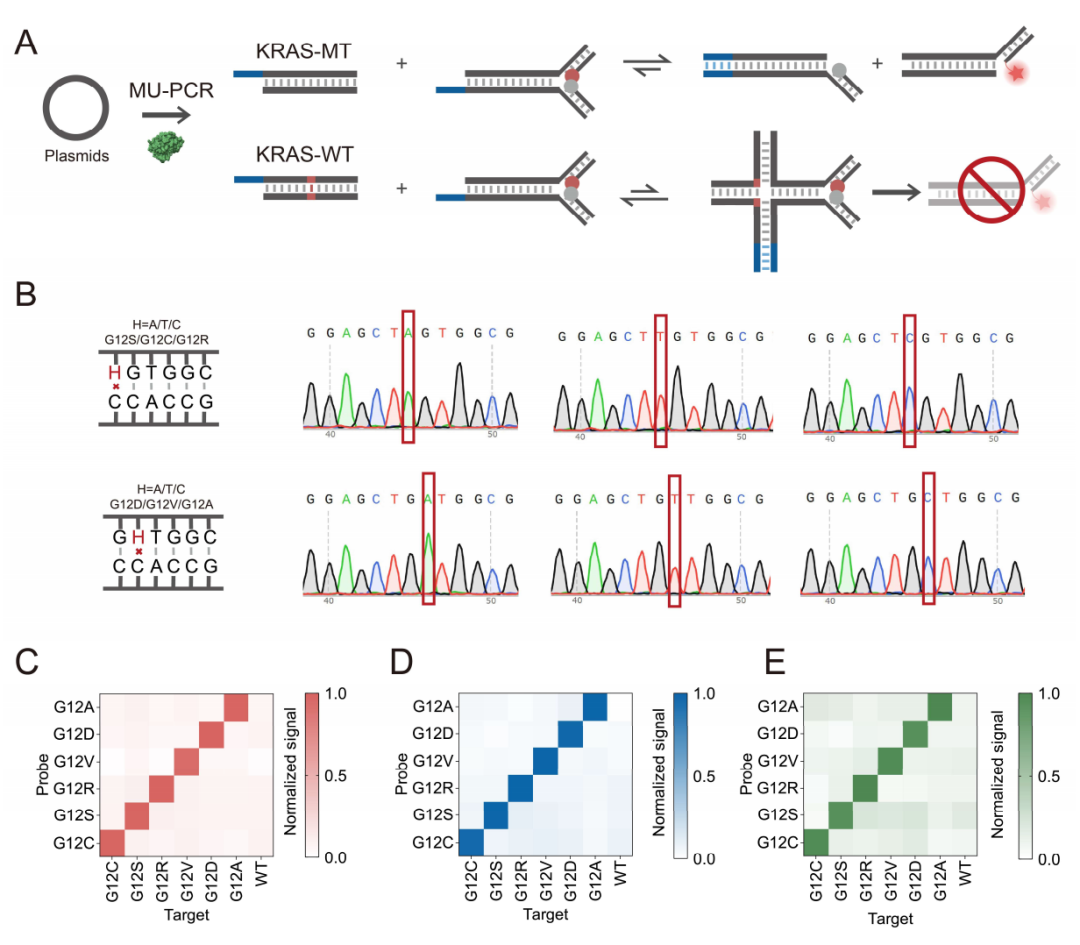
图4 质粒样本中KRAS SNV的正交性检测。
在验证了该策略在质粒样本中的正交性之后,作者进一步在实际临床环境中进行测试(图5)。对来自重庆医科大学附属第一医院的结直肠癌组织样本进行MU-PCR和dsSDR分析。作者在45个肿瘤组织样本中识别出31个KRAS阳性病例和14个阴性病例。所有样本均同时使用标准的Sanger测序进行验证。结果显示KRAS突变型的荧光值显著高于野生型人群。受试者工作特征曲线下面积为0.99。该策略的临床敏感性和特异性分别为94%和100%。以上结果验证了作者的方法在实际临床应用中的高度可行性和潜在的适用性。
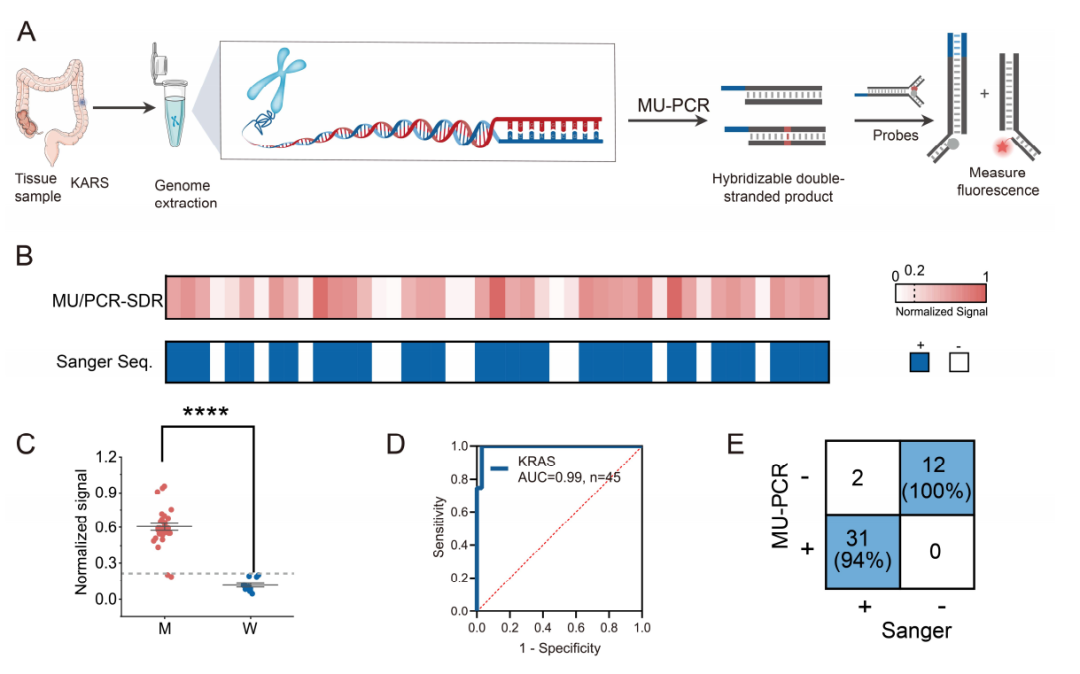
图5 MU-PCR和dsSDR分析临床结直肠癌组织。
【结论与展望】
作者在toehold域或者toehold区域与分支迁移区域之间加入了修饰单元(阻碍基团与可切割单元),形成了MU-SDR,并系统地验证了MU-SDR的动力学特点。MU-SDR中嵌入不同类型、不同位置的突变后的动力学变化,证明了dsSDR更优越的单碱基辨别能力。通过在引物中引入修饰片段使得PCR产物可以直接包含活性双链,这允许MU-SDR与PCR的完美衔接。模拟样品和质粒样品的检测证明所提出的策略可以轻松应用于复杂序列的检测,并可以识别低至0.1%的丰度。此外,该策略在识别不同KRAS突变时显示了良好的正交性。最后,45例KRAS突变临床样本中的检测展示出几乎与Sanger测序结果的一致性,进一步证明了其实际应用潜力。
作者所提出的活性双链获取策略具有以下几个优点:(1)与大多数用于获取具有杂交活性的单链目标的检测方法相比,双链靶标由于其主要组成部分是互补的双链,具有更强的更稳定。(2)从临床样本中直接获取活性双链可以最大限度保护双链核酸中的生物学信息,具有更高的突变鉴别能力。(3)作者预计作者的方法还可以拓展至更多的检测系统(如无PAM的CRISPR Cas检测和分支迁移探针等系统)。
原文链接:
https://doi.org/10.1021/acsnano.4c01511
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














好文章,谢谢分享。
42
#结直肠癌# #KRAS突变#
44