《浙江省新型冠状病毒感染临床用药建议》发布!
2023-01-16 浙江药事质控中心 浙江药事质控中心 发表于安徽省
包括奈玛特韦片/利托那韦片组合包装、莫诺拉韦胶囊、阿兹夫定片。
基于疫情防控政策调整后我省在新型冠状病毒感染临床救治中常见的药物治疗问题,浙江省医院药事管理质控中心组织药学专家、临床专家进行论证,以临床问题为出发点,基于目前循证医学证据及临床实践,结合抗病毒治疗药物的药学特性,形成并发布《浙江省新型冠状病毒感染临床用药建议》(第一期),本期主要关注国内现有口服抗新冠病毒药物(奈玛特韦片/利托那韦片组合包装、莫诺拉韦胶囊、阿兹夫定片)的临床应用问题,推动新冠抗病毒药物在临床的精准应用,有效保障各类患者的用药安全,提升药物治疗水平。
考虑到新发临床问题的出现、临床证据更新以及国内药物的可及性等,本建议将定期动态更新。
浙江省新型冠状病毒感染
临床用药建议
2023/01/09
一、奈玛特韦片/利托那韦片组合包装的临床问题及药学建议
-
临床问题一
新型冠状病毒感染确诊超过5天,是否还需启用奈玛特韦片/利托那韦片组合包装抗病毒治疗?
推荐意见:
(1)对于轻型/中型患者,发病>5d,在药物可及性受限的情况下,原则上不推荐使用。
(2)对于重型/危重型患者,发病>5d但新冠病毒核酸ct值<30者,应用抗病毒药物仍可能有一定获益。
推荐依据:
奈玛特韦片/利托那韦片组合包装目前在我国属于附条件批准,作用机制为抑制病毒复制,而非直接杀灭病毒。说明书建议在新型冠状病毒感染确诊或出现症状后5天内尽快服用本品,连续服用5天。新冠病毒感染的第1-5天属于病毒快速复制期,所以需要在前5天内服用,越早效果越好。
对于重症(包括重型及危重型)患者,核酸ct<30提示体内病毒载量较高,发病超过5天,仍可尝试使用奈玛特韦片/利托那韦片组合包装,以降低死亡率。
-
临床问题二
已在用心血管疾病治疗药物的患者,能否同时服用奈玛特韦片/利托那韦片组合包装?
推荐意见:

推荐依据:
利托那韦对几种细胞色素P450亚型具有高度亲和力,可抑制CYP3A4和CYP2D6,诱导CYP2C9;同时对P-糖蛋白也具有一定的抑制作用。当奈玛特韦/利托那韦与通过这些途径代谢的药物联用时,会影响其疗效或增加不良反应的发生风险。
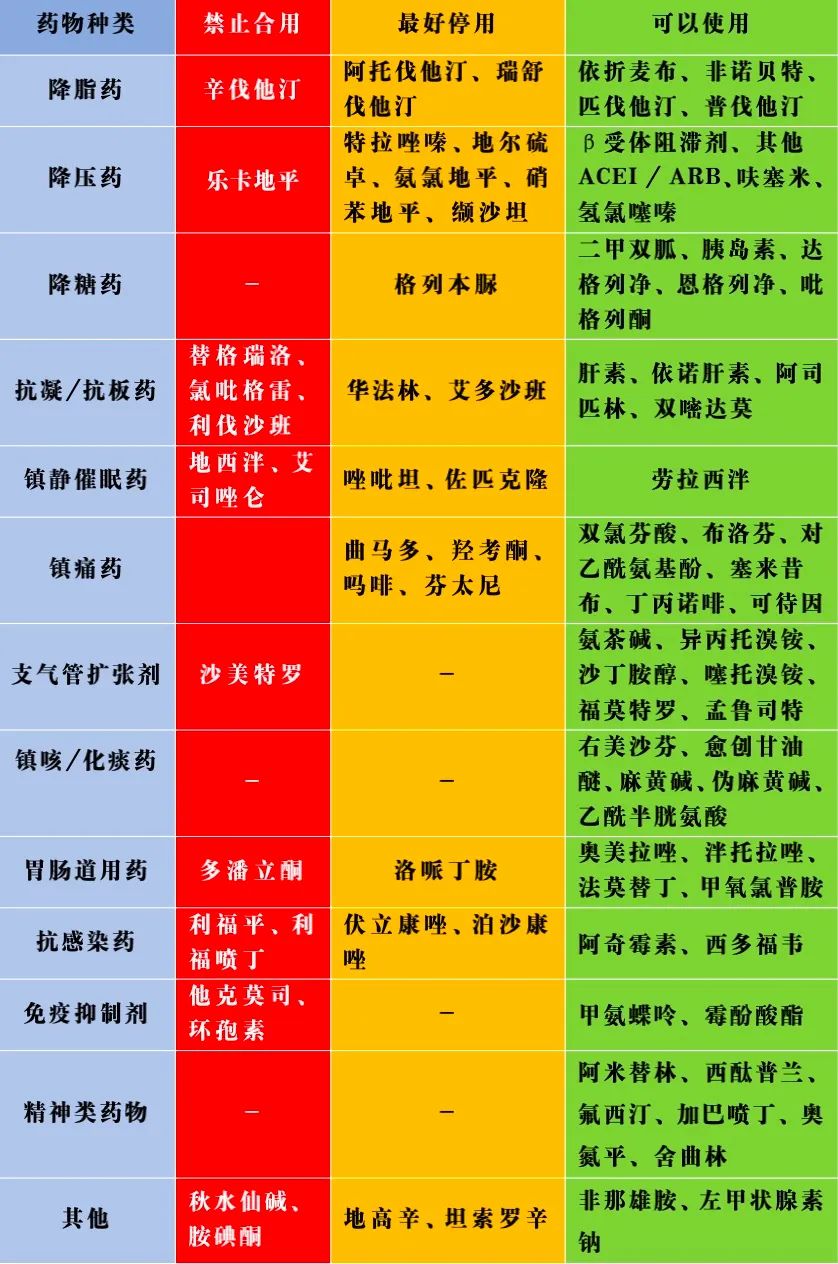
抗心律失常药物中的胺碘酮、决奈达隆和奎尼丁均由CYP3A4代谢,普罗帕酮被CYP2D6代谢。利托那韦与这些药物联用时可增加药物的血药浓度,增加心律失常的风险,甚至危及生命,因此临床上禁止联用。亲脂类他汀(辛伐他汀、洛伐他汀、阿托伐他汀)、大部分CCB类降压药物以及伊伐布雷定主要经由CYP3A4代谢,与奈玛特韦/利托那韦片联用可能会导致药物的血药浓度升高,增加不良反应的风险。部分ARB类药物(厄贝沙坦、氯沙坦)和托拉塞米主要由CYP2C9代谢,联用时会产生一定的相互作用,需加强监测。
由肝脏代谢的β受体阻滞剂(美托洛尔、普萘洛尔、卡维地洛)均是CYP2D6底物,但其与利托那韦联用时并未产生具有临床意义的相互作用;而ACEI类药物主要经过尿液排除,与奈玛特韦/利托那韦片无明显的相互作用,可安全使用。
-
临床问题三
已使用抗凝/抗血小板药物的患者,联用奈玛特韦/利托那韦是否需要调整用药?
推荐意见:
(一)抗凝药物

推荐依据:
尚未对抗凝药物与奈玛特韦/利托那韦联合给药进行研究,利伐沙班在肝脏中部分代谢(通过CYP3A4、CYP2J2),在尿液中部分原型消除(通过P-gp和BCRP),与利托那韦合用使利伐沙班AUC和Cmax分别增加153%和53%。因此,应避免同时给予利伐沙班与奈玛特韦/利托那韦。
阿哌沙班是CYP3A4和P-gp的底物,艾多沙班与达比加群酯是P-gp底物,联合给药导致出血的风险增加。在ENGAGE AF-TIMI 48(NCT00781391)中显示,艾多沙班剂量减少50%可与其他P-gp抑制剂(不包括利托那韦)联合使用。
达比加群酯(75 mg单剂量) 和奈玛特韦/利托那韦(300/100 mg,bid) 联合给药使达比加群酯Cmax和AUC分别增加133%和95%(n=24),剂量调整是基于达比加群酯和达芦那韦/考比司他的相互作用,与短期使用利托那韦相似。
华法林是由不同细胞色素代谢的对映体的混合物,其中R-华法林主要通过CYP1A2和CYP3A4代谢,而S-华法林(更有效)由CYP2C9代谢。利托那韦短期抑制CYP3A4,更可能导致国际标准化比值(INR)降低,因此需要频繁监测INR。相比之下,普通肝素和低分子肝素不被CYP450酶代谢,可与奈玛特韦/利托那韦共同给药。
(二)抗血小板药物

推荐依据:
尚未对抗血小板药物与奈玛特韦/利托那韦联合给药进行研究,替格瑞洛是直接P2Y12受体抑制剂,与CYP3A4强抑制剂 (如奈玛特韦/利托那韦)合用,会引起替格瑞洛暴露量大幅增加,导致患者出血风险增加,应避免联用。
氯呲格雷是一种前体药物,在体内需通过CYP3A4、2B6、2C19和1A2转化为其活性代谢产物发挥抗血小板作用,利托那韦为CYP3A4强抑制剂,利托那韦降低氯吡格雷活性代谢物的产生,氯吡格雷AUC减少51%,血小板抑制减少20%。
西洛他唑被CYP3A4和CYP2C19广泛代谢,并在较小程度上被CYP1A2代谢,利托那韦增加西洛他唑的药理活性,西洛他唑说明书中建议接受强效CYP3A4抑制剂的患者可剂量减少至50 mg bid使用。
-
临床问题四
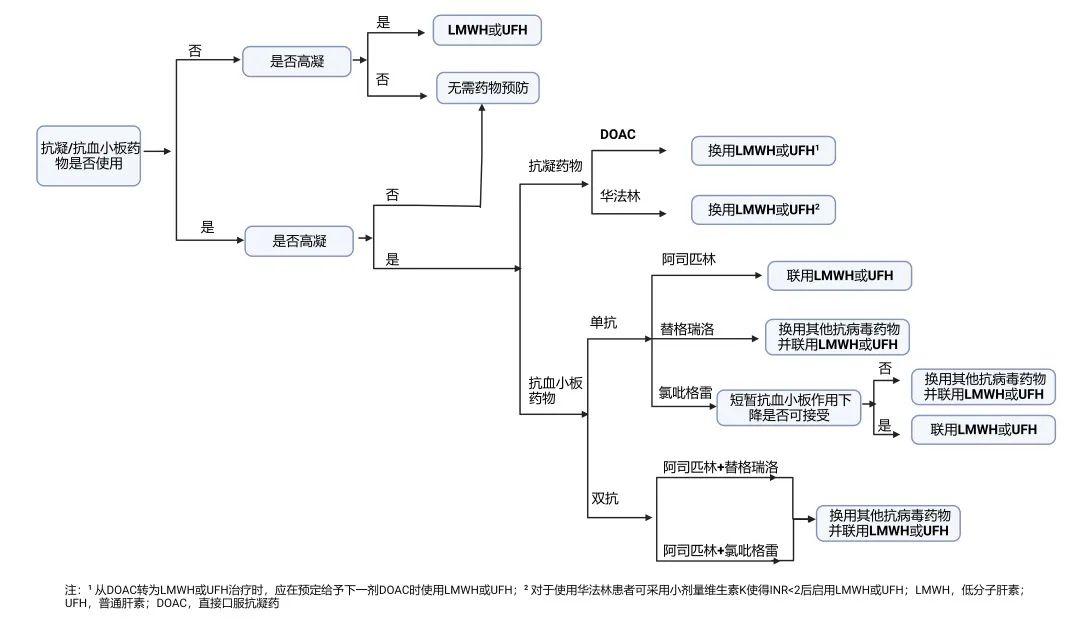
COVID-19可引起高凝状态,在使用奈玛特韦/利托那韦时如何联用抗凝/抗血小板药物?
推荐意见:
推荐依据:
COVID-19可引起高凝状态,住院患者(通常是静脉,但也可能是动脉)血栓栓塞的风险增加。因此,对于住院患者,除非存在禁忌,应接受血栓预防,肝素类药物与奈玛特韦/利托那韦不存在潜在相互作用,抗凝药优选低分子肝素或普通肝素(HIT病史等除外);若患者除COVID-19住院外还有抗凝的其他基础适应证(如房颤),抗凝药物需更换为肝素类药物,以便在需要时更快地调整治疗;若还有抗血小板治疗的患者,奈玛特韦/利托那韦与替格瑞洛禁止联用,并可能会降低氯吡格雷活性代谢产物浓度,两者需谨慎联用,对于单抗血小板药物治疗的,需评估两者联用期间氯吡格雷疗效短暂丧失是否可接受,对于双抗血小板治疗,由于血栓风险高,需换用其他抗病毒药物并联用肝素类药物。
-
临床问题五
正在使用常用免疫抑制剂的患者如何应用奈玛特韦/利托那韦?
推荐意见:
(1)对于使用钙调神经酶抑制剂(CNI)类免疫抑制剂的新冠感染患者,在可以密切监测免疫抑制剂的血药浓度情况下,可考虑选择奈玛特韦/利托那韦。
(2)对于此相互作用管理经验欠缺以及没有血药浓度监测条件,建议考虑使用其他抗新冠病毒药物。
(3)在奈玛特韦/利托那韦用药期间,需调整免疫治疗药物的剂量(详见用药建议)。在重新启用时,鉴于CYP3A酶恢复的时间存在个体差异,建议在2周内增加血药浓度监测频次,并在此基础上进行剂量调整。
具体用药建议如下:

推荐依据:
利托那韦是CYP3A强效抑制剂,可升高经CYP3A代谢的免疫治疗药物的血浆浓度,如环孢素、他克莫司、西罗莫司、甲泼尼龙等。由于环孢素、他克莫司、西罗莫司为窄治疗窗药物,这种相互作用可以引起免疫抑制剂明显的药物不良反应。一项对健康志愿者的研究表明,在利托那韦(100 mg每日一次)的稳定浓度下,24小时血药浓度(C24)和AUC 0-inf分别比不联用时高出15.8倍和5.8倍。对他克莫司药代动力学的影响更显著,剂量归一化的他克莫司C24和AUC 0-inf分别增加了17倍和57倍。环孢素的半衰期从7h延长到25h,他克莫司的半衰期从32h延长至232h。一项利托那韦联合西罗莫司治疗HIV患者的研究推荐西罗莫司的剂量减少至1/10至1/20。
-
临床问题六
已在用抗肿瘤治疗药物的患者,能否同时服用奈玛特韦/利托那韦?
推荐意见:
(1)目前临床常用的抗肿瘤药物多数是CYP3A4和P-糖蛋白的底物和(或)抑制剂/诱导剂,因此和奈玛特韦片/利托那韦片联用时需注意药物的相互作用。
(2)下表所示为奈玛特韦片/利托那韦片与抗肿瘤药物联用时的相关药学建议(药品按照首字母排序,便于检索)。

-
临床问题七
奈玛特韦/利托那韦和抗真菌药物合用存在药物相互作用吗?应该如何联用?
推荐意见:

推荐依据:
奈玛特韦/利托那韦与三唑类抗真菌药物合用,可能存在复杂的药物相互作用。其中,三唑类抗真菌药物通过细胞色素P450同工酶代谢,并抑制细胞色P450同工酶的活性,包括CYP2C19,CYP2C9和CYP3A4等,这些同工酶的抑制剂或诱导剂可能分别增高和降低三唑类抗真菌药物的血药浓度,而三唑类抗真菌药物本身也会增高通过CYP450同工酶代谢药物的血药浓度。相互作用研究表明,伏立康唑与不同剂量的利托那韦合用,彼此的体内暴露均会出现下降;利托那韦可使酮康唑AUC上升3.4倍,Cmax增加34%;NMV-r与伊曲康唑或泊沙康唑合用时,可能会增加奈玛特韦体内暴露量。艾沙康唑与奈玛特韦/利托那韦联用,艾沙康唑暴露增加,奈玛特韦/利托那韦暴露可能降低。
-
临床问题八
透析患者如何使用奈玛特韦/利托那韦?eGFR<30 mL·min-1的患者能否使用奈玛特韦/利托那韦?CRRT患者如何使用奈玛特韦/利托那韦?
推荐意见:
终末期肾病或透析患者在目前仍然缺乏充分的临床数据,尽管说明书中认为不应使用,但该部分患者面临重症风险,在权衡利弊后,可考虑使用。

推荐依据:
奈玛特韦的分子量为499.5D,药动学研究表明,两种成分的消除途径分别是奈玛特韦约35%由肾脏排出,70%与血浆蛋白结合;利托那韦主要由肝脏代谢,99%与血浆蛋白结合。奈玛特韦的暴露量随着肾功能损伤严重程度的增加而增加,由于缺乏相关研究数据,药品说明书指出严重肾功能损伤患者(eGFR<30 mL·min-1,包括血液透析下的ESRD患者)不推荐使用。
目前有报道终末期肾病(ESRD)患者使用奈玛特韦片/利托那韦片的研究,研究对4名接受间歇性血液透析的ESRD患者进行药代动力学研究,结果显示奈玛特韦Cmax较非ESRD患者高4倍(4563 - 7898 ng/mL),但没有观察到奈玛特韦的蓄积,且治疗结束后几天内血浆水平迅速下降。这些患者的给药剂量为150mg/100mg,BID,血透当天在给药2-6小时后开始透析治疗。
另有研究针对8名严重肾损害患者的II期研究中(eGFR,30 ml/min/1.73 m2,非透析),单次服用100 mg奈玛特韦后24小时的平均浓度为694.2 ng/ml(超过所需292 ng/ml的两倍),但未见有剂量依赖性的不良反应。对于血透患者,建议第一天服用300mg/100mg,之后每天服用150mg/100mg,QD,血透当天在透析后使用。体重≤40kg的患者建议每48h服用150mg/100mg。
根据药动学数据推测奈玛特韦30%的游离药物可能会被CRRT清除,其表观分布容积为109.4L,理论上被CRRT清除的量可忽略不计;综合考虑下,推测CRRT患者可以按正常剂量用药。
-
临床问题九
12周岁以下或体重小于40kg的儿童患者是否可以使用奈玛特韦/利托那韦?
推荐意见:

推荐依据:
2021年12月22日,FDA批准奈玛特韦/利托那韦用于12-17岁、体重≥40kg且伴有高风险因素的新型冠状病毒感染青少年患者。目前奈玛特韦/利托那韦尚未被批准用于6-12岁的儿童,但目前有一项针对18岁以下儿童的II/III期临床研究正在进行,6-17岁少年儿童的用法用量根据辉瑞公司官方及Clinical Trails网站信息推荐。
另外需要注意的是,奈玛特韦片含乳糖(176 mg/片),患有乳糖不耐受、总乳糖酶缺乏或葡萄糖-半乳糖吸收不良等罕见遗传代谢疾病的患儿不应服用此药;既往有肝胆疾病、肝酶异常或者肝炎、黄疸的患儿应慎用。
-
临床问题十
育龄期、妊娠期、哺乳期患者是否可以使用奈玛特韦片/利托那韦片?
推荐意见:
(1)育龄期:建议在治疗期间以及治疗结束后7天应避免怀孕;
(2)妊娠期:建议仅在母体的潜在获益大于对胎儿的潜在风险时使用;
(3)哺乳期:建议治疗期间以及治疗结束后7天停止哺乳。
推荐依据:
目前妊娠期妇女使用奈玛特韦片/利托那韦片的临床数据有限。利托那韦可安全用于HIV感染孕妇患者,基于奈玛特韦和利托那韦的作用机制以及现有的动物研究,根据风险-获益评估,NIH威廉亚洲博彩公司 建议符合条件使用奈玛特韦片/利托那韦片的妊娠或近期妊娠患者使用奈玛特韦片/利托那韦片。此外,1项研究显示7名接受奈玛特韦片/利托那韦片治疗的妊娠患者,除1名患者外(味觉障碍),其余患者完成疗程后,没有立即出现不良反应,也没有观察到对胎儿或新生儿的不良影响。
目前尚无哺乳期人群使用奈玛特韦片/利托那韦片的临床数据,尚不清楚奈玛特韦是否会分泌至乳汁中,及其对母乳喂养的新生儿/婴儿的影响或对乳汁分泌的影响。但动物研究显示,当大鼠暴露于8倍的奈玛特韦人体批准剂量时,后代出生17天后体重降低8%。关于人乳中存在利托那韦的报告有限。基于此,建议治疗期间以及治疗结束后7天停止哺乳。
尚缺乏妊娠期间使用本品的数据,因而不了解药物相关不良发育结局的风险,建议育龄期女性在治疗期间以及治疗结束后7天应避免怀孕。利托那韦与激素类避孕药联用时可能降低后者疗效,建议使用复方激素类避孕药患者在治疗期间及停用后的一个月经周期内使用替代避孕方法或额外的屏障避孕方法。
-
临床问题十一
奈玛特韦/利托那韦能否管饲给药?应如何操作?
推荐意见:
(1)将利托那韦和奈玛特韦直接压碎并与水(约20~50ml)混合,通过饲管给药;给药后用适量水冲洗管路。混悬液建议临用前配置。
(2)使用小孔径管路(如空肠管)管饲药物可能造成堵管,可适量增加溶媒后给药。管饲营养液或食物不影响奈玛特韦/利托那韦给药。

(操作视频二维码)
推荐依据:
奈玛特韦为薄膜包衣片剂,非缓释或控释制剂。奈马特韦与利托那韦均可掰开、压碎,并与苹果酱、布丁或任何普通食品或液体(包括含乳制品)混合。基于I期研究表明,混悬液与整片药物具有相似的药代动力学。由于缺乏奈玛特韦混悬液稳定性数据,建议临用前配制。奈玛特韦混悬液与利托那韦同时使用时,食物对其吸收影响不大,无需禁食后给药。
参考文献
1. 奈玛特韦片/利托那韦片组合包装说明书(国家药品监督管理局,2022年2月11日核准,2022年11月18日修改)
2. 中华医学会呼吸病学分会危重症学组,中国医师协会呼吸医师分会危重症医学专家组. 奥密克戎变异株所致重症新型冠状病毒感染临床救治专家推荐意见[J]. 中华结核和呼吸杂志, 2022, 46(2).
3. https://www.covid19-druginteractions.org/checker
4. Abraham S, Nohria A, Neilan TG, Asnani A, Saji AM, Shah J, Lech T, Grossman J, Abraham GM, McQuillen DP, Martin DT, Sax PE, Dani SS, Ganatra S. Cardiovascular Drug Interactions With Nirmatrelvir/Ritonavir in Patients With COVID-19: JACC Review Topic of the Week. J Am Coll Cardiol. 2022 Nov 15;80(20):1912-1924.
5. Mueck W, Kubitza D, Becka M. Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects. Br J Clin Pharmacol. 2013 Sep;76(3):455-66.
6. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, Waldo AL, Ezekowitz MD, Weitz JI, ?pinar J, Ruzyllo W, Ruda M, Koretsune Y, Betcher J, Shi M, Grip LT, Patel SP, Patel I, Hanyok JJ, Mercuri M, Antman EM; ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013 Nov 28;369(22):2093-104.
7. Egan G, Hughes CA, Ackman ML. Drug interactions between antiplatelet or novel oral anticoagulant medications and antiretroviral medications. Ann Pharmacother. 2014 Jun;48(6):734-40.
8. Kaminsky LS, Zhang ZY. Human P450 metabolism of warfarin. Pharmacol Ther. 1997;73(1):67-74.
9. Liverpool Drug Interactions Group.Interactions with essential medicines and nirmatrelvir/ritonavir https://www.covid19-druginteractions.org/, Accessed 12th Jun 2022.
10. Marsousi N, Daali Y, Fontana P, Reny JL, Ancrenaz-Sirot V, Calmy A, Rudaz S, Desmeules JA, Samer CF. Impact of Boosted Antiretroviral Therapy on the Pharmacokinetics and Efficacy of Clopidogrel and Prasugrel Active Metabolites. Clin Pharmacokinet. 2018 Oct;57(10):1347-1354.
11. Cuker A, Tseng EK, Schünemann HJ, Angchaisuksiri P, Blair C, Dane K, DeSancho MT, Diuguid D, Griffin DO, Kahn SR, Klok FA, Lee AI, Neumann I, Pai A, Righini M, Sanfilippo KM, Siegal DM, Skara M, Terrell DR, Touri K, Akl EA, Al Jabiri R, Al Jabiri Y, Boulos M, Brignardello-Petersen R, Charide R, Colunga-Lozano LE, Dearness K, Darzi AJ, Karam SG, Morgano GP, Morsi RZ, Philip BA, Benitez YR, Stevens A, Solo K, Wiercioch W, Mustafa RA, Nieuwlaat R. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis for patients with COVID-19: March 2022 update on the use of anticoagulation in critically ill patients. Blood Adv. 2022 Sep 13;6(17):4975-4982.
12. COVID-19 and VTE/Anticoagulation: Frequently Asked Questions. American Society of Hematology. Available at: https://www.hematology.org/covid-19/covid-19-and-vte-anticoagula -tion (Accessed on September 23, 2022).
13. Lemaitre F, Budde K, Van Gelder T, Bergan S, Lawson R, Noceti O, Venkataramanan R, Elens L, Moes DJAR, Hesselink DA, Pawinski T, Johnson-Davis KL, De Winter BCM, Pattanaik S, Brunet M, Masuda S, Langman LJ. Therapeutic drug monitoring and dosage adjustments of immunosuppressive drugs when combined with nirmatrelvir/ritonavir in patients with COVID-19. Ther Drug Monit. 2022 Aug 9. doi: 10.1097/FTD.0000000000001014. Epub ahead of print.
14. Badri P, Dutta S, Coakley E, Cohen D, Ding B, Podsadecki T, Bernstein B, Awni W, Menon R. Pharmacokinetics and dose recommendations for cyclosporine and tacrolimus when coadministered with ABT-450, ombitasvir, and dasabuvir. Am J Transplant. 2015 May;15(5):1313-22.
15. Krown SE, Roy D, Lee JY, Dezube BJ, Reid EG, Venkataramanan R, Han K, Cesarman E, Dittmer DP. Rapamycin with antiretroviral therapy in AIDS-associated Kaposi sarcoma: an AIDS Malignancy Consortium study. J Acquir Immune Defic Syndr. 2012 Apr 15;59(5):447-54.
16. https://covid19-sciencetable.ca/sciencebrief/nirmatrelvir-ritonavir-paxlovid-what-prescribers-and-pharmacists-need-to-know-3-0/
17. Considerations for the use of nirmatrelvir/ritonavir (brand name Paxlovid) to treat COVID-19 - Canada.ca
18. Paxlovid Drug-Drug Interactions | COVID-19 Treatment Guidelines (nih.gov)
19. Hiremath S, McGuinty M, Argyropoulos C, Brimble KS, Brown PA, Chagla Z, Cooper R, Hoar S, Juurlink D, Treleaven D, Walsh M, Yeung A, Blake P. Prescribing Nirmatrelvir/Ritonavir for COVID-19 in Advanced CKD. Clin J Am Soc Nephrol. 2022, 17(8):1247-1250.
20. Lingscheid T, Kinzig M, Krüger A, Müller N, B?lke G, Tober-Lau P, Münn F, Kriedemann H, Witzenrath M, Sander LE, S?rgel F, Kurth F. Pharmacokinetics of Nirmatrelvir and Ritonavir in COVID-19 Patients with End-Stage Renal Disease on Intermittent Hemodialysis. Antimicrob Agents Chemother. 2022, 66(11):e0122922.
21.https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-oral-antiviral-treatment-covid-19
22.https://www.pfizer.com/news/press-release/press-release-detail/pfizer-initiates-phase-23-study-novel-covid-19-oral
23. https://clinicaltrials.gov/ct2/show/record/NCT05261139
24.https://www.pfizermedicalinformationgulf.com/en-gulf/paxlovid/what-allergensingredients-paxlovidtm-contains
25. 国家卫生健康委员会国家中医药管理局. 新型冠状病毒感染诊疗方案(试行第十版)[国卫办医急函〔2023〕4号] http://www.nhc.gov.cn/cms-search/xxgk /getManuscriptXxgk.htm?id=32de5b2ff9bf4eaa88e75bdf7223a65a
26. National Institutes Of Health. Coronavirus Disease 2019 (Covid-19) Treatment Guidelines. https://www.covid19treatmentguidelines.nih.gov/.
27. Loza A, Farias R, Gavin N, Wagner R, Hammer E, Shields A. Short-term Pregnancy Outcomes After Nirmatrelvir-Ritonavir Treatment for Mild-to-Moderate Coronavirus Disease 2019 (COVID-19). Obstet Gynecol. 2022 Sep 1;140(3):447-449.
28. Food and Drug Administration. Fact sheet for healthcare providers: emergency use authorization for Paxlovid. 2022. Available at: https://www.fda.gov/media/155050/download.
29. CTC and CTRAWG Practice Brief – Crushing Nirmatrelvir/ritonavir.
30. Menon S, Nucci G, Bergman A. Innovative Randomized Phase I Study and Dosing Regimen Selection to Accelerate and Inform Pivotal COVID-19 Trial of Nirmatrelvir. Clin Pharmacol Ther. 2022 Jul;112(1):101-111.
二、莫诺拉韦胶囊的临床问题及药学建议
-
临床问题一
莫诺拉韦的药物相互作用有哪些需要关注?
推荐意见:
目前尚未证据证实莫诺拉韦与其他药物之间存在相互作用。
推荐依据:
莫诺拉韦和其活性成分NHC不是CYP酶或P-gp、BCRP转运体的底物。体外研究结果表明,莫诺拉韦和NHC不是CYP1A2、2B6、2C8、2C8、2C9、2C19、2D6和3A4的抑制剂或OATP1B1、OATP1B3、OCT1、OCT2、OAT1、OAT3、MATE1、MATE2K、MRP2、MDR1和BCRP 13的抑制剂或CYP1A2、2B6和3A4的诱导剂。莫诺拉韦与合用药物之间的相互作用目前尚无相关研究,从莫诺拉韦的代谢途径推测该药与其他药物相互作用较少,为了慎重起见,应当加强临床治疗期间的药品不良反应监测。
-
临床问题二
莫诺拉韦在肝、肾功能不全的患者中是否需要剂量调整?
推荐意见:
(1)莫诺拉韦在肝功能不全的患者中无需调整剂量。
(2)莫诺拉韦在肾功能不全(包括eGFR<30 mL·min-1或血液透析)的患者中无需调整剂量。
推荐依据:
莫诺拉韦是N-羟基胞苷(NHC)的前药,NHC会被细胞吸收,经细胞的合成代谢作用转变为N-羟基胞苷三磷酸(NHC-TP),主要分布在脾脏和肺中。NHC会经过内源性嘧啶代谢相同的途径代谢为尿苷与胞苷,然后排出体外。根据I期临床及II/III期临床及后续的群体药动学分析,莫诺拉韦或NHC经肾脏和肝脏的药物消除量极少,预计肾功能不全或肝功能不全对莫诺拉韦或NHC的PK参数的影响无显著意义,因此该药也没有进行肾功能不全或肝功能不全人群的研究。在eGFR<30 mL·min-1或透析的患者中,尚无相关药动学研究。一项在新型冠状病毒感染肾移植受体患者群体(n=7)的研究发现,尽管有4例患者eGFR<30 mL·min-1,但未发现有调整莫诺拉韦剂量的必要,也没有患者在使用莫诺拉韦期间发生不良反应。一项肾移植受体患者和血透患者的回顾性研究(n=36)中莫诺拉韦表现出较好的安全性和有效性,未发现血透患者有调整剂量的必要。此外,从莫诺拉韦的药物消除途径考虑,也暂无调整药物剂量的必要。
-
临床问题三
莫诺拉韦在未成年人患者中是否可以使用?
推荐意见:
未成年患者通常不建议使用,但在获益大于风险、尚无替代药物的情况下可在严密监护下谨慎短期使用,使用后并对该患者进行定期随访。
推荐依据:
长达3个月的毒理实验发现莫诺拉韦量(≥500 mg/kg/Day,约为人体NHC暴露量的5倍)会影响大鼠股骨和胫骨的骨生长。大鼠使用莫诺拉韦(约为人体NHC暴露量4~8倍)、犬连续使用莫诺拉韦14天(50 mg/kg/Day,大致与人体NHC暴露量相当)、小鼠使用莫诺拉韦1个月(2000 mg/kg/Day,相当于人体NHC暴露量的19倍)均未发现骨及软骨毒性发生。因此,未成年患者通常不建议使用,但在获益大于风险且尚无替代药物的情况下可在严密监护下谨慎短期使用,使用后并对该患者进行定期随访。
-
临床问题四
莫诺拉韦在妊娠期及哺乳期患者是否可以使用?
推荐意见:
(1)不建议妊娠期患者使用莫诺拉韦。
(2)育龄期女性在使用莫诺拉韦治疗期间和使用最后一剂后至少4天内应当采取严格的避孕措施。男性则在使用莫诺拉韦治疗期间和使用最后一剂后至少3个月内应当采取严格的避孕措施。
(3)不建议哺乳期患者使用莫诺拉韦。
推荐依据:
目前尚无妊娠期妇女使用莫诺拉韦的相关临床研究,但根据动物实验发现莫诺拉韦可能会导致流产、子痫、胎儿体重降低、胎儿发育迟缓、致畸性等问题,因此不建议在妊娠期妇女中使用。育龄期女性在使用莫诺拉韦治疗期间和使用最后一剂后至少4天内应当采取严格的避孕措施。男性则在使用莫诺拉韦治疗期间和使用最后一剂后至少3个月内应当采取严格的避孕措施。目前尚无莫诺拉韦及其代谢产物NHC是否会出现在人类的乳汁中的报道,但在动物研究中,使用莫诺拉韦的大鼠哺乳的幼崽血浆中检出了NHC,因此在使用莫诺拉韦治疗期间和使用最后一剂4天内不建议进行哺乳,同时将乳汁吸出并丢弃。
-
临床问题五
莫诺拉韦能否鼻饲给药?如何操作?
推荐意见:
莫诺拉韦在无法整粒吞服的情况下可以打开胶囊进行鼻饲给药。鼻饲给药操作步骤:
(1)打开胶囊,分散于适量温开水中,搅拌混合3分钟。
(2)用注射器抽吸全部混合物。
(3)用20-50 mL灭菌水冲洗鼻饲管,上下摇动注射器使混悬液分散均匀后通过鼻饲管给药,用20-50 mL灭菌水冲洗鼻饲管两次即可。

(操作视频二维码)
推荐依据:
目前关于莫诺拉韦肠内给药后的药代动力学数据有限,II期临床研究纳入5名受试者通过鼻胃管(NG)或口胃(OG)管接受了至少一次剂量。口服给药后的药物浓度与NG/OG管给药后的浓度范围相同,药代动力学没有明显差异。I期临床研究表明,莫诺拉韦可以与食物同服,药动学影响较小。对于不能耐受稀薄混悬液的患者,可以打开胶囊并与一勺酸奶或苹果泥混合后通过鼻饲管给药。
参考文献
1. https://www.fda.gov/media/155054/download
2.https://www.cec.health.nsw.gov.au/__data/assets/pdf_file/0006/702816/Drug-guideline-use-of-molnupiravir-capsules-for-COVID-19.PDF
3. https://www.covid19-druginteractions.org/
4. https://www.fda.gov/media/154421/download
5. Villamarín M, Márquez-Algaba E, Esperalba J, Perelló M, Los Arcos I, Campany D, Moreso F, Len O. Preliminary Clinical Experience of Molnupiravir to Prevent Progression of COVID-19 in Kidney Transplant Recipients. Transplantation. 2022 Nov 1;106(11):2200-2204.
6. Poznański P, Augustyniak-Bartosik H, Magiera-?ak A, Skalec K, Jakuszko K, Mazanowska O, Janczak D, Krajewska M, Kamińska D. Molnupiravir When Used Alone Seems to Be Safe and Effective as Outpatient COVID-19 Therapy for Hemodialyzed Patients and Kidney Transplant Recipients. Viruses. 2022 Oct 9;14(10):2224.
7. https://www.ncbi.nlm.nih.gov/books/NBK582856/
8.https://www.health.qld.gov.au/__data/assets/pdf_file/0019/1142074/molnupiravir-prescribing-guideline.pdf
9. Nakamura K, Fujimoto K, Hasegawa C, Aoki I, Yoshitsugu H, Ugai H, Yatsuzuka N, Tanaka Y, Furihata K, Maas BM, Wickremasingha PK, Duncan KE, Iwamoto M, Stoch SA, Uemura N. A phase I, randomized, placebo-controlled study of molnupiravir in healthy Japanese to support special approval in Japan to treat COVID-19. Clin Transl Sci. 2022 Nov;15(11):2697-2708.
三、阿兹夫定片的临床问题及药学建议
-
临床问题一
阿兹夫定的药物相互作用有哪些需要关注?
推荐意见:
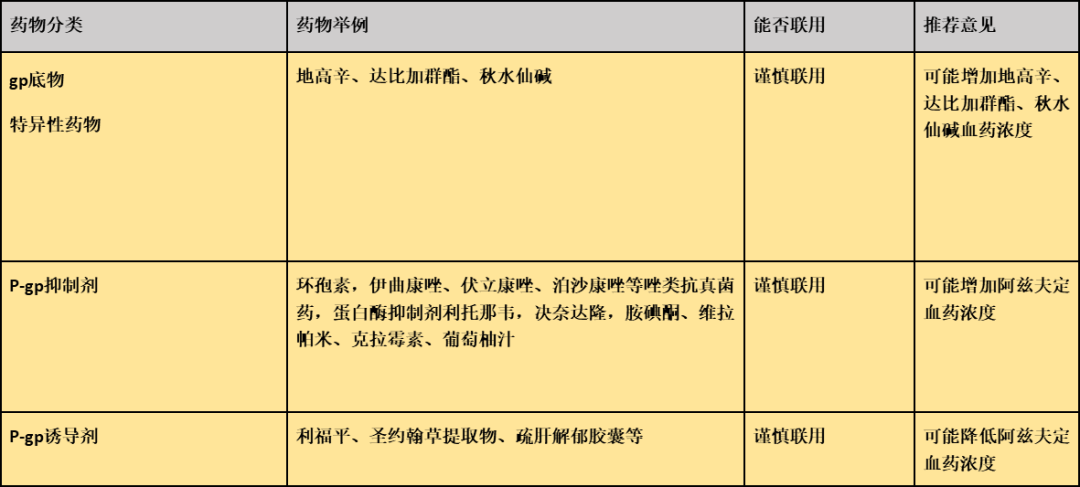
推荐依据:
阿兹夫定为P-gp底物及弱效P-gp诱导剂,在维拉帕米、丙磺舒、MK571或GF120918存在下,外排比降低50% 以上。
-
临床问题二
阿兹夫定在肝肾功能不全患者中是否需要剂量调整?
推荐意见:
(1)建议中重度肝功能损伤(参考临床试验入组标准:谷丙转氨酶/谷草转氨酶≥3×ULN,或总胆红素≥2×ULN)患者慎用阿兹夫定治疗。
(2)肾功能不全者建议根据肌酐清除率来调整给药剂量(见下表)。

推荐依据:
根据阿兹夫定在巴西开展的2项主要临床研究,均排除了肝病患者(谷丙转氨酶和/或谷草转氨酶超过正常值上限 3 倍,或总胆红素超过正常值上限的2倍)以及有已知肝病病史(Child-Pugh评分为B和C的肝硬化)的人群。此外,虽然这两项临床研究排除了肾功能不全(肾小球滤过率<70 mL·min-1,或肌酐超过正常值上限)的患者,但阿兹夫定说明书中提到以原形经肾脏排泄,排泄量占总排泄量 70% 以上。因此根据肾小球滤过率估算阿兹夫定给药剂量公式所得剂量。由于阿兹夫定为水溶性药物,推测其被透析清除,建议血液透析后给药。
-
临床问题三
阿兹夫定在未成年人患者中是否可以使用?
推荐意见:
不建议在未成年人患者中使用阿兹夫定。
推荐依据:
目前尚无未成年患者使用阿兹夫定的相关临床研究。根据阿兹夫定在巴西开展的2项主要临床研究,纳入的患者年龄均排除了<18岁患者。
-
临床问题四
阿兹夫定在妊娠期及哺乳期患者是否可以使用?
推荐意见:
(1)不建议妊娠期患者使用阿兹夫定
(2)不建议哺乳期患者使用阿兹夫定,建议服药期间及治疗结束后4天暂停哺乳;
推荐依据:
目前尚无妊娠期或哺乳期患者使用阿兹夫定的相关临床研究。根据阿兹夫定在巴西开展的2项主要临床研究,排除了妊娠期、哺乳期以及6个月内计划怀孕的患者,同时纳入的患者年龄均排除了<18岁患者。但根据动物实验提示,大鼠胚胎-胎仔发育毒性试验中,大鼠妊娠第 6~15 天经口给予阿兹夫定,1.5 和 5.0 mg/kg 剂量下产生胚胎及胎仔发育毒性;5.0 mg/kg 剂量下可引起胎仔骨骼发育迟缓;兔胚胎-胎仔发育毒性试验中,兔妊娠第 6~18 天经口给予阿兹夫定,3.0 mg/kg 剂量下产生母体毒性,并产生胚胎及胎仔发育毒性,胎仔骨骼畸形率升高。
围产期生殖毒性试验中测定了大鼠乳汁中的阿兹夫定药物浓度,结果显示阿兹夫定可通过血乳屏障,经乳汁排出。
-
临床问题五
还有哪类人群需要慎用阿兹夫定?
推荐意见:
曾患有胰腺炎或合并病毒性肝炎患者应慎用阿兹夫定治疗。对于HIV患者如合并新冠肺炎目前仅有一项小样本(12例)的临床研究,也应慎重选用。如正在服用3种抗病毒药物,需权衡利弊加用阿兹夫定。
推荐依据:
目前关于阿兹夫定在胰腺炎或合并病毒性肝炎患者中的临床研究数据有限,但是一项III期的临床研究(NCT04303598)中,排除了胰腺炎和临床乙型肝炎表面抗原/丙型肝炎抗体阳性患者。
对于曾患有胰腺炎的患者应慎用阿兹夫定,主要是因为阿兹夫定和拉米夫定结构相似,同属于核苷类逆转录酶抑制剂,化学结构上是核苷类似物,参考拉米夫定临床数据,曾有接受拉米夫定治疗后发生胰腺炎的案例报告,因此对于曾患有胰腺炎的患者应慎用阿兹夫定。
对于合并慢性乙型肝炎或丙型肝炎感染的患者是否可安全使用尚未进行临床研究。同类产品研究提示,在有慢性乙型肝炎或丙型肝炎合并感染并使用联合抗反转录病毒治疗的患者中,发生严重的和可能致死性的肝脏不良事件危险性升高。阿兹夫定的II期临床试验172例患者的结果显示,其肝酶(ALT、AST、γ-谷氨酰转移酶升高发生率较高),因此在肝炎患者中使用阿兹夫定应慎重。慢乙肝患者如发生新冠肺炎,如使用阿兹夫定,需要联用抗病毒力强、耐药率低的药物如恩替卡韦或替诺福韦、丙酚替诺福韦等,定期检查肝功能或能避免严重不良反应。
艾滋病的治疗方法主要是:“鸡尾酒疗法”,即具有不同的作用机理或针对HIV病毒复制周期中的不同环节的药物联合使用,从而避免单一用药产生的耐药性。对于HIV患者如合并新冠肺炎,在没有抗HIV治疗之前,可能不能单独应用阿兹夫定。
-
临床问题六
使用阿兹夫定常见的不良反应是什么?
推荐意见:
阿兹夫定最常见不良反应为头晕、谷丙转氨酶/谷草转氨酶升高、γ-谷氨酰转移酶升高、天门冬氨酸氨基转移酶升高、中性粒细胞绝对值降低、呕吐、血尿酸增高,属于十分常见,发生率10%~100%;常见不良反应为皮疹、恶心、腹泻发生率,发生率1%~10%。偶见血糖升高,淋巴细粒细胞计数降低。
推荐依据:
与研究药物相关的不良事件中,阿兹夫定 2mg、3mg、4mg 剂量组发生率最高的不良反应均为头晕(38.1%、59.5%、51.2%),其他常见的不良反应为丙氨酸氨基转移酶升高(35.7%、23.8%、41.9%)、γ-谷氨酰转移酶升高(14.3%、11.9%、32.6%)、天门冬氨酸氨基转移酶升高(16.7%、11.9%、20.9%)、血尿酸升高(14.3%、11.9%、16.3%),其他不良反应还有血乳酸增高、低密度脂蛋白升等。此外,说明书特别警示了服用本品后可能会产生中性粒细胞绝对值降低,总胆红素升高,谷草转氨酶升高,血糖升高的现象。
-
临床问题七
阿兹夫定能否鼻饲给药?如何操作?
推荐意见:
阿兹夫定在患者无法吞服的情况下,可以碾碎进行鼻饲给药。鼻饲给药操作步骤:
(1)将阿兹夫定碾碎,分散于适量温开水中,将其搅拌混合直至成混悬液。
(2)用注射器抽吸全部混合物,用20-50 mL温开水冲洗鼻饲管,上下摇动注射器使混悬液分散均匀后通过鼻饲管给药,冲洗鼻饲管两次即可。
推荐依据:
从药剂学角度来看,阿兹夫定片属于直压片,可以直接碾碎。
参考文献
1. Liu Y, Liu B, Zhang Y, Peng Y, Huang C, Wang N, Jiang J, Wang Q, Chang J. Intestinal absorption mechanisms of 2'-deoxy-2'-β-fluoro-4'-azidocytidine, a cytidine analog for AIDS treatment, and its interaction with P-glycoprotein, multidrug resistance-associated protein 2 and breast cancer resistance protein. Eur J Pharm Sci. 2017 Jul 15;105:150-158.
2. Liu Y, Wang Y, Peng Y, Liu B, Ma F, Jiang J, Wang Q, Chang J. Effects of the antiretroviral drug 2'-deoxy-2'-β-fluoro-4'-azidocytidine (FNC) on P-gp, MRP2 and BCRP expressions and functions. Pharmazie. 2018 Sep 1;73(9):503-507.
3. 河南省药学会《阿兹夫定治疗新型冠状病毒肺炎河南药学专家共识》
4. Elmeliegy M, Vourvahis M, Guo C, Wang DD. Effect of P-glycoprotein (P-gp) Inducers on Exposure of P-gp Substrates: Review of Clinical Drug-Drug Interaction Studies. Clin Pharmacokinet. 2020 Jun;59(6):699-714.
5. 阿兹夫定片(捷倍安)药品说明书(国家药品监督管理局,2022年7月25日核准,2022年7月28日修改)
6. https://clinicaltrials.gov/ct2/show/NCT04668235?term=Azvudine&draw=2&rank=1
7. https://clinicaltrials.gov/ct2/show/NCT05033145?term=Azvudine&draw=1&rank=2
8. 广东省药学会《新型冠状病毒肺炎抗病毒治疗临床药学指引(2022.12.07更新版)》
9. https://clinicaltrials.gov/ct2/show/NCT04109183?term=Azvudine&draw=2&rank=8
10. Tuon FF, Guastini CM, Boulos MI. Acute pancreatitis associated with lamivudine therapy for chronic B hepatitis. Braz J Infect Dis. 2008 Aug;12(4):263.
11. Umar J, Zayac A, Masood U, Rawlins S. Lamivudine-Associated Pancreatitis: Strongest Evidence to Date. Am J Ther. 2017 Sep/Oct;24(5):e636-e637.
12. Ren Z, Luo H, Yu Z, Song J, Liang L, Wang L, Wang H, Cui G, Liu Y, Wang J, Li Q, Zeng Z, Yang S, Pei G, Zhu Y, Song W, Yu W, Song C, Dong L, Hu C, Du J, Chang J. A Randomized, Open-Label, Controlled Clinical Trial of Azvudine Tablets in the Treatment of Mild and Common COVID-19, a Pilot Study. Adv Sci (Weinh). 2020 Oct;7(19):e2001435.
13. https://beta.clinicaltrials.gov/study/NCT04303598?distance=50&term=Azvudine&rank=8
14. Yang R, Cheng J, Song X, et al. Characteristics of COVID-19 (Delta Variant)/HIV Co-infection: A Cross-sectional Study in Henan Province, China. Intensive Care Res. 2022;2(3-4):96-107.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言