Heart Rhythm 武汉大学中南医院鲁志兵教授团队揭示心脏钠离子通道Nav1.5的新调控机制
2024-06-18 论道心血管 论道心血管 发表于上海
该研究揭示了接头蛋白14-3-3ε调控Nav1.5表达的分子机制,并初步证实了14-3-3ε在室性心律失常中的作用,表明其可能作为治疗Nav1.5相关心律失常的新靶标。
心律失常是导致心源性猝死的主要原因之一。抗心律失常的常用药物钠通道阻滞剂在临床上使用有一定的局限性,多数药物缺乏特异性,诱发新的心律失常,发展有选择性的钠通道阻滞剂成为更有前景的治疗选择。心脏电压门控钠离子通道Nav1.5的基因突变或表达异常均会导致心律失常,是与心律失常发生发展的直接相关基因。在心律失常基因治疗的研究中,由于Nav1.5蛋白较大,通常将Nav1.5的调控蛋白作为治疗靶点。因此,亟需通过基础研究寻找调节Nav1.5功能的重要作用分子,为未来靶向治疗心律失常提供新的实验依据及潜在的思路。
2024年5月13日,武汉大学中南医院鲁志兵教授课题组在电生理领域著名期刊Heart Rhythm在线发表题为“14-3-3ε/YWHAE regulates the transcriptional expression of cardiac sodium channel Nav1.5”的最新研究成果。该研究揭示了接头蛋白14-3-3ε调控Nav1.5表达的分子机制,并初步证实了14-3-3ε在室性心律失常中的作用,表明其可能作为治疗Nav1.5相关心律失常的新靶标。

该研究在体外实验中发现,14-3-3ε通过与转录因子TBX5 mRNA连接,降低其稳定性,进而负调控Nav1.5 mRNA的表达,影响Nav1.5蛋白表达及钠电流密度,但不改变钠通道的失活、激活、失活恢复特性。
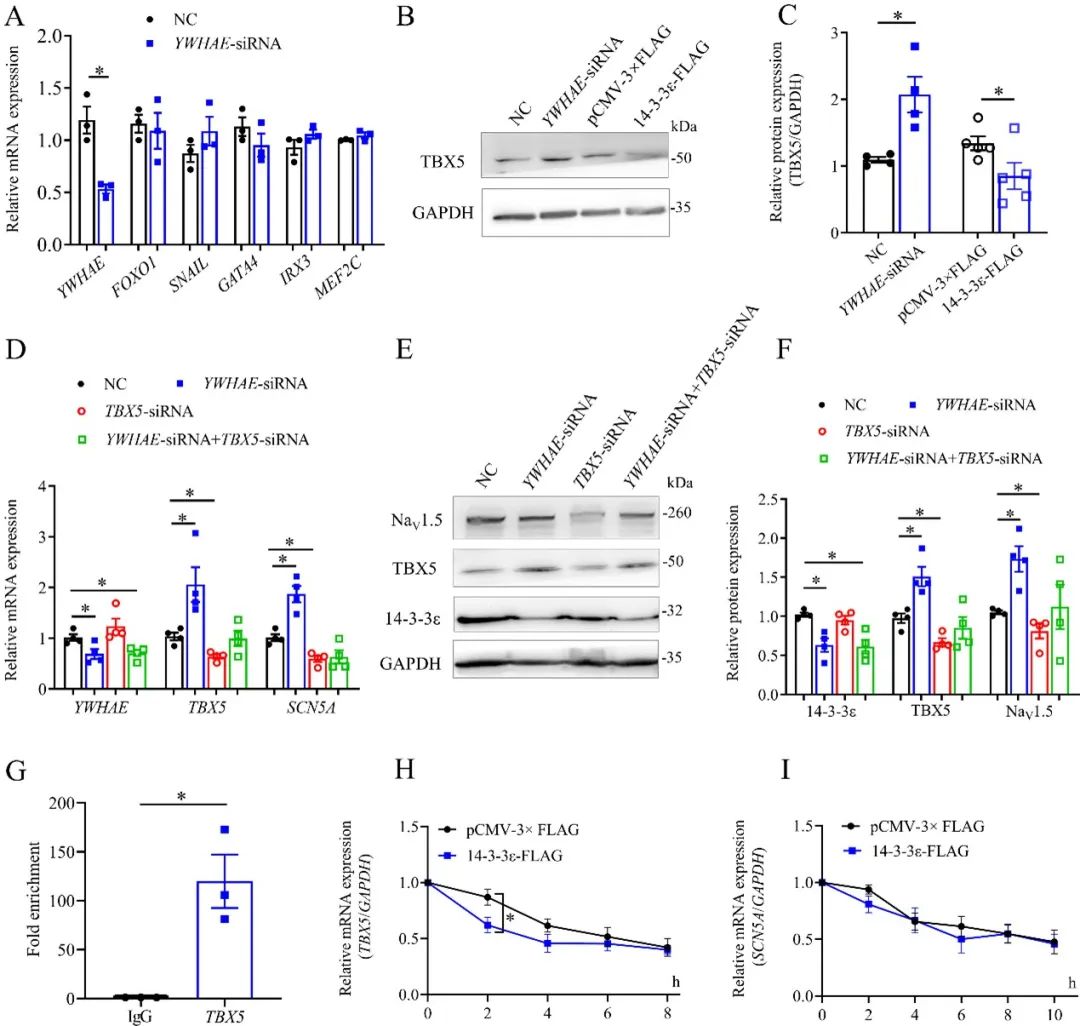
该研究进一步在野生小鼠体内,利用AAV9敲低14-3-3ε的表达,发现14-3-3ε表达的降低导致TBX5及Nav1.5的表达显著增加,且小鼠心率及室性早搏的发生频率显著增加。
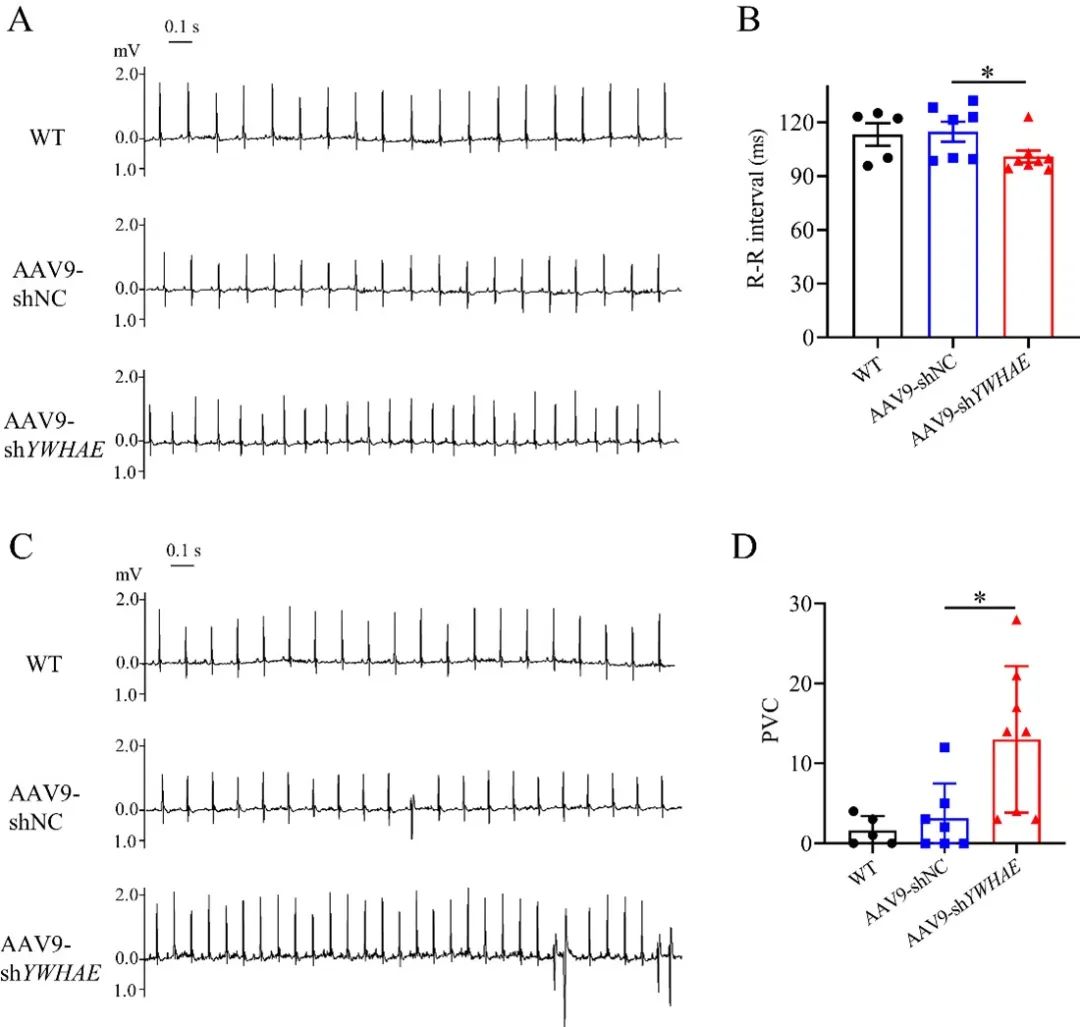
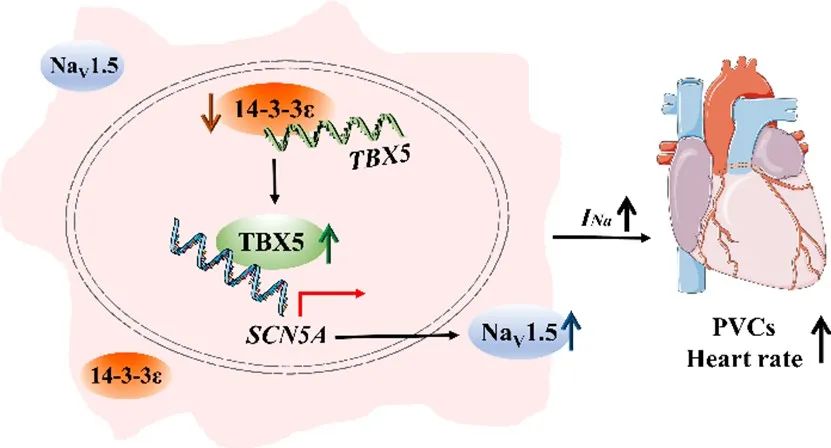
综上,该研究揭示了14-3-3ε是调控Nav1.5转录表达的重要分子,可能与室性心律失常的发生发展相关,并为治疗Nav1.5表达或钠电流降低所致的心律失常提供潜在的靶点。
武汉大学中南医院心血管内科鲁志兵教授及华中科技大学生命科学与技术学院王擎教授为共同通讯作者。武汉大学中南医院心血管内科胡玉双博士、王顺博士、熊洪波博士,华中科技大学张弛博士及厦门医学院谢雯博士为共同第一作者。该项工作得到国家自然科学基金(82070425和82270402)及中国博士后基金(2021M702522)的资助。
鲁志兵:武汉大学中南医院主任医师,教授,博士生导师,武汉大学中南医院副院长,武汉大学中南医院心内科科主任,湖北省杰青获得者,湖北省楚天英才(第一层次)。团队长期从事心血管疾病的基础和临床研究,建立创新研究团队,创立了武汉大学心肌损伤与修复研究所,致力于心律失常关键靶点的开发与应用,发表SCI文章60余篇,包括European Heart Journal、Cell Metabolism、JAMA Cardiology、Cardiovascular Research、Circulation: Arrhythmia and Electrophysiology、Redox Biology、Basic Research in Cardiology、JACC Clinical Electrophysiology等著名期刊。
王擎:华中科技大学教授,人类基因组中心主任,美国科学促进会会士,国家首批海外引进高层次人才,心律失常遗传领域的创始人之一,发现10个遗传病致病基因和21个冠心病、心梗、脑卒等常见疾病易感基因,发表300多篇文章,论文被引用3.8万多次。团队聚焦于罕见遗传病和重大心血管与神经疾病,探索疾病分子机制与精准诊疗。
论文链接:
https://linkinghub.elsevier.com/retrieve/pii/S1547527124025578
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#心律失常# #Nav1.5#
34