Mol Psychiatry:阿尔茨海默病风险基因 BIN1 调节人诱导的谷氨酸能神经元中的活性依赖性基因表达
2024-03-27 xiongjy MedSci原创 发表于上海
神经元特性的 BIN1 依赖性改变可能有助于 AD 的病理生理学,并且应考虑使用低剂量临床批准的钙阻滞剂治疗作为减缓疾病发作和进展的一种选择。
桥连整合因子1(BIN1)是阿尔茨海默病 (AD) 风险基因的第二大重要基因,但它在神经元中的生理作用及其对脑病理学的贡献在很大程度上仍然难以捉摸。

CRISPR/Cas9 生成针对外显子 3 中 BIN1 修饰的同基因 hiPSC(ASE 9109,Applied StemCell Inc. CA,USA)。BIN1 的纯合无效突变体在一个等位基因上缺失 5 bp,在另一个等位基因上缺失 8 bp。BIN1 的杂合子在一个等位基因上有 1 bp 的插入。本研究中使用的 3 种细胞系的全基因组测序证实了正常的倍性、对 HET 和 KO 克隆的 BIN1 位点的编辑,并且没有其他潜在的 CRISPR/Cas9 脱靶效应。
在与多电极阵列(256MEA100/30iR-ITO,Multi-Channel Systems,Germany)结合的微流控装置中培养ASCL1-hiN,并使用MEA2100-256-System(多通道系统)在分化2、3、4和6周时在5种不同的培养物中记录两种基因型的细胞外动作电位。
统计分析上,使用 Kolmogorov-Smirnov 检验验证了数据的非参数分布,并使用具有单个值和中位数的点图来表示这些数据。对于大样本量,箱形图显示 1-99 个百分位数、异常值和中位数。

图1:6.5月龄的BIN1 HET和KO COs中谷氨酸能神经元的转录变化相似。
这篇文章里,作者发现BIN1在调节谷氨酸能神经元的钙稳态、电活动和基因表达中起着关键作用。使用对由同基因 BIN1 野生型 (WT)、杂合子 (HET) 和纯合敲除 (KO) 人诱导的多能干细胞 (hiPSC) 生成的大脑类器官进行单细胞 RNA 测序,发现了 BIN1 主要由少突胶质细胞和谷氨酸能神经元表达,就像在人脑中一样。BIN1 HET 和 KO 脑类器官都显示出特定的转录改变,主要与谷氨酸能神经元中的离子转运和突触有关。
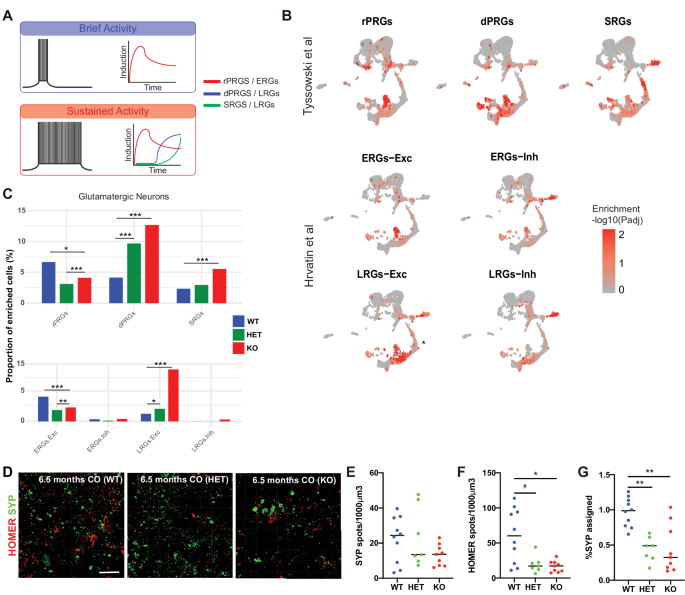
图2:BIN1 HET和KO谷氨酸能神经元活性相关基因表达改变和突触数量减少。
此外, BIN1 细胞通过使用一种新的方案产生 hiPSC 衍生的诱导神经元 (hiN) 的纯培养物,自主调节谷氨酸能神经元中的基因表达。通过该系统,结果还表明了 BIN1 通过与 L 型电压门控钙通道 Cav 的相互作用,在神经元钙瞬变和电活动的调节中起关键作用1.2.BIN1型KO hiNs显示出活性依赖性内化减少和Cav升高1.2与 WT hiN 相比的表达。使用临床相关剂量的硝苯地平(一种钙通道阻滞剂)对该通道进行药理学阻断,可部分挽救 BIN1 KO 谷氨酸能神经元中的电和基因表达改变。
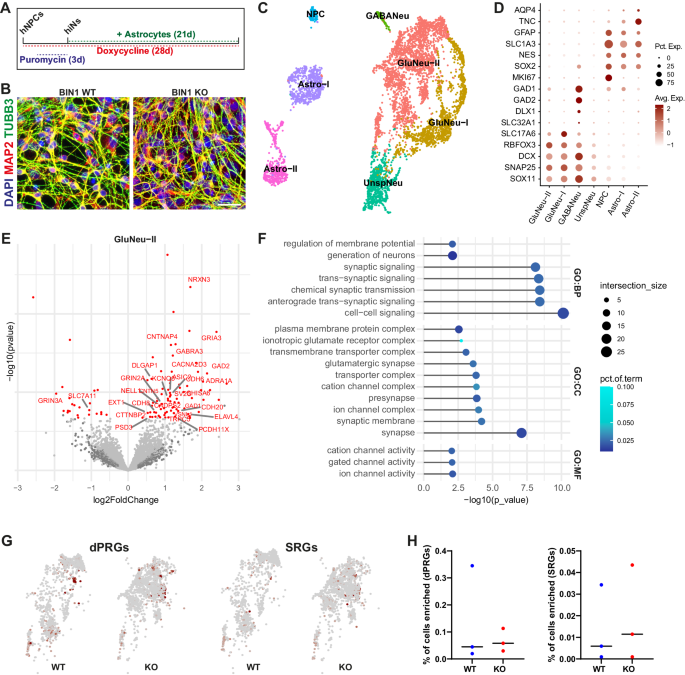
图3:神经元特异性BIN1 KO细胞自主引发转录变化。
此外,作者还发现,在AD病理学的晚期,影响与钙稳态相关的生物过程的BIN1 KO hiN的转录改变也存在于人脑的谷氨酸能神经元中。
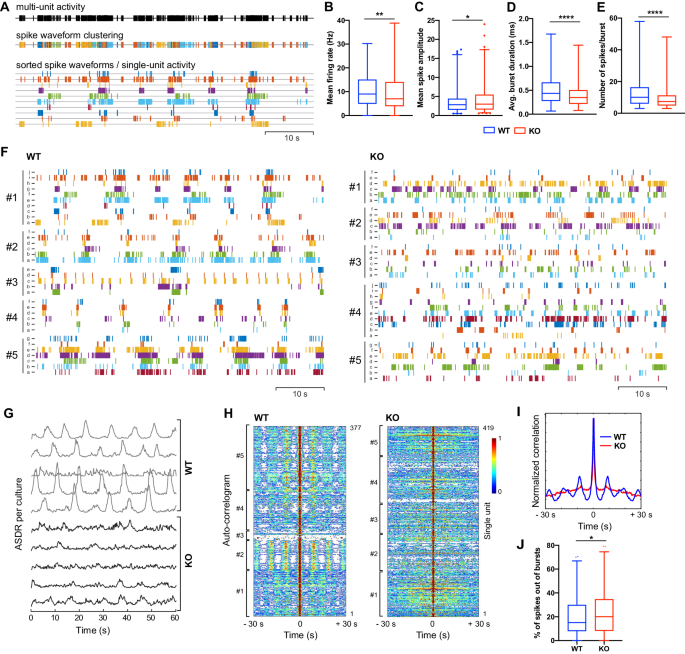
图4:BIN1 KO ASCL1-hiNs中神经元活动的紊乱。
总之,这些发现表明,神经元特性的 BIN1 依赖性改变可能有助于 AD 的病理生理学,并且应考虑使用低剂量临床批准的钙阻滞剂治疗作为减缓疾病发作和进展的一种选择。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#AD# #阿尔兹海默病# #BIN1#
38