Blood:冒烟型骨髓瘤是否应该治疗?
2024-03-08 聊聊血液 聊聊血液 发表于威斯康星
是否有可能通过为这些无症状的个体提供治疗,来阻止SMM进化为有症状的、危及生命的疾病。在单克隆浆细胞导致终末器官损伤之前清除它们,是SMM干预性研究的最佳目标。
SMM
冒烟型骨髓瘤(SMM)是多发性骨髓瘤的癌前状态。冰岛关于骨髓瘤前驱疾病的全国性筛查研究iStopMM报告,≥40岁人群中SMM的患病率为0.53%。部分SMM可发展为症状性疾病,如MM或AL淀粉样变性,但转化率随时间呈非线性,前5年较高(每年约10%),但之后显著较低(每年1% ~ 3%)。作为一种癌前病变,目前的问题在于,是否有可能通过为这些无症状的个体提供治疗,来阻止SMM进化为有症状的、危及生命的疾病。在单克隆浆细胞导致终末器官损伤之前清除它们,是SMM干预性研究的最佳目标。
《Blood》近日发表关于SMM治疗指征的综述文章,题目为“Smoldering Multiple Myeloma : Taking the narrow over the wide path?”,running title为“Should we treat smoldering multiple myeloma”。作者提到,基于“定义尚不明确”的进展风险,很多研究者建议对高危SMM患者进行前瞻性干预性试验。作者认为这样的干预措施有害,建议采取密切的“观察等待”,并将这些患者纳入专门的观察性生物学研究,旨在根据浆细胞生物学(包括基因组学、表观遗传学和免疫微环境)更好地识别将进展为MM的患者。
 从哪里开始?
从哪里开始?
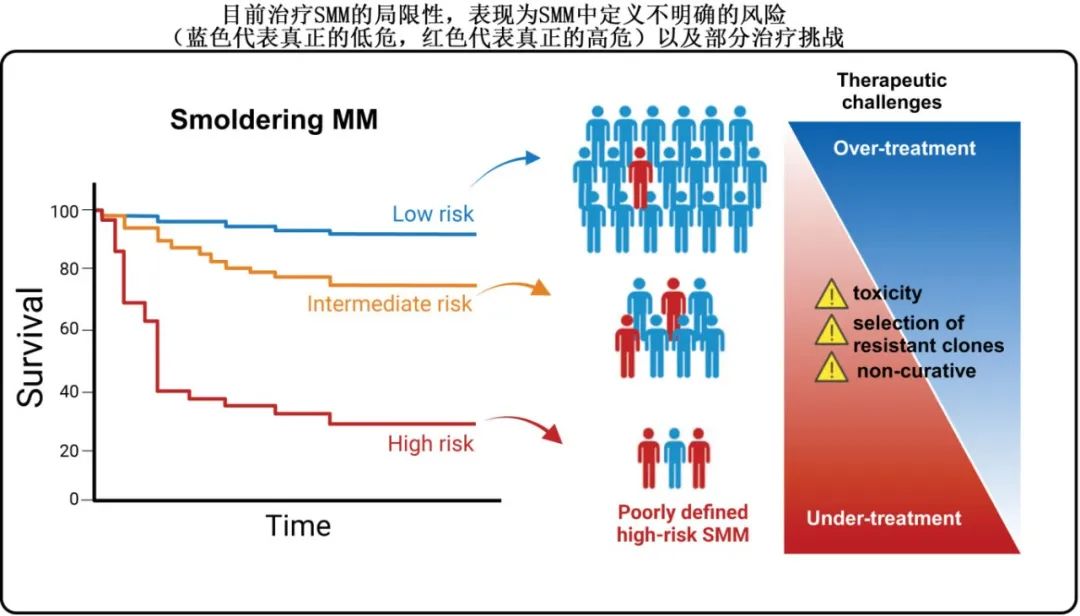
为避免对那些可能永远不需要任何治疗的个体进行过度治疗,研究人员开发出能够识别 “高危SMM”的预后模型。目前有两种公认的模型可供选择,包括西班牙PETHEMA模型和梅奥20/2/20模型,两种模型均将SMM患者分为低危、中危和高危,但两者的一致性很差。此外,对于归类为“高危”的患者,并非所有的患者都是真正的高危患者,20-25%的患者在5年未进展为MM。值得注意的是,将20/2/20模型或IMWG逻辑回归评分模型中的两个高危标准应用到最近提出的更全面的PANGEA模型中,2年进展风险仅为25%,而上述两种模型的2年进展风险分别为44%和51%。因此,目前的预测模型在很大程度上并不准确,原因可能是其以浆细胞为中心的性质,以及未能考虑到适应性免疫和先天免疫在控制SMM中发挥的重要作用。
尽管目前使用的风险预测模型显著局限性,但很多研究者仍主张对“高危”SMM患者进行治疗。西班牙PETHEMA团队是该领域的先驱,开展了QUIREDEX研究,将119例高危SMM患者(基于西班牙模型)随机分组,分别接受来那度胺-地塞米松治疗2年(57例患者)和观察(62例患者),以至进展为MM的时间作为研究的主要终点。结果达到主要目标,且该研究结果为在这一人群中开展多项研究奠定基础;但其也有局限性,包括:(i)样本量相对较小,(ii)纳入的患者现在根据新的疾病标准归为有症状MM,(iii)缺乏统计学效力来分析对总生存期(OS)的影响。
治疗的目标是什么?
支持治疗SMM患者的学者经常将其与癌前病变(如导管原位癌)的治疗相提并论,但这种类比有缺陷,因为导管原位癌的治疗是治愈性的,并且仅限于手术(以及某些情况下为特定疗程的放疗)。同样的概念也适用于仅需轻微手术干预即可根除的不典型增生结肠息肉或癌前皮肤病变,但SMM显然并非如此。Clinicaltrials.gov网站上有54项涉及SMM患者的干预性研究,但只有少数已发表。所有这些研究均以缓解率、微小残留病和/或无进展生存期(PFS,包括进展为MM)为主要终点,旨在延缓肾功能衰竭或椎体骨折等器官损伤的发生;其中大多数是随机研究,将试验方案与观察或来那度胺-地塞米松进行比较。值得注意的是,两项学术试验(GEM-CESAR和ASCENT)是单臂2期研究,采用了相当积极的干预措施,包括西班牙CESAR研究中的自体移植。
在迄今发表的研究中,主要终点如缓解率和PFS均成功实现,但事实上这一结局完全符合预期,尤其是在将治疗与观察进行比较时(如ECOG研究中所见),尽管缓解率仅为50%。因此,这些研究检验的主要终点可能具有误导性,尤其是在未证明总生存期获益的情况下。重要的是,通过这些试验性干预措施和当前的分类,真正的“高危”SMM患者仍不可避免地发展为显性MM,部分患者会对有效的抗MM药物产生耐药,而错误地归为“高危”的SMM患者将接受有害的治疗而没有任何生存获益。
从这些治疗中可以学到什么?
首先,确定这些试验的主要目标很关键。在患SMM等癌前疾病的健康人群中,研究早期治疗的试验应优先考虑延长生存期(甚至治愈),尽管其挑战巨大,可能需要数十年才能实现。而选择总缓解率、MRD或PFS作为主要目标具有误导性。首先,这些目标非常容易实现,尤其是在比较治疗和观察时。其次,并非旨在治愈SMM患者的干预措施,如来那度胺为基础的治疗或抗CD38抗体的双药方案,可能仅仅推迟MM症状的发生,对总生存期(OS)的影响很小甚至没有影响。相反,部分患者(特别是侵袭性SMM患者)可能在这些试验期间获得耐药,导致后续使用这些药物治疗显性MM时无效,并降低获得持久缓解的可能性。此外,SMM患者接受抗MM骨干治疗可能会使他们在进展为MM时无法参与前瞻性临床试验。此外,这些干预措施会阻碍在明显进展为MM时收集的生物样本的分析,因为这些治疗有可能改变肿瘤克隆本身及其微环境。
这些SMM研究的第二个主要局限性在于对“高危SMM”的定义。目前的模型包括20%-25%的患者永远不会发展为MM。对于使用非常激进方案的研究,例如CESAR(强化诱导、移植、巩固和维持)或ASCENT(长期强化四联治疗),这一点非常有问题。人们认为对SMM患者进行早期干预有益,是因为他们相信单克隆浆细胞的基因组结构不那么复杂,而且可能更容易受到抗MM药物的影响。虽然没有研究证明,但这一假设是可以理解的,但对于永远不会发展为有症状MM的患者给予积极治疗是有问题的,会暴露于潜在有害和威胁生命的毒性。此外,这两项研究的初步信息表明,MRD阴性率并不优于接受类似治疗(例如FORTE研究)的显性MM患者,从而对主要假设的有效性提出质疑,即SMM比显性MM对治疗更敏感,因此更容易治愈。最后,基于适应性免疫治疗方法(双特异性抗体或CAR-T细胞)的试验目前正在提出或积极纳入“高危”SMM患者,但这些方法在新诊断MM中的疗效还尚未确定。同样的担忧也包括可能引起毒性,特别是双特异性抗体的潜在致死性感染或CAR-T的继发性白血病/淋巴瘤。
还有哪些问题?
最关键的问题可能在于,SMM是否是真正的癌前状态,对用于MM的药物是否更敏感,以及在MM发生之前进行治疗是否可以根除浆细胞克隆。其平行问题在于SMM的概念是否适宜。有学者提出,这一概念是对浆细胞恶性肿瘤生物学的误解,部分SMM可能已经是真正的浆细胞恶性肿瘤,因此被归类为需要治疗的MM,而另一些仍是意义未明单克隆丙种球蛋白病(MGUS),仅需要监测。
为了回答这一基本问题,还需要更深入的生物学研究,包括表型、基因组和免疫环境分析。这些研究包括单克隆丙种球蛋白病的MGUS样表型分类,其中19%的SMM可能重新分类为MGUS样,且进展为MM的风险低。同样,除基于FISH的分析之外,多项研究发现了与SMM进展为多发性骨髓瘤相关的基因组特征,包括TP53、ATM、NRAS、KRAS、MAF、BRAF、NFKBIA和DIS3等基因的SNV,以及14q缺失、16q缺失(CYLD)、t(4;14)、t(14;16)、MYC易位或拷贝数增加的CNV以及APOBEC (SBS2+SBS13)突变标签。这些基因组研究表明,与临床风险评分相比,具有基因组惰性疾病的“高危”SMM患者的进展风险低。更有意义的是,新兴的免疫学研究和免疫适应性评估与SMM进展为MM明显相关,但尚未纳入进展风险评估。
从实用的角度来看,在验证高度准确的SMM进展预测工具之前,“原始的无伤害”方案应是建议密切“观察”。SMM患者应接受充分的放射学评估,使用成像技术,如低剂量全身断层密度测量、磁共振成像和正电子发射计算机断层显像。还应密切随访(至少在最初5年期间)以检测临床演变,如肾功能恶化或骨局灶性病变。
最后,对于高危SMM的定义这一尚未解决的问题,大多数目前正在进行或计划中的SMM治疗试验都并非合适答案(下图)。反对治疗SMM的建议具有进一步的意义,因为部分研究者现在主张治疗非高危SMM,甚至MGUS (NCT06140524)。
参考文献
Hervé Avet-Loiseau, Nizar J Bahlis.Smoldering Multiple Myeloma : Taking the narrow over the wide path?Blood . 2024 Mar 1:blood.2024023880. doi: 10.1182/blood.2024023880.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













冒烟型骨髓瘤(SMM)是多发性骨髓瘤的癌前状态
34
#冒烟型骨髓瘤# #骨髓瘤#
52