中山大学袁进教授团队ACS Nano:建立工程化外泌体可溶性微针角膜炎症干预新策略
2024-08-09 BioMed科技 BioMed科技 发表于上海
中山大学中山眼科中心袁进教授团队,成功构建了具有靶向抗炎作用的工程化外泌体,创新性的与可溶性微针给药体系相结合,显著抑制角膜碱烧伤导致的炎症反应,改善角膜碱烧伤预后。
角膜是维持清晰视觉的前提和基础,化学性外伤、免疫性疾病引起的炎症反应导致伤口愈合延迟,破坏角膜正常结构与功能,严重者如角膜碱性化学伤导致失明,严重威胁患者视力健康。现有的临床治疗方法存在诸多局限性,促使研究者不断探索高效、安全的创新疗法。
为了解决这一难题,中山大学中山眼科中心袁进教授团队,成功构建了具有靶向抗炎作用的工程化外泌体,创新性的与可溶性微针给药体系相结合,显著抑制角膜碱烧伤导致的炎症反应,改善角膜碱烧伤预后。研究成果近日以题为“Engineered Mesenchymal Stromal Cell Exosomes-Loaded Microneedles Improve Corneal Healing after Chemical Injury”发表在国际知名学术期刊《ACS Nano》。

【工程化外泌体的构建及特性检测】
在碱性损伤的治疗过程中,及时中和炎症因子、抑制过度的免疫炎症反应以及促进角膜组织的修复和再生至关重要。TNF-α在角膜碱烧伤中发挥着诱发炎症、介导细胞凋亡和坏死的重要致病作用。然而,单独使用aT在促进受损角膜组织修复方面的效果有限。近年来,脂肪间充质干细胞外泌体(ADSC-Exo)被发现是具有高组织粘附性、低免疫原性的多功能生物纳米药物和药物载体。于是,研究者通过基质金属蛋白酶(MMPs)可切割肽链将角膜碱烧伤特异性关键炎症因子TNF-α的抗体(aT)连接于ADSC-Exo表面,获得具有抗炎特异性和促进组织再生修复双重功能的工程化外泌体药物(aT-Exo)。
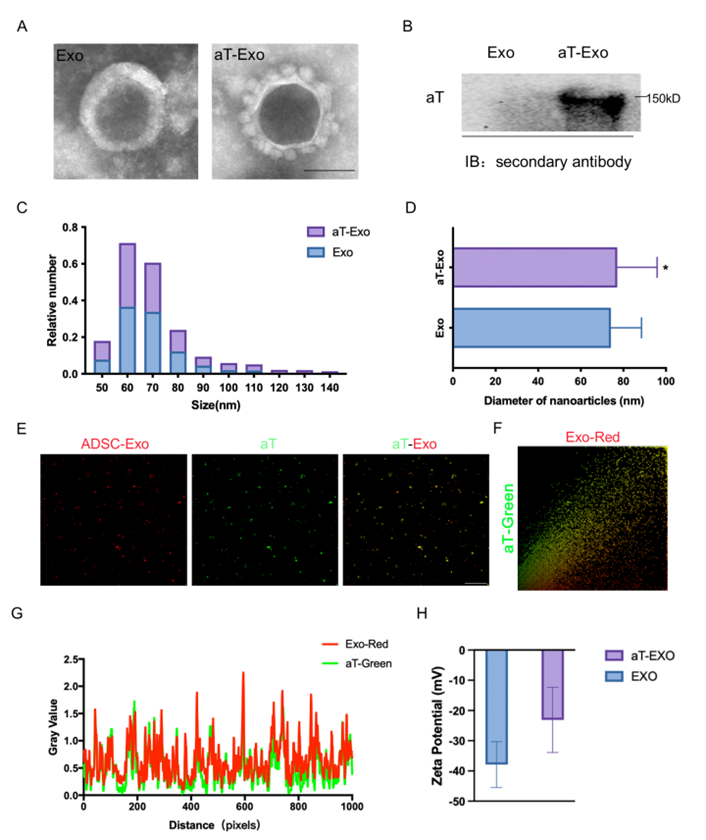
图1. aT-Exo的构建、形貌及性能表征
首先,研究者采用透射电子显微镜(TEM)观察了工程化外泌体的形态。TEM显示了原始外泌体典型的杯状结构,以及aT-Exo展示的独特花环状图案,表明aT成功修饰在ADSC-Exo的表面。此外,研究者通过WB成功检测到aT-Exo中aT的存在。研究者还通过纳米流式检测到Exo和aT-Exo均呈正态分布,其中aT-Exo的粒径稍大于Exo。免疫荧光共定位进一步显示绿色信号(代表aT)和红色信号(代表外泌体)高度重叠,同样支持aT成功结合在外泌体表面。在Exo和aT-Exo之间并未检测到显著的zeta电位变化,表明aT结合后外泌体的稳定性。
【aT-Exo通过减轻炎症保护角膜细胞】
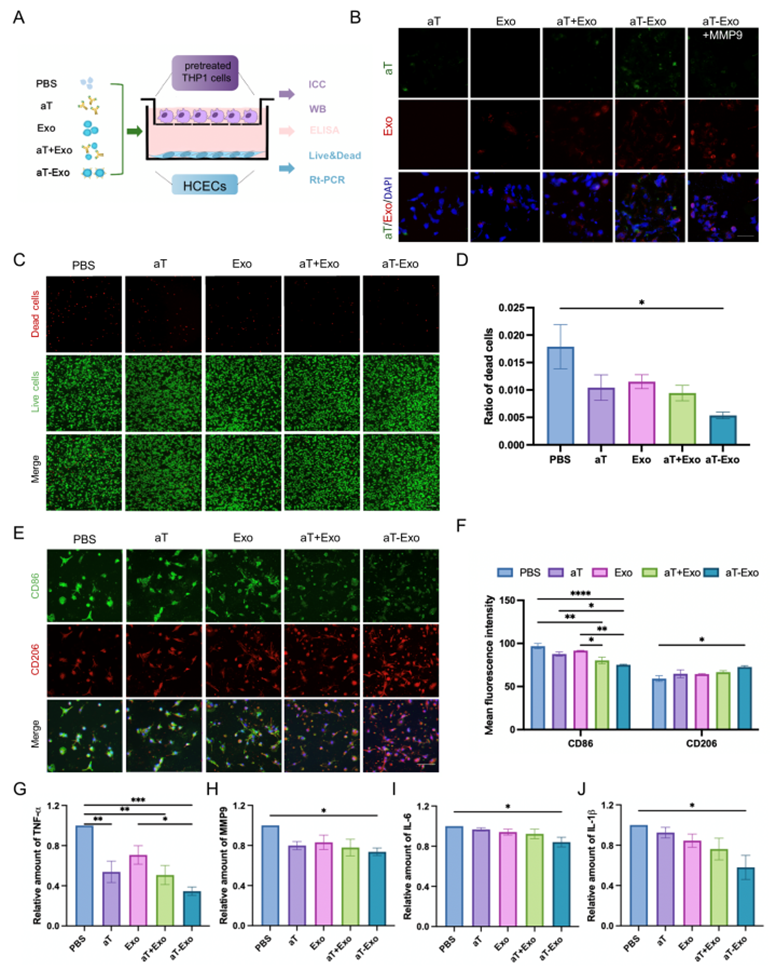
图2. aT-Exo通过抑制炎症因子的释放保护角膜上皮细胞
研究者在体外建立了共培养体系,以阐明aT-Exo促进碱烧伤角膜修复的作用机制。人角膜上皮细胞在下室,THP-1诱导成的促炎M1型巨噬细胞(M1)在上室。分别将PBS、游离aT、ADSC-Exo、aT+Exo和aT-Exo加入培养基中,共培养24小时。首先,通过荧光共染揭示了aT、ADSC-Exo的分布。结果显示在未添加MMP9的aT-Exo组中,aT(绿色标记)与ADSC-Exo(红色标记)在细胞水平聚集,而在添加MMP9时,aT的绿色荧光消失。这证明了aT和Exo之间的连接被MMP9成功切割,导致aT游离并溶解到培养基中。接下来,细胞死活染色发现,aT-Exo组的HCECs死亡比例最低。CD86和CD206分别是M1和M2型巨噬细胞的表面标志,两者免疫荧光染色证明了aT-Exo可以通过促进巨噬细胞M2型极化显著抑制角膜炎症。最后,通过ELISA测定分泌了培养体系中的炎症因子,结果同样发现了aT-Exo可以最有效地减少TNF-α、MMP9、IL-6和IL-1β,进而减轻对细胞的炎症损伤。
【可溶性角膜微针的制备和特性】
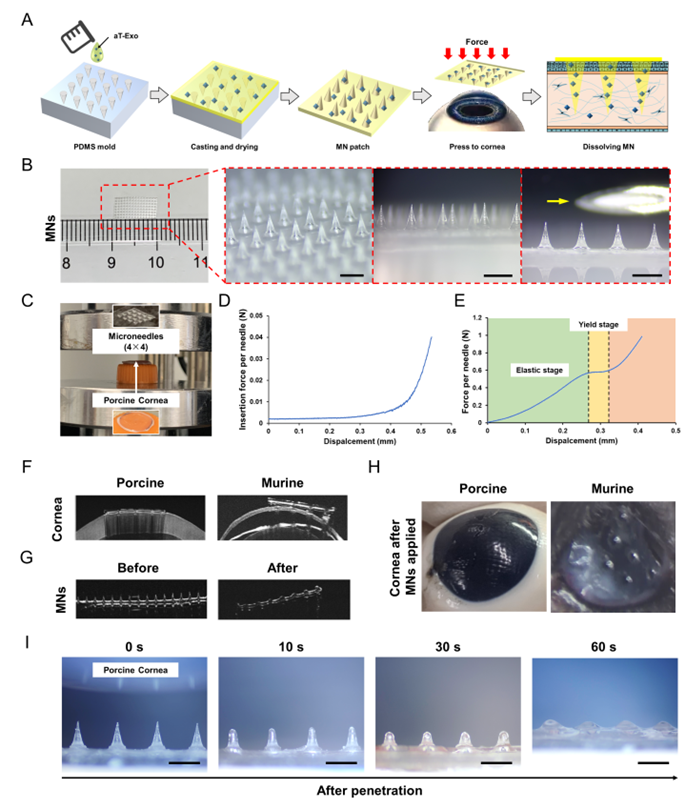
图3. MNs的构建和跨角膜上皮药物递送评价
虽然局部给药是治疗眼部疾病的最常见方法,但是眼部的解剖和生理屏障限制了局部药物的生物利用度,超过95%的滴眼液会迅速被清除。研究者使用人工泪液和生物材料的聚乙烯醇(PVA)构建微针(MNs)来用于递送外泌体。图像显示MNs针尖均匀分布,针的尺寸远小于26号注射针,保证非侵入性和无痛药物递送。微针的机械特性测试表明,其能轻松穿进离体猪角膜,每根针所需的力小于0.02 N。研究者还测试了针体在显著变形前的最大承压能力,进而证明了MNs具有足够的强度能有效工作而不发生显著变形或损坏。此外,研究者还使用微针插入离体猪角膜和麻醉小鼠的角膜。AS-OCT图像清楚地显示,微针能够插入角膜基质,但未穿透角膜。通过比较应用前后AS-OCT图像,研究者发现MNs尖端能够完全留在并溶解于角膜组织中。光学显微镜观察显示MNs在猪角膜中快速溶解,60秒后仅留下少量针尖。因此,MNs具备跨角膜上皮给药的性能。通过荧光标记成像观察,可发现MNs显著提高了外泌体在角膜内的滞留时间。
【MNs负载aT-Exo有效治疗角膜碱烧伤】
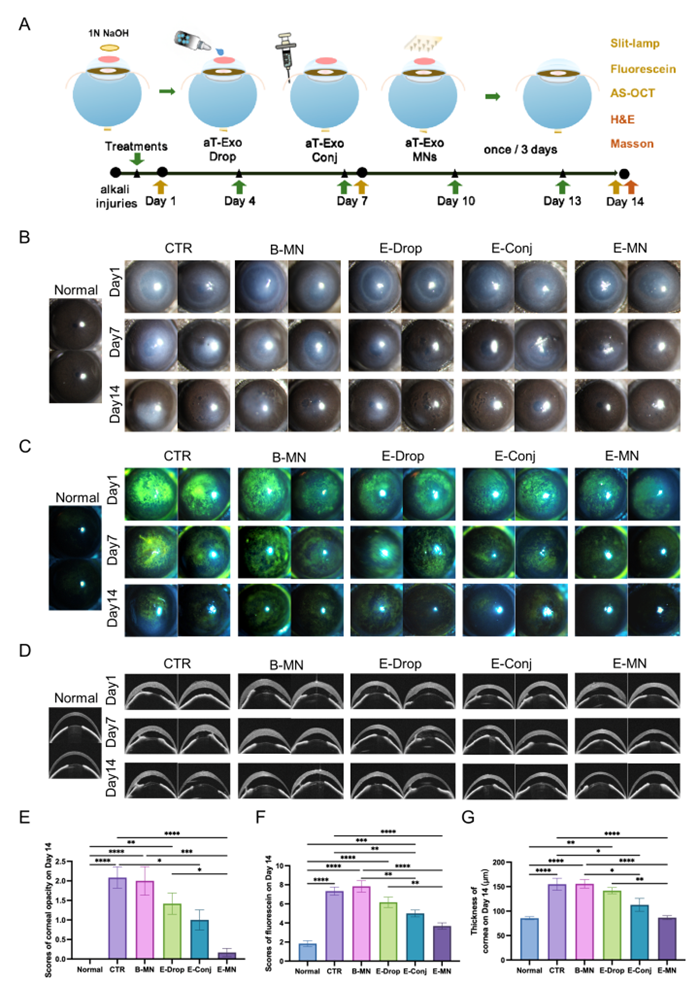
图4. MNs递送aT-Exo干预小鼠角膜碱烧伤
为了验证MNs递送aT-Exo的治疗效果,将等量的aT-Exo分别通过滴眼液(E-Drop)、结膜下注射(E-Conj)和微针(E-MN)应用于小鼠碱烧伤角膜,然后评估角膜愈合过程。治疗14天后,研究者发现仅E-MN处理显著改善了角膜透明度。与CTR和B-MN组相比,虽然三种给药方式递送的aT-Exo均能加速角膜上皮修复,但其中E-MN组的角膜最接近正常状态。此外,还发现通过结膜下注射和微针递送的aT-Exo有助于消除受伤角膜的水肿,但同样MNs的效果更好。因此,MNs递送系统能够有效提高外泌体的生物利用度,进而增强其治疗效果。
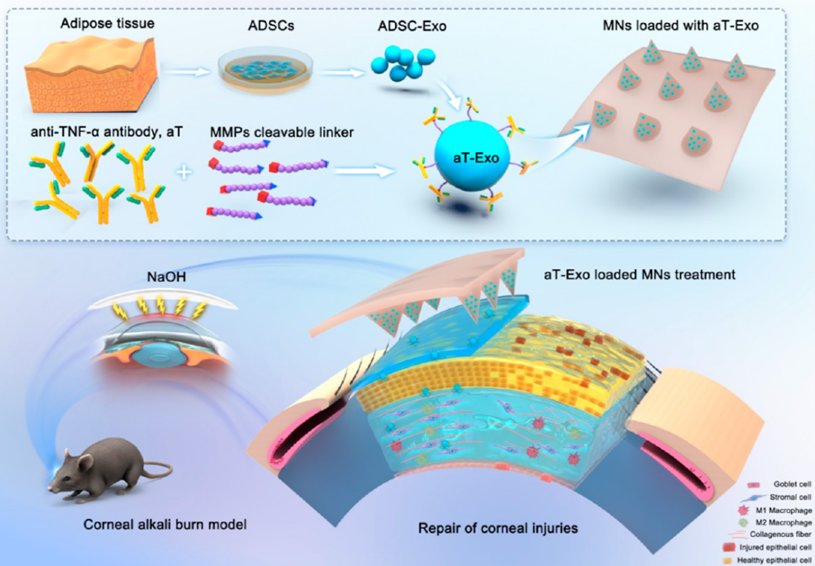
模式图.装载工程化外泌体(aT-Exo)的微针体系效果机制模式图
【总结】
该研究通过构建工程化外泌体aT-Exo,靶向抑制角膜碱烧伤引起的炎症反应,促进角膜的修复和再生,结合构架聚乙烯醇(PVA)微针实现外泌体的精确和持续角膜递送,明确了工程化外泌体干预角膜炎症相关疾病的临床应用前景,同时展示了微针技术在眼部生物活性纳米药物递送中的潜力。
中山大学中山眼科中心、眼病防治全国重点实验室为第一单位,中山眼科中心袁进教授、李赛群副主任医师和香港大学刘璐教授为共同通讯作者,中山眼科中心余菲博士后、赵轩副研究员和汪倩博士后为共同第一作者。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言









#角膜炎症# #可溶性微针#
8