FDA顾问小组不支持阿尔茨海默氏病药物aducanumab
2020-11-07 Allan MedSci原创
近日,FDA顾问小组对Biogen和Eisai的抗淀粉样蛋白抗体aducanumab的批准投了反对票,小组认为,鉴于与另一项试验的结果相互矛盾,单项阳性研究的证据不足以证明该药对阿尔茨海默氏病的疗效。
近日,FDA顾问小组对Biogen和Eisai的抗淀粉样蛋白抗体aducanumab的批准投了反对票,小组认为,鉴于与另一项试验的结果相互矛盾,单项阳性研究的证据不足以证明该药对阿尔茨海默氏病的疗效。
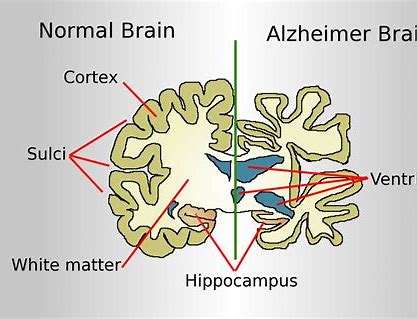
基于有争议的III期EMERGE和ENGAGE试验的事后评估,制药商正在寻求批准aducanumab以延缓阿尔茨海默氏病患者的临床衰退。
专家组以8-1的投票结果认为,如果不考虑相互矛盾的ENGAGE数据,就不能单独将EMERGE阳性试验视为有力证据来支持aducanumab的有效性。其他两名小组成员对这个问题尚未给出结论。FDA还要求咨询委员会考虑进行事后探索性分析,以帮助“最大程度地了解这两项试验的部分不一致结果”,以及讨论来自名为study-103的小型I期试验的支持数据以及aducanumab的药效学作用。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#阿尔茨海默氏#
56
#mAb#
44
#阿尔茨海#
41
#阿尔茨#
47
#阿尔茨海默氏病#
60
#阿尔茨海默#
49
👍
110