Nat Commun:哈佛医学院研究团队发表可共享大型儿童肿瘤患者队列的临床及基因组数据,助力儿科癌症精准医疗
2024-08-05 测序中国 测序中国 发表于上海
这项研究揭示利用医院基因组测序数据可为正在进行和未来的精准肿瘤学临床试验提供信息,并强调了数据共享的重要性,能够为临床实践中大量罕见儿科癌症确定基因组格局和靶向治疗机会。
全球每年有40多万儿童和青少年被诊断出罹患肿瘤,但仅有一半患儿能被诊断出;在过去半个世纪里,得益于化疗强化、风险分层和多模式疗法等治疗方案,儿童及青少年癌症患者的生存期被大大延长。尽管取得了不错的进展,但目前癌症依旧是全球儿童疾病死亡的主要原因,并且有许多儿童癌症幸存者因治疗遭受了严重的长期后遗症。此外,一些特定的儿科癌症诊断结果改善甚微,患者仍然承担不成比例的治疗相关副作用负担,如儿童、青少年和年轻成人(AYA)脑肿瘤和肉瘤患者等。
近年来,精准肿瘤学的出现与发展为儿科癌症的治疗带来了新的希望,通过对基因组进行癌症类型特异性表征,并使用研究性或已批准药物进行分子靶向治疗,可改善治疗效果、降低治疗副作用。在许多癌症中,基因组表征还促进了与治疗反应和耐药性相关的生物学亚型的分类,以及风险分层治疗方案的开发。但由于许多儿童脑肿瘤和实体肿瘤的罕见性,科研人员无法纳入足够的患者构建临床-基因组数据库,无法进行有意义的基因组分析来指导精准肿瘤学。
近日,美国哈佛大学医学院的科研人员在Nature Communications上发表了题为“Molecular profiling of 888 pediatric tumors informs future precision trials and data-sharing initiatives in pediatric cancer”的文章。研究团队对在丹娜法伯/波士顿儿童癌症和血液疾病中心进行测序的大型非选择性实体肿瘤患者队列进行了诊断分类、评估其突变谱并识别与试验匹配的基因组变异;其中,使用OncoPanel(一种靶向NGS DNA测序panel)对肿瘤进行测序,诊断则根据国际肿瘤学疾病分类(ICD-O-3.2)进行分类。总体而言,33%患者至少有一个变异符合精准肿瘤学试验方案,14%患者接受了分子靶向治疗。
综上,这项研究揭示利用医院基因组测序数据可为正在进行和未来的精准肿瘤学临床试验提供信息,并强调了数据共享的重要性,能够为临床实践中大量罕见儿科癌症确定基因组格局和靶向治疗机会。

文章发表在Nature Communications
主要研究内容
纳入分析队列的儿科患者的临床特征
据悉,自2013年以来,丹娜法伯癌症研究中心/波士顿儿童癌症与血液疾病中心的所有癌症或疑似癌症患儿均有机会参与一项机构测序研究——Profile癌症研究,该研究能够生成临床级靶向NGS数据,这为分析罕见、超罕见儿童肿瘤基因组特征提供了机会。截止2019 年3月,共有1120名患有颅内(CNS)或颅外实体瘤的儿科患者同意并参加了这一研究。
经筛选,研究团队纳入了888名实体瘤儿科患者组成最终分析队列,所有患者均完成了体细胞OncoPanel测序(图1)。该队列中,颅外实体瘤患儿共512人(58%),中枢神经系统(CNS)肿瘤患儿共376人(42%);初诊中位年龄为7.66岁;56%患者为男性,65%为白人。60%颅外实体瘤在诊断时的肿瘤分期为局限性,29%为转移性疾病。此外,92%样本来自原发肿瘤部位;73%样本为治疗前初诊样本。
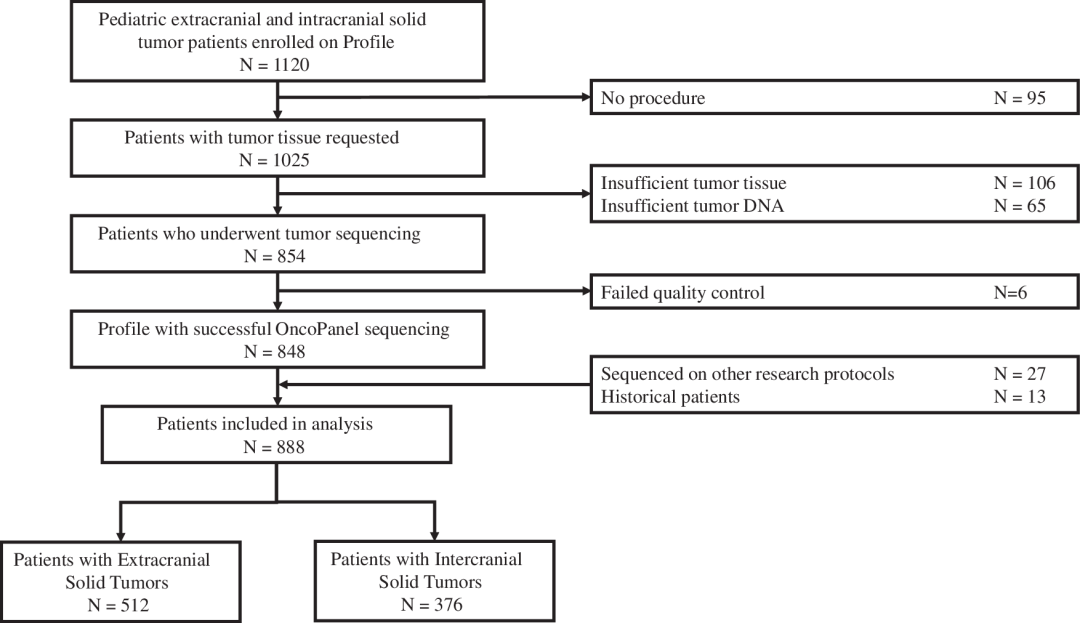
图1.分析队列确定流程图
多学科小组对病理报告进行审查后,研究团队根据ICD-O-3.2对患者诊断进行了确认和统一分类,发现该分析队列中有95种不同的组织学癌症类型(图2)。其中,有10种为常见儿科癌症,患病人数占55%;其余85种为罕见儿科癌症,患病人数达45%。常见的儿科癌症诊断有神经母细胞瘤、低级别星形细胞瘤、Wilms肿瘤、髓母细胞瘤和毛细胞星形细胞瘤等。
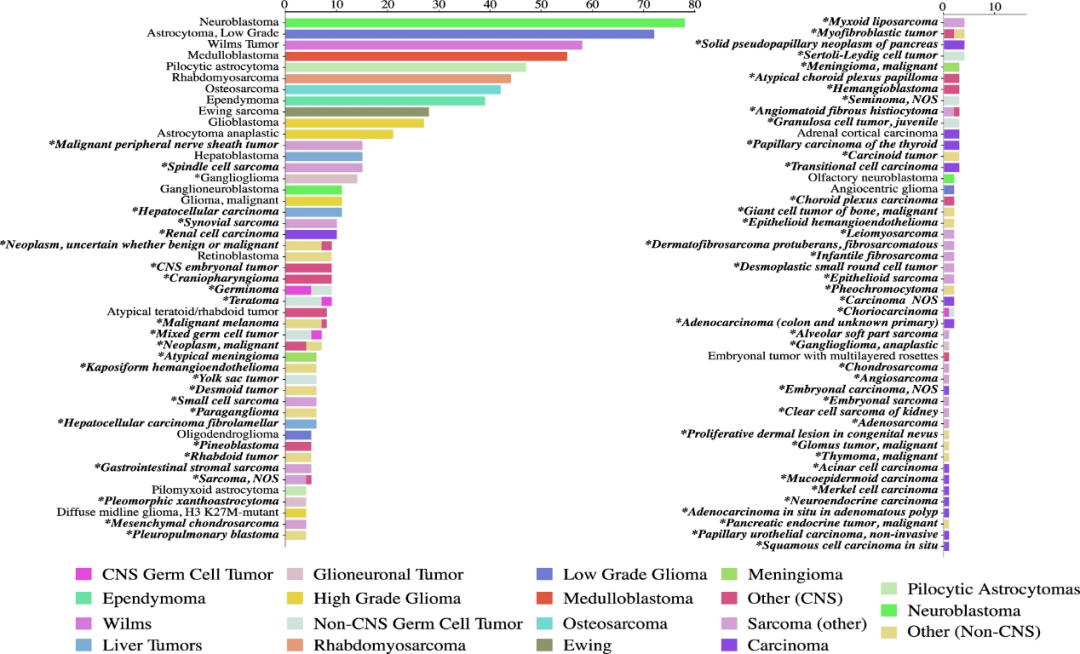
图2.分析队列包含的儿科癌症类型
从比例上看,该分析队列中的颅外实体肿瘤诊断与2014-2018年美国国家癌症研究所(NCI)国家儿童癌症登记处(NCCR)人群相似;但该队列癌症的比例(6.8%)低于NCCR队列(26.8%)(图3)。这种差异可能因NCCR队列包含了14.5%的AYA甲状腺癌患者所导致,研究团队在儿科肿瘤学实践中通常不接触这些病例。
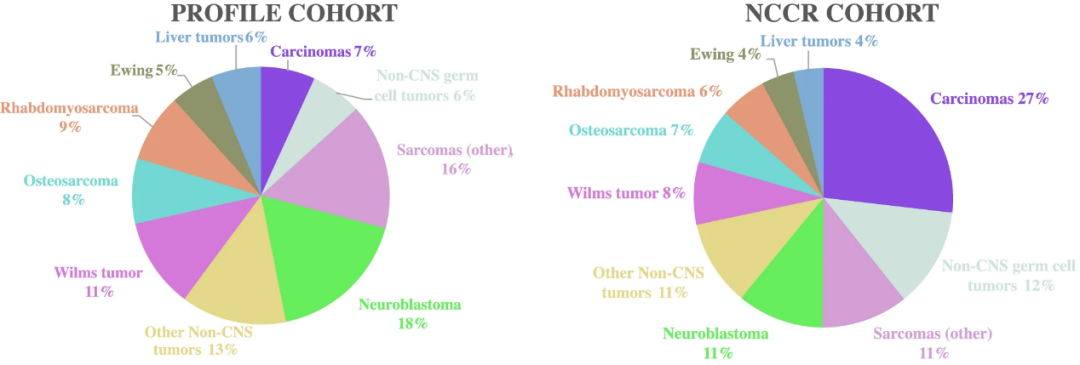
图3.该研究队列与NCCR队列的颅外实体瘤分布比较
致癌基因组突变鉴定与靶向疗法应用
为确定具有符合分子靶向治疗临床试验资格标准的肿瘤变异患者或具有临床指证药物的患者,研究团队使用了三个大型精准医学篮式实验的可操作性目标突变(aMOI)数据,即NCI-COG Pediatric MATCH试验、NCI-MATCH试验与ASCO TAPUR研究,并结合队列研究来确定致癌突变基因(图4)。总体而言,分析队列中33%患者的肿瘤至少具有1个致癌基因组变异与三项试验中至少1项的靶向治疗组相匹配。
与3项试验治疗组相匹配且具有可操作肿瘤变异的患者人数分别为238人、227人和 124人;75名患者的肿瘤变异与所有3项试验中的一个治疗组相匹配。aMOIs出现率最高的基因为:BRAF、NF1、CDKN2A、PI3KCA、NRAS/KRAS、BRCA2、ALK和FGFR1。
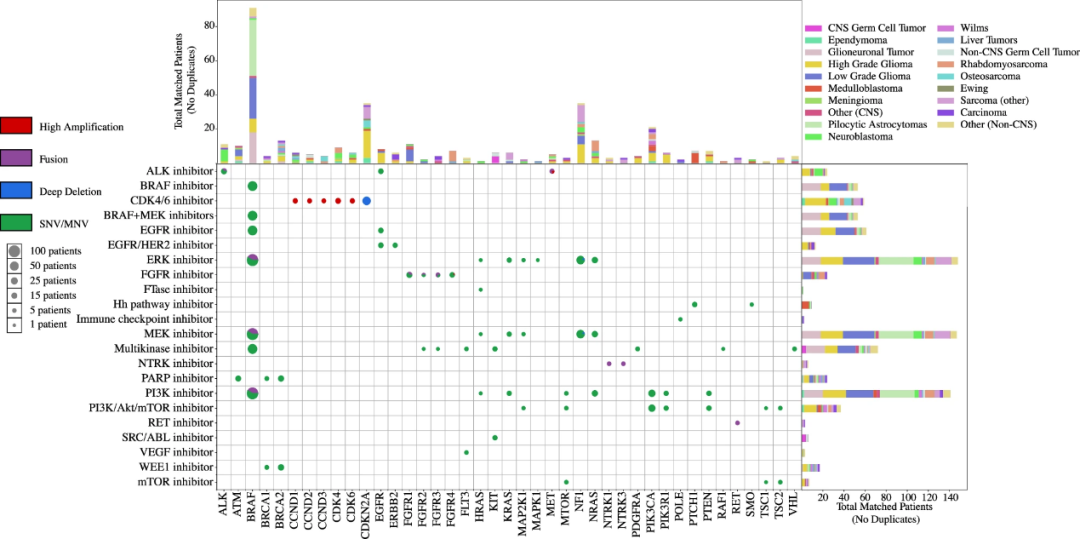
图4.与3项精准医学篮式实验的靶向治疗组匹配的致癌基因组变异
研究团队发现,与精准肿瘤治疗方案相匹配的变异患者比例因诊断而异。由BRAF突变驱动的神经胶质瘤、高级别胶质瘤和毛细胞星形细胞瘤的匹配率最高,分别为89%、70%、64%;尤文肉瘤和Wilms细胞瘤的匹配率最低,分别为7%和12%。
研究团队回顾了含有精准医疗篮式试验aMOIs的肿瘤患者的处方数据和医疗记录,以确定其是否接受了相应靶向治疗(图 5)。在289例患者中,41人(14%)接受了48种匹配的分子靶向治疗。在接受匹配分子靶向治疗的患者中,只有12%患者参与了临床试验,而88%的患者通过单一患者方案或非适应症用药接受匹配治疗。
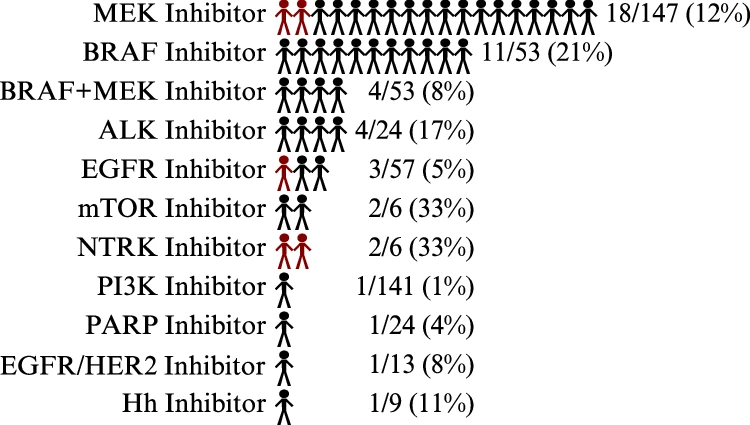
图5.患者接受靶向治疗以鉴定aMOIs
超罕见癌症中独特存在的致癌基因突变
研究团队分别分析了该研究队列中颅外实体恶性肿瘤与CNS肿瘤的复发性基因组突变情况,并评估了75种罕见颅外实体瘤与CNS肿瘤中独特富集的致癌突变(图6)。在>5%的颅外实体瘤病例中,最常见的复发性致癌突变包括TP53突变/缺失、MYC/MYCN扩增和CTNNB1突变;在>5%的CNS肿瘤病例中,最常见的致癌突变是BRAF重排/突变、TP53突变/缺失和CDKN2A/B缺失。
在235例未纳入先前儿科泛癌分析的颅外实体瘤中,具有独特致癌性突变的基因(与常见肿瘤相比)是CTNNB1、DICER1和NF1。在78个未纳入先前儿科泛癌分析的CNS肿瘤中,具有独特致癌性突变的基因(与常见肿瘤相比)是CTNNB1、NF2和KIT。同时存在于罕见CNS和颅外实体瘤中、可能成为精准治疗靶点的独特基因组改变包括:ERBB2激活突变,CNS和非CNS生殖细胞肿瘤中的KIT激活突变,以及肝脏肿瘤、骨纤维瘤和颅咽管瘤中的CTNNB1失活突变。
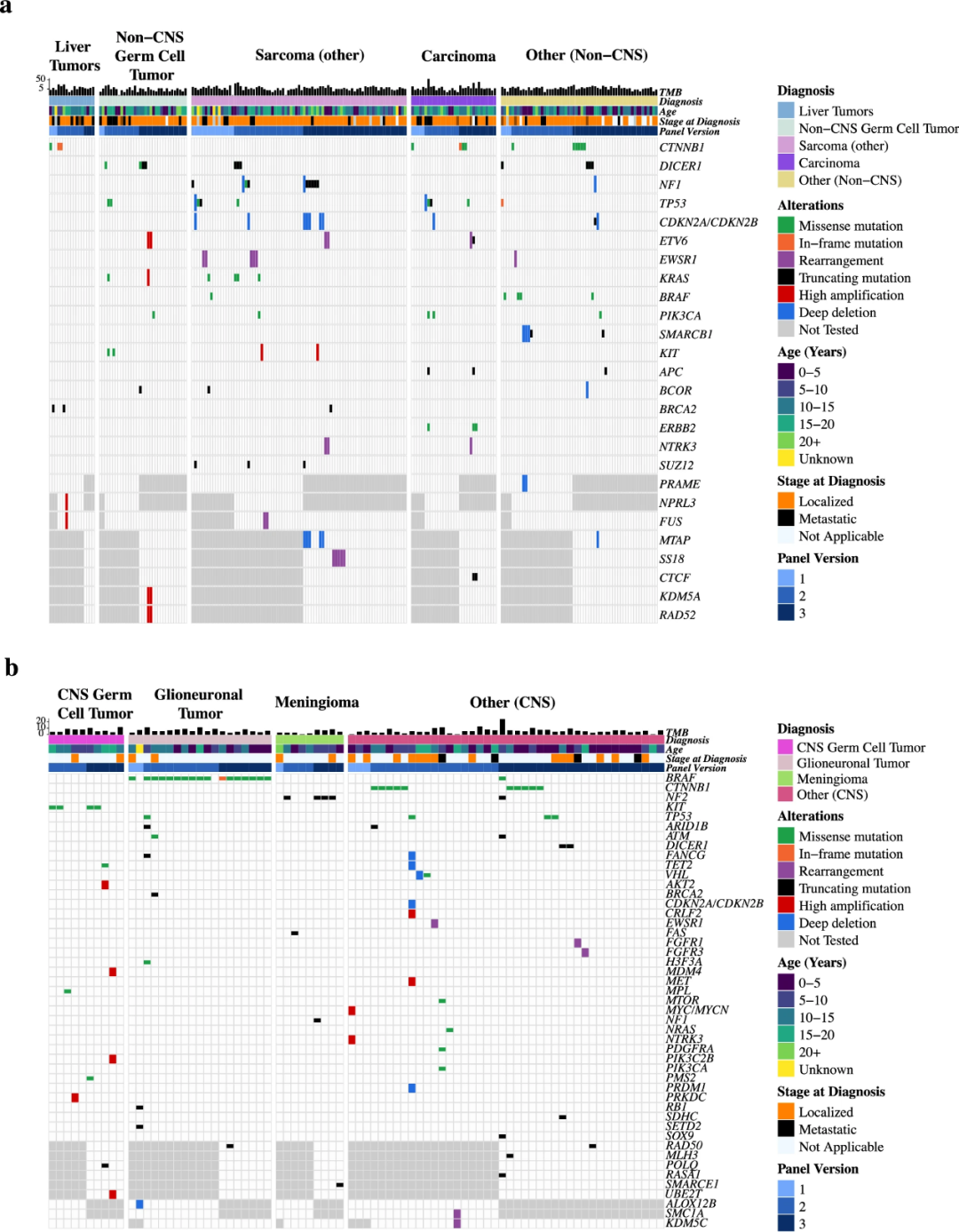
图6.OncoPrint显示最常见致癌改变(未纳入先前儿科泛癌分析)
据悉,这项研究的测序数据将与NCI的CCDI共享;特别地,这些测序数据还保留了与丹娜法伯/波士顿儿童癌症和血液疾病中心的电子病历(EMR)的链接,科研人员能够对这些基因组数据进行更全面的注释,可提供完整的癌症诊断、治疗和结果信息。
综上所述,研究团队深入解析了888名儿科癌症患者的测序及临床数据,综合分析了癌症患儿的临床特征、鉴定了高变的致癌基因突变,并探究了与致癌基因相匹配的靶向疗法在癌症患儿中的应用。该研究阐明了罕见儿科颅外实体瘤与CNS肿瘤的测序图谱及临床特征,并将所得基因组数据与配对临床数据共享给广大团队,这种详细的数据收集和共享模式可作为未来研究的范例。
该研究基因组与临床数据已提交CCDI,可在基因型与表型数据库(dbGaP)中查询:
https://www.ncbi.nlm.nih.gov/projects/gap/cgi-bin/study.cgi?study_id=phs002677.v1.p1
参考文献:
Forrest, S.J., Gupta, H., Ward, A. et al. Molecular profiling of 888 pediatric tumors informs future precision trials and data-sharing initiatives in pediatric cancer. Nat Commun 15, 5837 (2024). https://doi.org/10.1038/s41467-024-49944-0
https://www.nature.com/articles/s41467-024-49944-0#Ack1
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














#精准医疗# #儿科癌症#
4