Nature Communications: 用于腺相关病毒基因治疗的人源化小鼠模型
2024-03-27 MedSci原创 MedSci原创 发表于上海
随着基因治疗技术的迅速发展,人们对于治疗基因相关疾病的方法和效果越来越感兴趣。然而,评估基因治疗策略的有效性往往需要进行大量的动物实验,而常规的小鼠模型由于其与人类生物学特征的差异,限制了其在基因治疗
随着基因治疗技术的迅速发展,人们对于治疗基因相关疾病的方法和效果越来越感兴趣。然而,评估基因治疗策略的有效性往往需要进行大量的动物实验,而常规的小鼠模型由于其与人类生物学特征的差异,限制了其在基因治疗研究中的应用。因此,为了更准确地评估基因治疗在人类身上的效果,建立一种人源化小鼠模型显得尤为重要。

腺相关病毒(AAV)是一种常用的基因治疗载体,经过多年的载体开发和临床试验,两种不同的AAV血友病基因疗法(Hemgenix和Roctavian)已获得FDA批准。临床前开发的一个重要教训是,实验动物模型很难预测人类 AAV 转导和体内药理学。尽管目前评估的所有 AAV 血清型在实验动物模型中都显示出亲肝性,但肝脏和其他器官中的摄取、入核、脱壳、第二链合成以及转基因表达/沉默方面存在差异。
人肝嵌合小鼠允许在体内验证 AAV 在原代人肝细胞中的作用。这些人源化小鼠实现了高人嵌合性,可用于评估体内人肝细胞的 AAV 转导效率。
在这项研究中,作者描述了一种人类肝脏嵌合非转基因TIRFA小鼠模型,通过将肝脏人源化与AAV受体(AAVR)相结合,克服了这一翻译障碍消融,使小鼠细胞不允许 AAV 转导。使用人肝嵌合 TIRFA 小鼠,研究人员证明与野生型 AAVR 人源化小鼠相比,临床使用的 AAV 血清型在原代人肝细胞中的转导有所增加。此外还证明了 AAV 在人畸胎瘤来源的原代细胞和肝癌组织中的转导,展示了人源化 TIRFA 小鼠的多功能性。
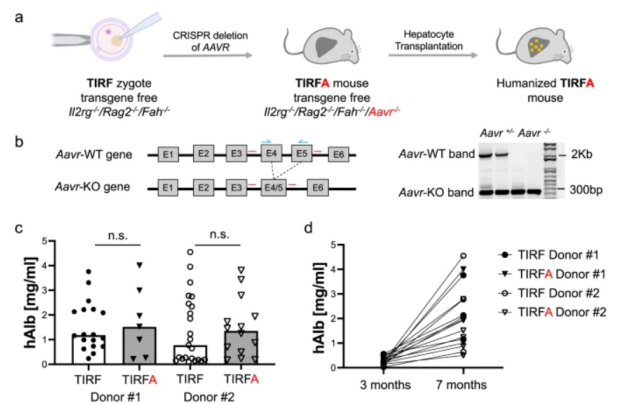
为了充分利用 TIRFA 小鼠的人源化,研究人员生成了人类畸胎瘤模型,该模型可从所有三个胚层产生人体组织。这样的模型应该能够在任何所需的人体组织中验证 AAV 的向性。同样,研究人员将患者来源的人类肝癌组织移植到人源化 TIRFA 肝脏中,并以相同剂量注射 AAV9-tdTomato 载体。正如预期的那样,研究人员在人类原代肝细胞和人类肝癌样本中检测到了 tdTomato。
总之,该研究引入了一种多功能小鼠模型,可以在体内选择性地研究 AAV 的趋向性和生物学特性。结果证明,AAV 载体在人肝嵌合 TIRFA 小鼠中静脉注射时,可以更容易地转导人肝细胞而不是鼠肝细胞,并且可用于评估其他人类细胞和靶组织。TIRFA小鼠克服了当前实验动物模型所带来的重大限制,并且应该能够预测肝脏定向AAV基因疗法的体内药理学以及在人类环境中研究AAV生物学。
原始出处:
Barzi, M., Chen, T., Gonzalez, T.J. et al. A humanized mouse model for adeno-associated viral gene therapy. Nat Commun 15, 1955 (2024). https://doi.org/10.1038/s41467-024-46017-0
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#基因治疗# #腺相关病毒基因治疗#
46