Nat Commun:阜外医院汪一波教授团队发现ZFYVE28为胰岛素抵抗的潜在治疗新靶点
2023-11-04 论道心血管 论道心血管 发表于加利福尼亚
ZFYVE28促进磷酸化胰岛素受体降解的调控作用。在机制上,ZFYVE28通过其FYVE结构域与细胞内体共定位,并促进早期内体向晚期内体转化,从而促进磷酸化胰岛素受体的降解,介导胰岛素抵抗的发生发展。
肥胖是全球主要的公共卫生问题之一,胰岛素抵抗(Insulin resistance, IR)是肥胖人群常见的并发症之一,与多种疾病的发生密切相关,包括糖尿病、代谢综合征、血脂异常、高血压及众多心血管疾病1。然而,尽管大多数肥胖患者表现出胰岛素敏感性受损,但约30%的肥胖患者仍然维持正常的代谢指数,胰岛素敏感性与健康人相似,被称为代谢健康的肥胖2,3。这部分人群与胰岛素抵抗的患者的生化和分子调控机制的差异尚未明确,深入了解胰岛素抵抗的分子机制对改善胰岛素敏感性和预防相关的心血管疾病是十分重要的。
中国医学科学院阜外医院汪一波教授团队长期从事心血管病遗传机制研究,在心血管代谢方面,近年来发现ANKRD36通过影响钠代谢参与盐敏感高血压(Circ Res 2021),而SDC3引起的代谢异常是国人难治性高血压显著危险因素(BMC Med 2022),代谢综合征甲低缘于甲状腺素β受体基因的甲基化异常,T3生理剂量的补充则可以系统性改善表型(Hypertension 2021);在血管稳态方面,揭示了体细胞突变是散发动静脉畸形和海绵状血管畸形的核心遗传机制(Brain 2019/2021/2023, Exp Mol Med 2023)。详细见:Brain:中国医学科学院阜外医院汪一波教授团队发现GPRASP1突变参与动静脉畸形的新机制
2023年10月26日,中国医学科学院阜外医院汪一波教授团队在Nature Communications上发表题为“ZFYVE28 mediates insulin resistance by promoting phosphorylated insulin receptor degradation via increasing late endosomes production”的研究论文。该研究首次发现了ZFYVE28在单纯性肥胖和胰岛素抵抗的两种状态下的表达差异,并揭示了ZFYVE28促进磷酸化胰岛素受体降解的调控作用。在机制上,ZFYVE28通过其FYVE结构域与细胞内体共定位,并促进早期内体向晚期内体转化,从而促进磷酸化胰岛素受体的降解,介导胰岛素抵抗的发生发展。因此,靶向ZFYVE28可作为改善胰岛素抵抗、预防相关心血管疾病的新的潜在靶点。
ZFYVE28是一种锌指蛋白FYVE包含蛋白28基因,它的Lys-87 处的单泛素化可防止与磷脂酰肌醇 3-磷酸 (PI3P) 结合并定位到早期内体膜。ZFYVE28是表皮生长因子受体 (EGFR) 信号传导的负调节因子。 当未单泛素化时,通过促进内涵体中的 EGFR 降解发挥作用。

首先,研究人员发现ZFYVE28在胰岛素敏感性正常的肥胖患者中表达降低,但在胰岛素抵抗的代谢综合征患者中表达升高。为了进一步研究ZFYVE28表达水平与胰岛素敏感性的关系,研究人员通过不同时间的高脂饮食(high-fat diet, HFD)喂养来构建肥胖和胰岛素抵抗的小鼠模型,并通过葡萄糖耐受实验(glucose tolerance test, GTT)和胰岛素耐受实验(insulin tolerance test, ITT)来检测小鼠的胰岛素敏感性。研究人员选取了4周HFD喂养的代谢正常的小鼠作为肥胖模型,而选取12周HFD喂养的小鼠作为胰岛素抵抗模型,检测了肥胖小鼠和胰岛素抵抗小鼠不同组织中Zfyve28的表达水平。结果显示,在肥胖小鼠的肝脏组织中,Zfyve28表达水平下降,而在胰岛素抵抗小鼠的肝脏组织中,Zfyve28表达水平上升(图1)。
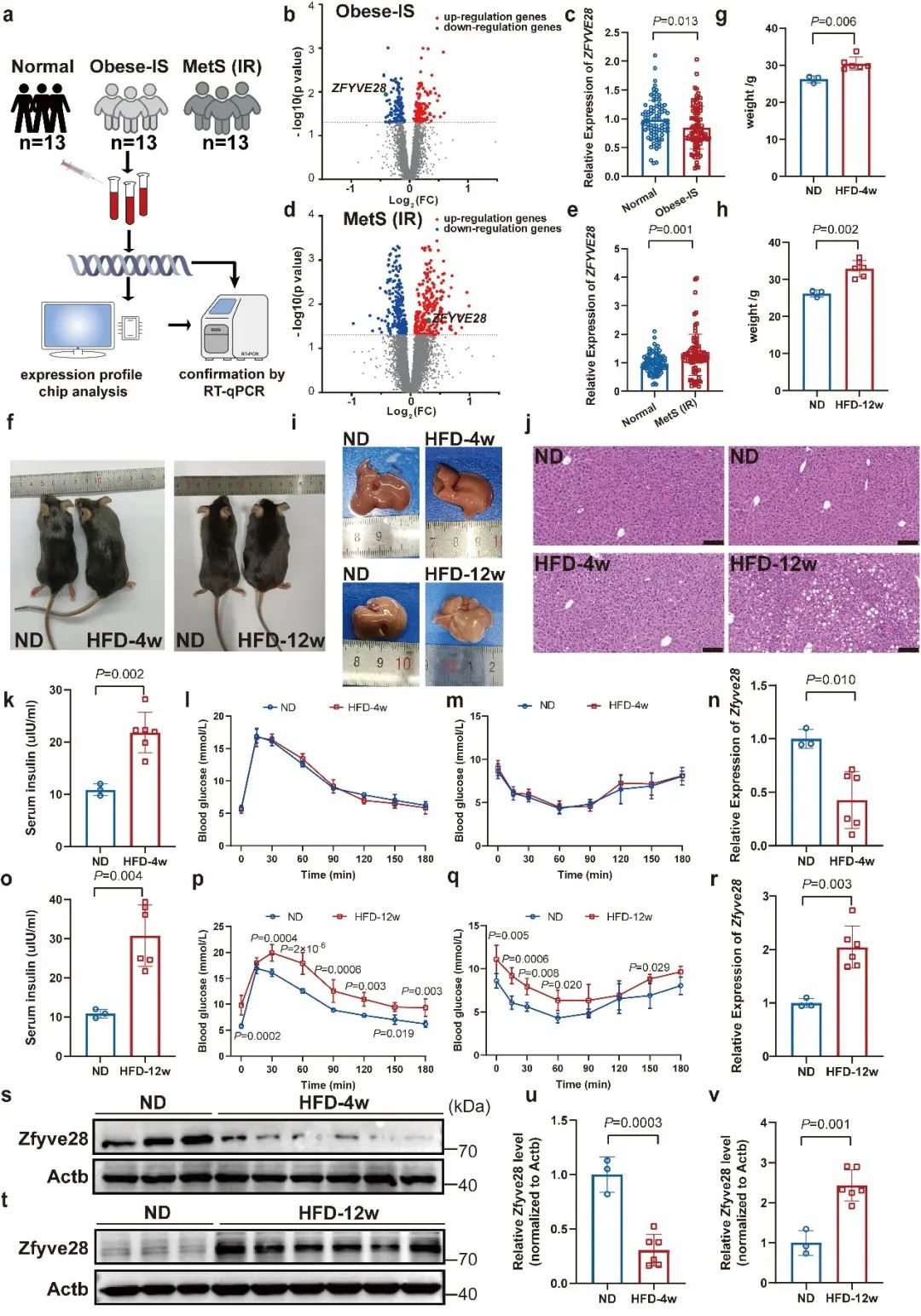
图1. ZFYVE28在胰岛素敏感性正常的肥胖个体中表达降低,但在胰岛素抵抗的个体中表达升高
ZFYVE28表达水平的差异引起了研究人员极大的兴趣。接下来,研究人员通过体内和体外实验,在HepG2工具细胞和小鼠原代肝细胞中证实,NOTCH1调控ZFYVE28的表达,而胰岛素通过抑制NOTCH1通路来抑制ZFYVE28的表达。在代谢正常的肥胖个体中,代偿性升高的胰岛素水平进一步抑制了ZFYVE28的表达;而在胰岛素抵抗的个体中,由于胰岛素信号传导的受损,ZFYVE28的表达不再被抑制。这解释了ZFYVE28在代谢正常的肥胖个体和胰岛素抵抗个体中表达水平的差异。
为了进一步研究ZFYVE28在胰岛素抵抗中的作用,研究人员通过尾静脉注射AAV9-pTBG-Zfyve28构建了Zfyve28肝脏特异性表达的小鼠模型,发现在HFD诱导下,Zfyve28过表达显著损害了小鼠的胰岛素敏感性,并引起了血清及脏器甘油三酯、胆固醇含量的升高。研究人员还构建了Zfyve28全身性敲除(KO)和肝脏特异性敲除(LKO)的小鼠。有趣的是,在喂养HFD时,Zfyve28的敲除显著预防了小鼠的肝脏脂肪变性,改善了小鼠的胰岛素敏感性,并引起了小鼠肝脏中磷酸化胰岛素受体水平的升高。此外,Zfyve28敲除小鼠表现出更低的血清脂质水平、血压,以及改善的心脏微循环,肝脏和心脏的重量及脂质含量也低于对照组。总结来说,Zfyve28敲除鼠表现出更好的胰岛素敏感性和相关的心血管代谢指标(图2)。
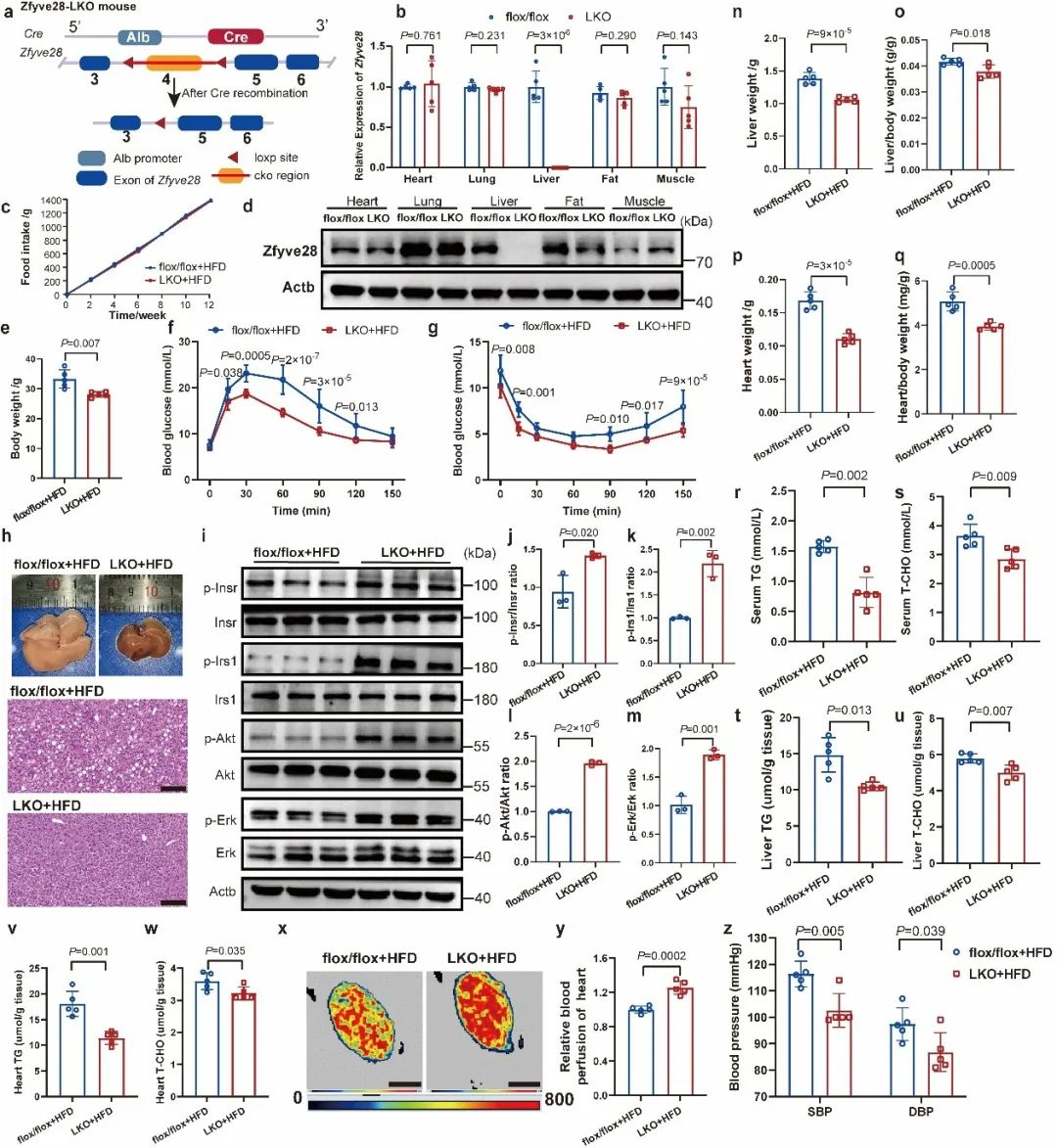
图2. Zfyve28肝脏特异性敲除改善了小鼠的胰岛素敏感性及相关的代谢指标
研究人员还深入探究了ZFYVE28参与胰岛素敏感性调控的分子机制。正常生理状况下,胰岛素受体在结合胰岛素后发生磷酸化,启动下游胰岛素信号级联反应;磷酸化的胰岛素受体随后会内吞进细胞早期内体中,并通过再循环内体回到细胞膜表面,或者通过晚期内体靶向溶酶体降解4,5。研究人员发现,ZFYVE28能显著促进胰岛素刺激后的磷酸化胰岛素受体的降解而非去磷酸化,且该作用与FYVE结构域密切相关。ZFYVE28通过其FYVE结构域,与早期内体共定位,并促进早期内体向晚期内体的转化,从而促进了磷酸化胰岛素受体的降解(图3)。
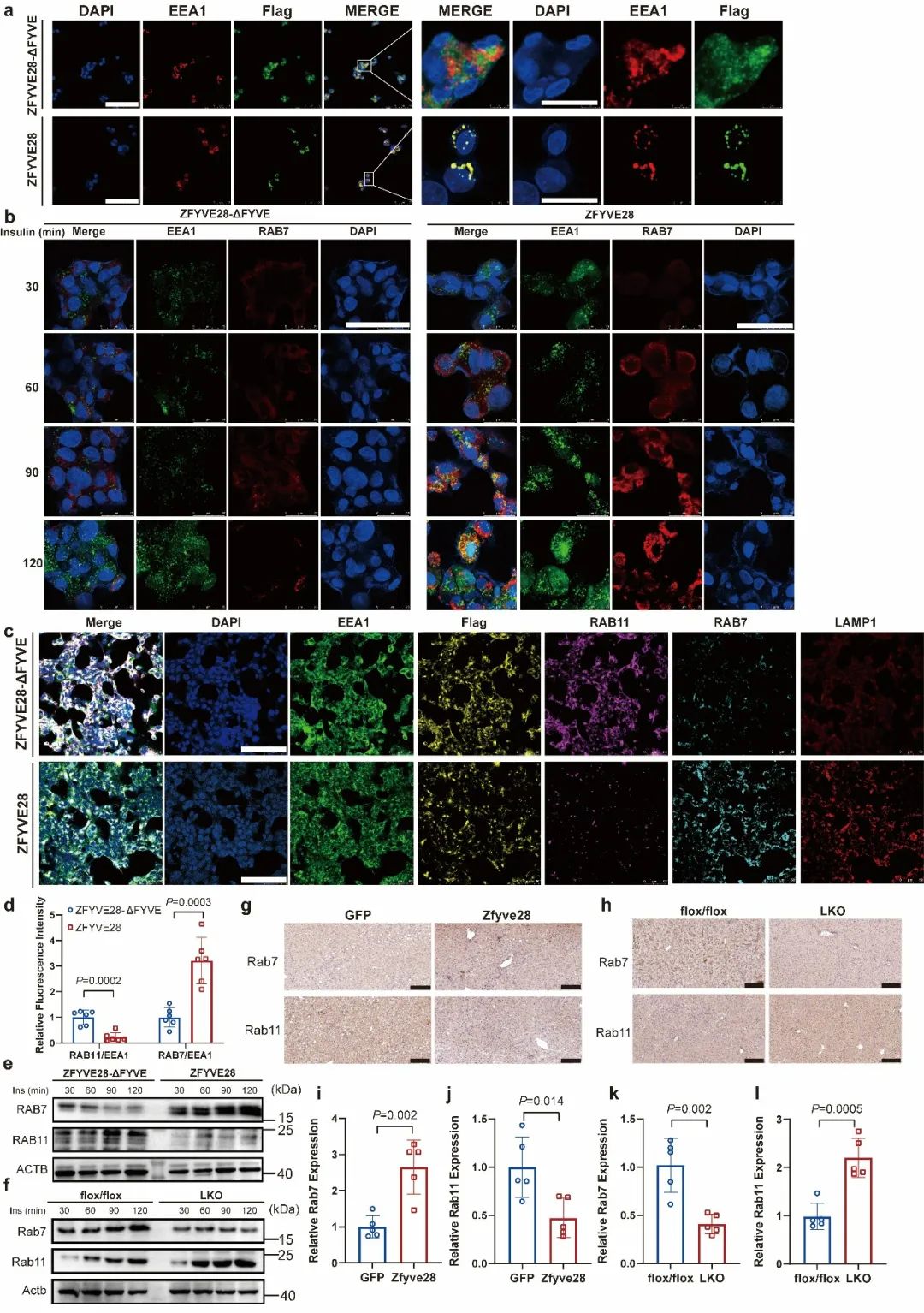
图3. ZFYVE28促进早期内体向晚期内体的转化
综上所述,本项研究的结果证实,ZFYVE28在胰岛素敏感性的调控中起重要作用,ZFYVE28的敲除可显著改善小鼠的胰岛素敏感性和相关的心血管代谢指标。研究人员还证实了胰岛素通过NOTCH1通路抑制ZFYVE28的表达,而在胰岛素抵抗的情况下,受损的胰岛素信号不再抑制ZFYVE28的表达,导致ZFYVE28表达水平的升高。机制上,ZFYVE28通过其FYVE结构域,与早期内体共定位,并促进早期内体向晚期内体的转化,从而促进了磷酸化胰岛素受体的降解(图4)。该研究首次发现了ZFYVE28在代谢正常和胰岛素抵抗的个体间的表达差异,并深入研究了ZFYVE28参与胰岛素抵抗的分子机制。ZFYVE28可作为潜在的改善胰岛素抵抗及预防相关心血管疾病的新的靶点
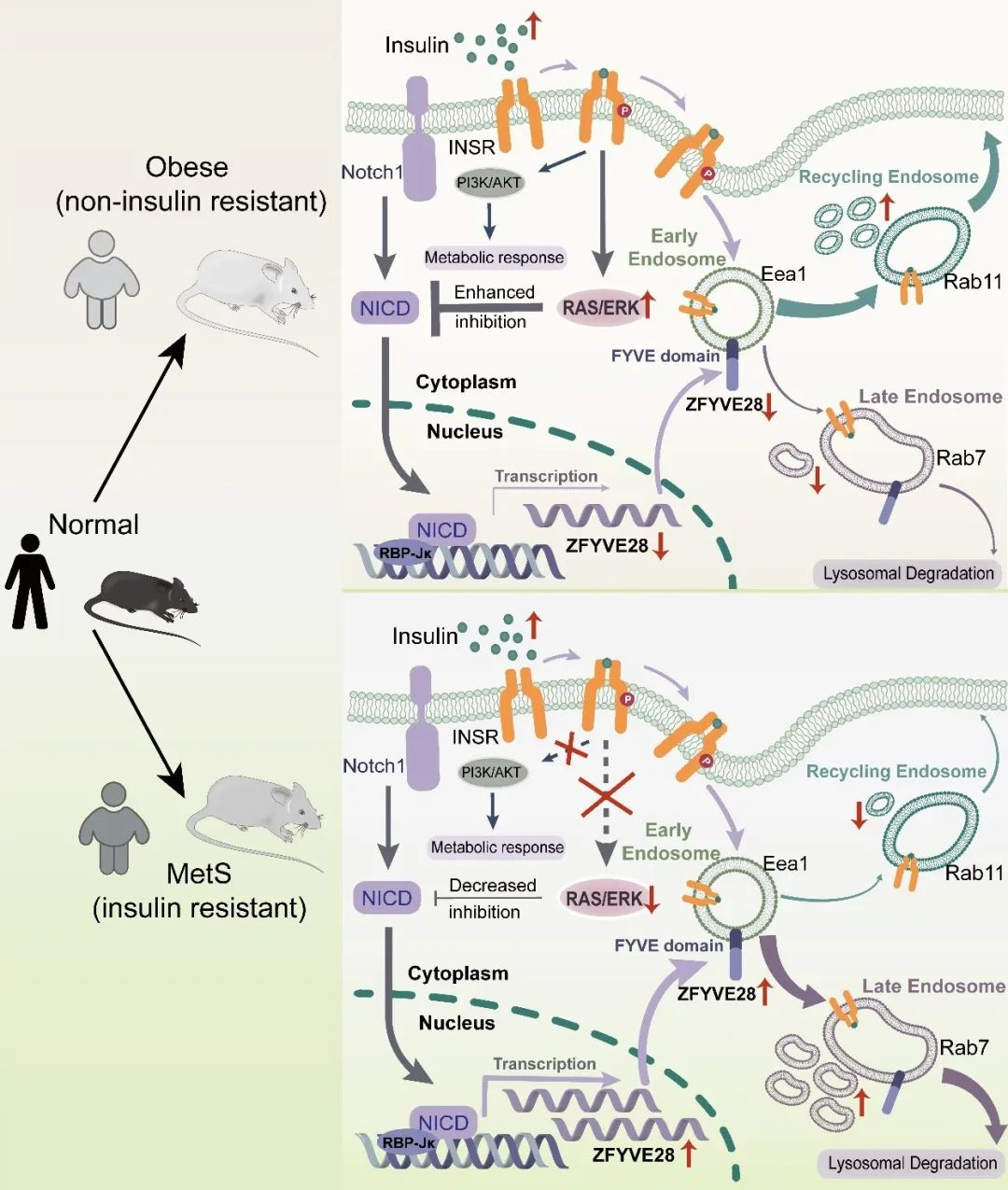
图4. ZFYVE28参与胰岛素抵抗的调控机制图
中国医学科学院阜外医院汪一波教授为本文的通讯作者。研究生虞亮、徐梦晨、闫宇鹏和黄书晨为本文的共同第一作者。该项研究得到了国家自然科学基金、科技部重大专项、医科院创新工程及心血管疾病国家重点实验室的资助和支持。
参考文献:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言