新加坡南洋理工AFM:阳离子抗菌剂,用于激活式抗菌治疗!
5小时前 BioMed科技 BioMed科技 发表于上海
该研究提出了一种通过静电作用形成的聚离子复合物,它由一种强效的阳离子聚咪唑和一种阴离子脂肪酶可降解的共聚物构成,具有选择性抗菌活性。
新加坡南洋理工Hongwei Duan/Mary B. Chan-Park提出了一种自组装的“笼式”策略,用于安全递送具有非特异性毒性的强效阳离子抗菌剂,以有效治疗体内系统性细菌感染。关键发展是合成了一种新型嵌段共聚物,由聚(乙二醇)(PEG)隐形块和阴离子及脂肪酶可降解的聚(ε-己内酯)(PCL)和含磷酸基的甲基丙烯酸酯共聚物组成,通过甲基丙烯酸酯和环酯的混合共聚合成。阴离子块与阳离子抗菌剂通过静电作用形成中性电荷的聚离子复合物,表面带有PEG块。PCL组分赋予纳米复合物以细菌分泌脂肪酶的生物降解性。在概念验证研究中,具有极好抗菌活性但严重毒性的阳离子聚咪唑啉被嵌段共聚物包装成纳米复合物,这些复合物在高盐和蛋白质浓度的复杂环境中稳定,并在细菌分泌的脂肪酶降解共聚物时释放抗菌剂。聚咪唑啉的“笼式”配方消除了其毒性,并实现了与游离聚咪唑啉相当的高效杀菌性能。这种笼式策略不需要对阳离子抗菌剂进行复杂的化学修饰,提供了一种广泛适用的配方策略,以克服其常见的毒性问题,这一问题已成为主要的转化障碍。该研究以题为“Enzyme-Responsive Polyion Complex Nanoparticles of Cationic Antimicrobials for Activatable Antibacterial Therapy”的论文发表在《Advanced Functional Materials》上。

图1展示了通过自组装形成的聚离子复合纳米粒子的设计,这种设计利用了阳离子聚咪唑(PIM-E)和一种新型的阴离子可降解嵌段共聚物PEG-b-(PCL-co-PPMA)之间的静电作用。该共聚物由聚乙二醇(PEG)隐形块和聚(ε-己内酯)(PCL)及含磷酸基的甲基丙烯酸酯共聚物组成,通过混合这两种聚合物的水溶液实现了聚咪唑的电荷中和,形成了表面带有PEG块的中性电荷复合物。这种复合物在生理条件下稳定,并且能够在细菌分泌的脂肪酶作用下发生降解,从而释放出抗菌剂,实现对病原体的选择性杀伤。这种“笼式”策略不仅成功地将具有强效抗菌活性但同时具有严重毒性的阳离子聚咪唑封装进纳米复合物中,还在复杂环境中保持了稳定性,并在细菌分泌的脂肪酶作用下实现了有效释放,从而消除了其毒性,达到了与未封装聚咪唑相当的高效杀菌性能。
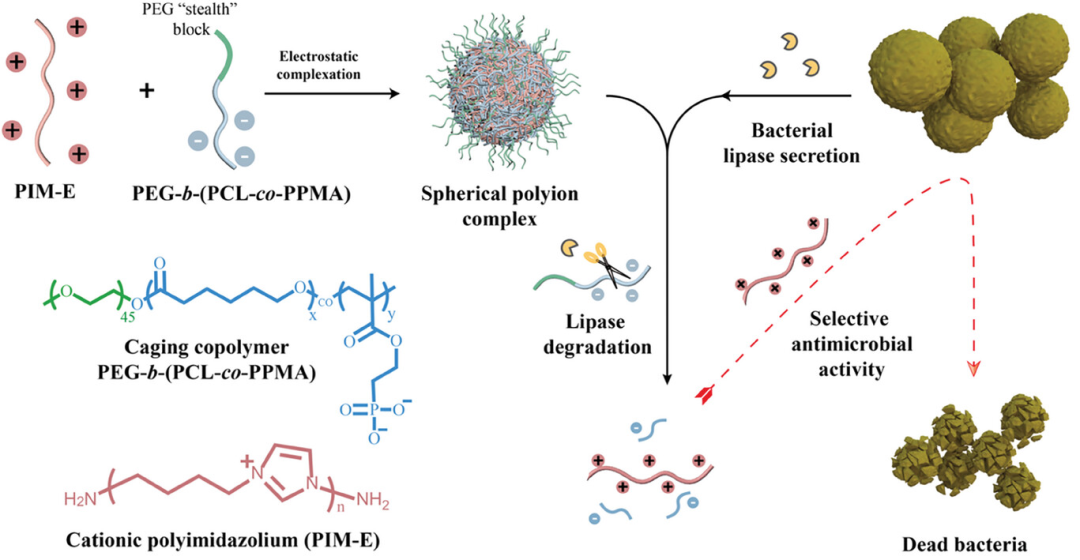
图1. 通过自组装形成的聚离子复合纳米粒子的设计,用于选择性抗菌活性
【自组装聚离子复合物的特征】
图2展示了自组装聚离子复合物的特性。这些数据表明,随着“笼式”共聚物与阳离子抗菌剂PIM-E比例的增加,复合物表面的电荷密度逐渐降低,实现了电荷的中和。TEM图像显示了脂肪酶处理后纳米粒子的解聚,证实了共聚物的降解导致复合物的解离。通过荧光共振能量转移(FRET)实验,进一步验证了复合物的形成和脂肪酶诱导的解离。因此,通过精确控制共聚物的组成和比例,成功制备了表面电荷中性、尺寸稳定、能够在特定酶作用下迅速解离释放有效抗菌成分的聚离子复合纳米粒子,这为实现抗菌剂的精准递送和活性控制提供了一种有效的策略。
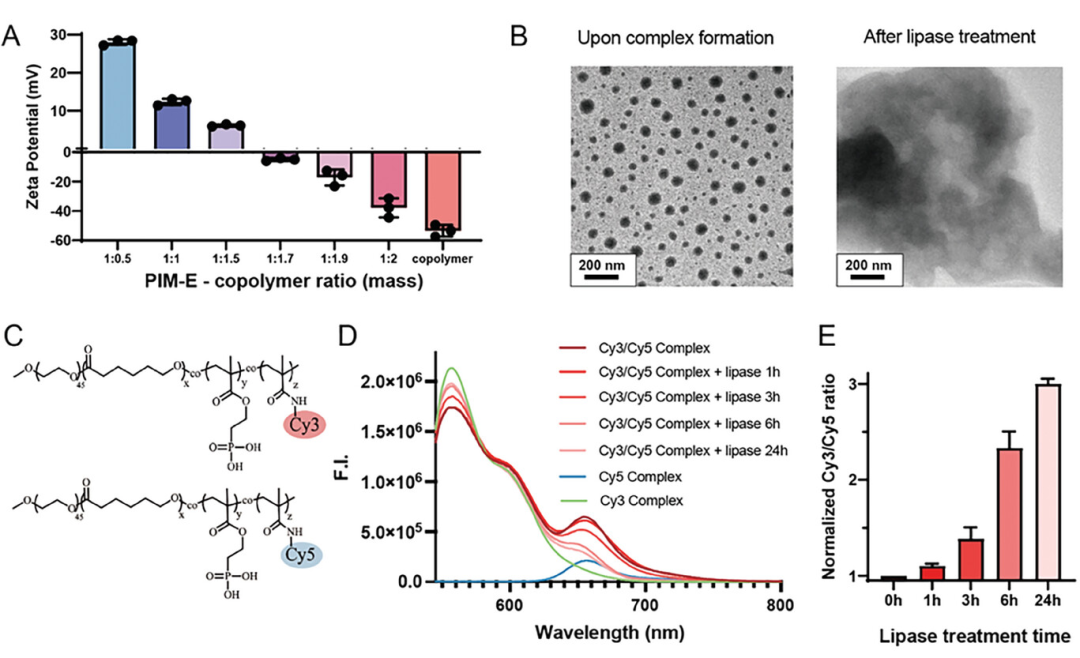
图2. 自组装聚离子复合物的特征
【体外选择性抗菌效果】
图3展示了体外选择性抗菌效果的实验结果。实验结果表明,复合物对分泌脂肪酶的MRSA表现出显著的抑制效果,而对不分泌脂肪酶的E. faecalis几乎没有影响。此外,当在培养基中加入外源性脂肪酶时,复合物能够恢复对E. faecalis的抑制能力。这些数据支持了设计原则:特定细菌菌株分泌的脂肪酶能够降解复合物中的PCL,削弱多价静电相互作用,导致阳离子PIM-E从颗粒中解离并释放出来,发挥其抗菌效果。而对于不能分泌脂肪酶的菌株,复合物在培养基中保持完整,不会释放出杀菌的PIM-E。因此,这种基于聚离子复合物的“笼式”策略能够有效地在体外选择性地对特定细菌菌株发挥抗菌作用,并通过脂肪酶响应性释放机制,实现了对抗菌剂活性的精确控制。
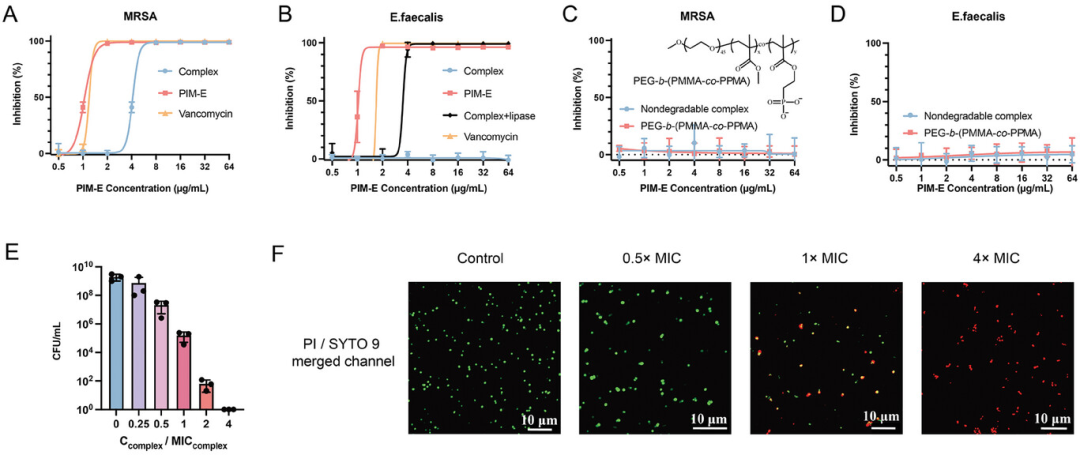
图3. 体外选择性抗菌效果
【复合物的体外和体内安全性评估】
图4评估了复合物的体外和体内安全性。体外细胞毒性测试显示,与阳离子抗菌剂PIM-E相比,电荷中性的复合物对3T3细胞的活性影响极小,因为PIM-E的正电荷被生物相容的阴离子共聚物完全中和。细胞膜渗透性染色结果表明,PIM-E处理的细胞虽然形态完整,但细胞膜通透性显著增加,而复合物处理的细胞则未影响细胞膜完整性。在体内安全性研究中,通过腹膜注射(I.P.)给药,监测小鼠连续14天的体重变化,发现PIM-E单剂量给药导致小鼠体重迅速下降,而复合物重复给药则仅引起体重的微小波动或总体增长。血液生化标记物分析也表明,PIM-E给药的小鼠肝脏和肾脏损伤标志物水平升高,而复合物给药的小鼠这些标志物水平仅有轻微波动。因此,与单独的PIM-E相比,复合物显著降低了体内毒性,并且在安全性窗口内展现了良好的生物相容性,为阳离子抗菌剂的临床转化提供了一种有效的安全策略。
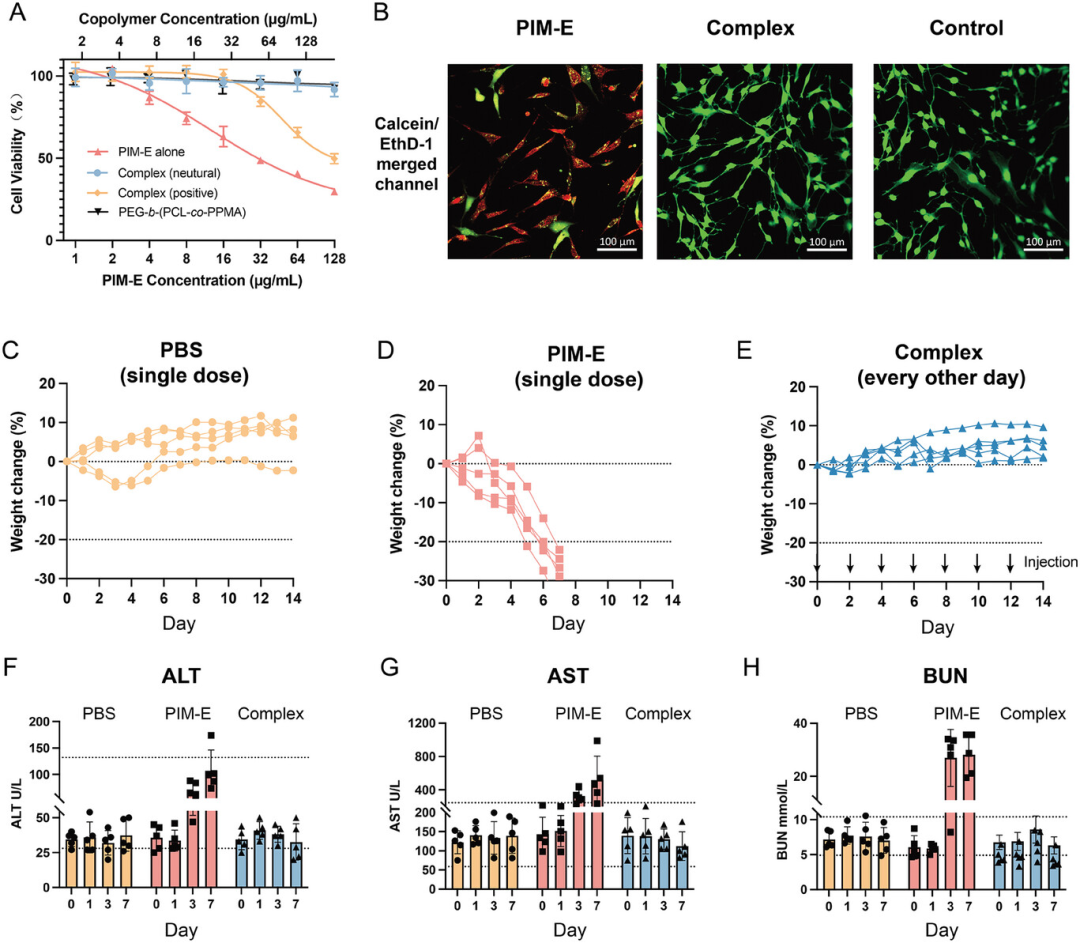
图4.复合物的体外和体内安全性评估
【复合物的体内治疗效果】
图5展示了复合物在体内治疗系统性MRSA感染的效果。实验通过腹膜注射细菌悬浮液建立小鼠MRSA感染模型,然后给予不同治疗,并记录了小鼠14天内的生存状况和体重变化。结果显示,接受PBS和单剂量PIM-E治疗的小鼠在感染后2到5天内全部死亡,而接受复合物治疗的小鼠则全部存活。尽管最初体重有所下降,但随后逐渐恢复至正常水平。此外,对另一组小鼠在治疗24小时后进行的器官细菌负荷测定显示,与PBS处理组相比,接受PIM-E和复合物治疗的小鼠在所有测试器官(包括腹膜液、肝脏、脾脏和肾脏)中的MRSA计数显著减少。因此,复合物在安全剂量下不仅减轻了系统性感染小鼠的细菌负荷,而且有助于提高其生存率,显示出与PIM-E相似的体内抗菌效果,表明这种阳离子抗菌剂的“笼式”复合物是治疗多重耐药细菌引起的感染的有希望的替代品。
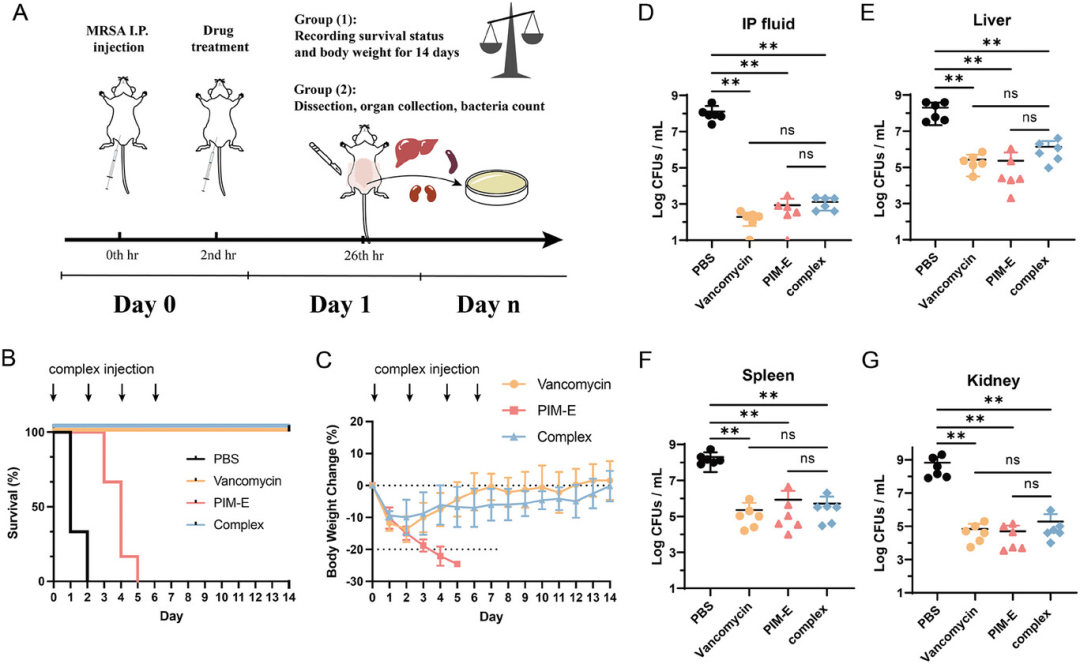
图5. 复合物的体内治疗效果
【小结】
该研究提出了一种通过静电作用形成的聚离子复合物,它由一种强效的阳离子聚咪唑和一种阴离子脂肪酶可降解的共聚物构成,具有选择性抗菌活性。通过聚离子复合物的形成,成功中和了聚咪唑的正电荷,使复合物对哺乳动物细胞的毒性降至最低。该“笼式”聚合物可被细菌脂肪酶降解,从而释放出自由的聚咪唑以杀灭分泌脂肪酶的菌株。动物实验证实了复合物相比单独的聚咪唑对小鼠的安全性更高,并显示出与聚咪唑相似的对抗系统性感染的抗菌效果。研究者们预期这种基于复合物的“笼式”策略能够普遍适用于解决包括天然来源和大规模筛选的抗菌肽在内的阳离子抗菌剂的毒性问题。
原文链接:
https://doi.org/10.1002/adfm.202407869
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言








前往app查看评论内容
1 0