血浆NGS跟踪EGFR突变非小细胞肺癌的克隆演变,以及C797S获得性突变的治疗
2024-01-27 苏州绘真医学 苏州绘真医学 发表于陕西省
研究者报告了3例携带EGFR突变的NSCLC患者,这些患者在奥希替尼治疗期间获得了EGFR C797S耐药突变,这些突变是通过血浆NGS检测的,患者接受了第一代或第二代EGFR TKIs治疗。
-
血浆NGS可追踪EGFR突变NSCLCs的克隆演变;
-
C797S突变是奥希替尼获得性耐药最常见的机制之一;
-
第一代TKI可靶向C797S突变,但应答通常是短暂的;
-
期待新的治疗策略来克服C797S突变。
研究背景
第三代EGFR TKI奥希替尼是携带常见EGFR突变晚期/转移性非小细胞肺癌(NSCLC)患者的首选一线治疗方案。正如在所有靶向治疗中观察到的那样,几乎所有接受奥希替尼治疗的患者都通过靶内和脱靶机制发生了获得性耐药。克服奥希替尼获得性耐药是一项高度未满足的医疗需求,而且在临床实践中,目前尚无获得批准的靶向药物可用于这些患者。在不同的耐药机制中,获得性EGFR C797S突变是最常见的突变之一,报道的发生率为6%-24%。C797S突变是一种发生较晚的耐药机制,在奥希替尼二线治疗后更为常见,并且可能使肿瘤对第一代或第二代EGFR TKI增敏。临床前研究确实表明,EGFR C797S+常见EGFR突变对前一代EGFR TKIs敏感,以及同时携带常见EGFR突变、T790M和C797S的三重突变也对前一代EGFR TKIs敏感。鉴于目前尚无批准用于这些患者的靶向治疗策略,因此有人提出在这种情况下使用第一代或第二代EGFR TKI,从而延迟铂类化疗的使用。
然而,耐药性的获得是一个高度异质性的过程,在靶向治疗的选择压力下进化出的耐药克隆和敏感克隆共存。液体活检,尤其是循环肿瘤DNA(ctDNA)分析可以更好地捕捉EGFR突变NSCLC的克隆演变,克服了组织再次活检的一些局限性,如时空异质性和侵袭性。近年来,血浆二代测序(NGS)已进入临床实践,与组织基因分型相比,显示出高灵敏度、特异性以及一致性。血浆NGS已经被纳入国际威廉亚洲博彩公司 ,作为可获得ctDNA分析的首选方法,因为它可以实时且高灵敏度地识别大多数已知的EGFR TKI获得性耐药机制。
在本病例系列中,研究者报告了3例携带EGFR突变的NSCLC患者,这些患者在奥希替尼治疗期间获得了EGFR C797S耐药突变,这些突变是通过血浆NGS检测的,患者接受了第一代或第二代EGFR TKIs治疗。
病例1
患者女,52岁,无吸烟史,2018年7月诊断为cT4 N3 M1c肺腺癌(AJCC第8版IVB期)。患者最初表现为左侧腰痛、呼吸困难和咳嗽,并被发现左侧胸腔积液。胸腔积液细胞学检查提示肺腺癌。当时PET/CT显像显示左肺上叶肿块、左肺结节、左胸腔积液,左肺门、纵隔、左乳链、肝门、腹膜后淋巴结肿大。头颅MRI显示右侧额顶叶8 mm脑转移。组织二代测序显示EGFR E746_A750del(第19号外显子缺失)突变。2018年7月液体活检显示EGFR第19号外显子缺失,循环游离DNA(cfDNA)占41.2%。患者于2018年8月开始接受奥希替尼治疗,并达到颅内完全缓解和颅外部分缓解。
奥希替尼治疗18个月后,再次CT影像学显示左肺门有新的亚厘米淋巴结。此时重复液体活检显示出现EGFR C797S突变(0.3% cfDNA)。行支气管镜检查/EBUS检查,11L组淋巴结转移阳性。患者接受了左肺门淋巴结放疗,于2020年6月完成。液体活检显示EGFR C797S(5.2% cfDNA)和EGFR第19号外显子缺失(4.7% cfDNA)突变持续存在。奥希替尼继续用药。
术后2个月PET/CT显示锁骨上、纵隔淋巴结肿大,骨内新发病灶。液体活检显示EGFR第19号外显子缺失(58.3% cfDNA)和EGFR C797S突变(55.6% cfDNA)的变异丰度增加。由于认为EGFR C797S突变可能是耐药的机制,因此停用奥希替尼,开始使用厄洛替尼。2个月后液体活检未检出EGFR C797S和EGFR第19号外显子缺失。术后3个月PET/CT显示胸内淋巴结完全消退,无新发病灶。
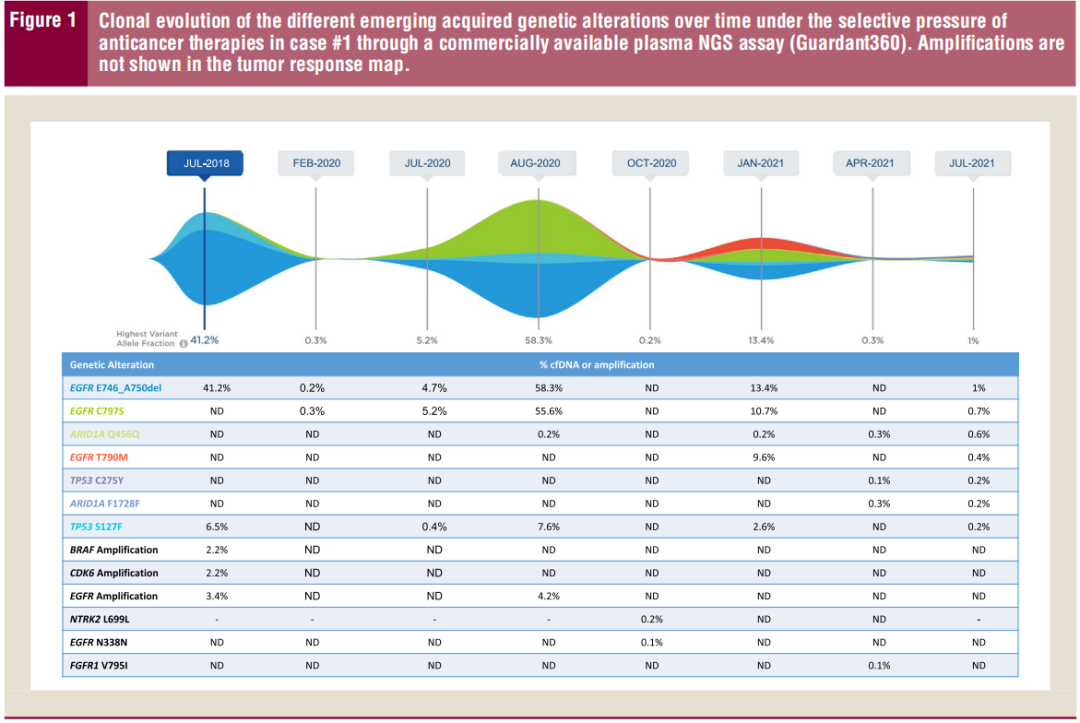
图1
6个月后,随访液体活检再次检出EGFR C797S(10.7% cfDNA)和EGFR第19号外显子缺失(13.4% cfDNA),以及新检出EGFR T790M(9.6% cfDNA)(图1)。随访CT胸部影像学显示新的亚厘米肺结节。停用厄洛替尼,开始接受卡铂/培美曲塞的细胞毒性化疗。厄洛替尼治疗的无进展生存期为5个月。在疾病进展时进行的液体活检中,研究者观察到EGFR C797S、EGFR T790M和EGFR第19号外显子缺失突变的清除。患者接受了4个周期的卡铂/培美曲塞化疗,随后接受培美曲塞维持治疗。几个月后胸部CT显示双肺结节增大,提示恶性肿瘤进展。之后不久再次液体活检显示EGFR C797S(0.7% cfDNA)、EGFR T790M(0.4% cfDNA)和EGFR第19号外显子缺失(1.0% cfDNA)突变再次出现。停用培美曲塞,患者参加了一项新型EGFR抑制剂的临床试验。
病例2
患者男,69岁,从不吸烟,2018年4月确诊为cT3 N2 M1c肺腺癌(AJCC第8版IVB期)。患者最初表现为发热和无意的体重减轻。CT胸/腹/盆腔影像学提示右肺下叶肿块、右侧胸腔积液、双肺结节、肝脏病变、弥漫性骨性病变。颅脑CT显示2个亚厘米的颅内转移灶。进行了胸腔穿刺,胸腔积液细胞学检查结果为肺腺癌阳性。对胸腔积液细胞进行EGFR突变检测,检出第19号外显子缺失突变。患者于2018年5月开始接受奥希替尼治疗,颅内和颅外均达到部分缓解。
奥希替尼治疗28个月后,再次进行CT扫描显示右侧胸腔积液复发,右肺下叶几乎完全塌陷。随访PET/CT显示右肺下叶嗜FDG结节及右侧胸腔积液,弥漫性骨性病灶增多,纵隔、右肺门、右腹股沟淋巴结肿大,证实恶性进展。液体活检显示患者已知的EGFR第19号外显子缺失突变(24.1% cfDNA)以及EGFR G724S(3.6% cfDNA)和EGFR C797S(0.05% cfDNA)突变。鉴于EGFR G724S和EGFR C797S是已知的奥希替尼获得性耐药突变,因此停止了这一治疗,并开始使用厄洛替尼(图2)。
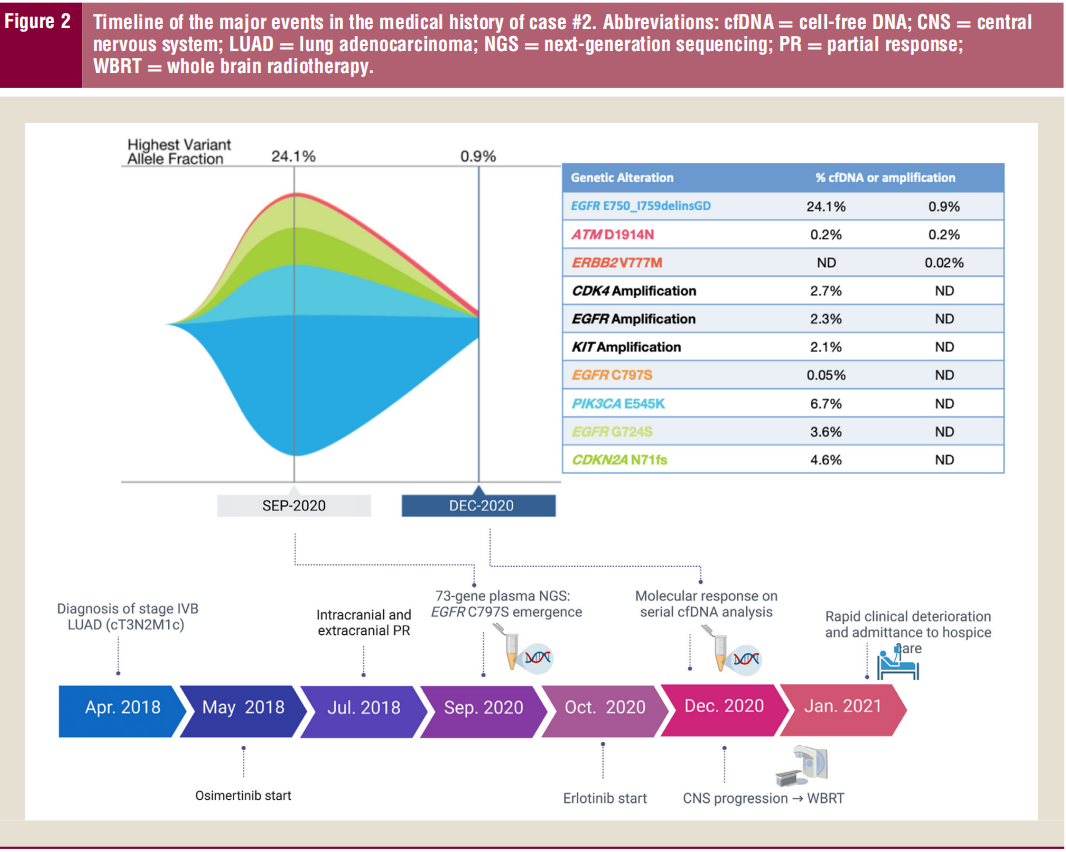
图2
厄洛替尼治疗后约5周的CT胸部成像显示,患者右侧大量胸腔积液间隔增大,左侧胸膜增厚/结节增多,右肺新发不通气。在CT扫描后不久的随访中,患者出现找词困难和步态不稳,约1个月后行头颅MRI显示双侧大脑半球及小脑多发强化病灶,累及软脑膜。从厄洛替尼开始治疗2个月后进行的重复液体活检显示,EGFR第19号外显子缺失突变的cfDNA百分比降低(0.9%),EGFR G724S和EGFR C797S突变被清除。患者接受了全脑放疗和类固醇减量治疗。不幸的是,患者的神经系统症状持续进展,功能状态下降。患者被认为不再适合接受全身化疗,并将其转为临终关怀。
病例3
患者女,46岁,无吸烟史,2018年9月诊断为cT3 N0 M1c肺腺鳞癌(AJCC第8版IVB期)。患者最初表现为干咳。胸部CT显示左肺下叶肿块伴阻塞性肺炎。行支气管镜/EBUS检查,肺部肿块病理显示鳞癌,胸内淋巴结未见恶性侵犯。PET/CT显示肝转移2处,L1椎体转移1处。头颅MRI未见颅内转移。肝脏主要病变的活检显示腺鳞癌,符合肺原发性转移。基线液体活检显示EGFR L858R突变(9.8% cfDNA)和EGFR R108K突变(5.4% cfDNA)。患者于2018年10月开始接受奥希替尼治疗,并观察到部分缓解。奥希替尼治疗3个月后的液体活检显示EGFR突变的cfDNA百分比降低(L858R 0.2%,R108K 0.1%)。
奥希替尼治疗7个月后的再次CT显示肝脏疾病进展的证据。重复肝脏病变活检证实持续性腺鳞癌。此时的重复液体活检显示EGFR L858R(18.9%)和EGFR R108K(12.8%)的cfDNA百分比升高,以及新出现EGFR扩增(++)和EGFR C797S突变(4.5% cfDNA)。奥希替尼停药,阿法替尼于2019年6月启动治疗。2个月后PET/CT显示影像学进展,肝转移灶加重,新发骨转移灶。重复液体活检显示,之前观察到的EGFR突变的cfDNA百分比增加(L858R 42.3%,R108K 29.9%,C797S 16.5%)。停用阿法替尼,患者开始接受卡铂/吉西他滨化疗。1个月后进行的液体活检再次显示EGFR突变的cfDNA百分比降低(L858R 2.7%,R108K 1.7%,C797S 0.8%)(图3)。
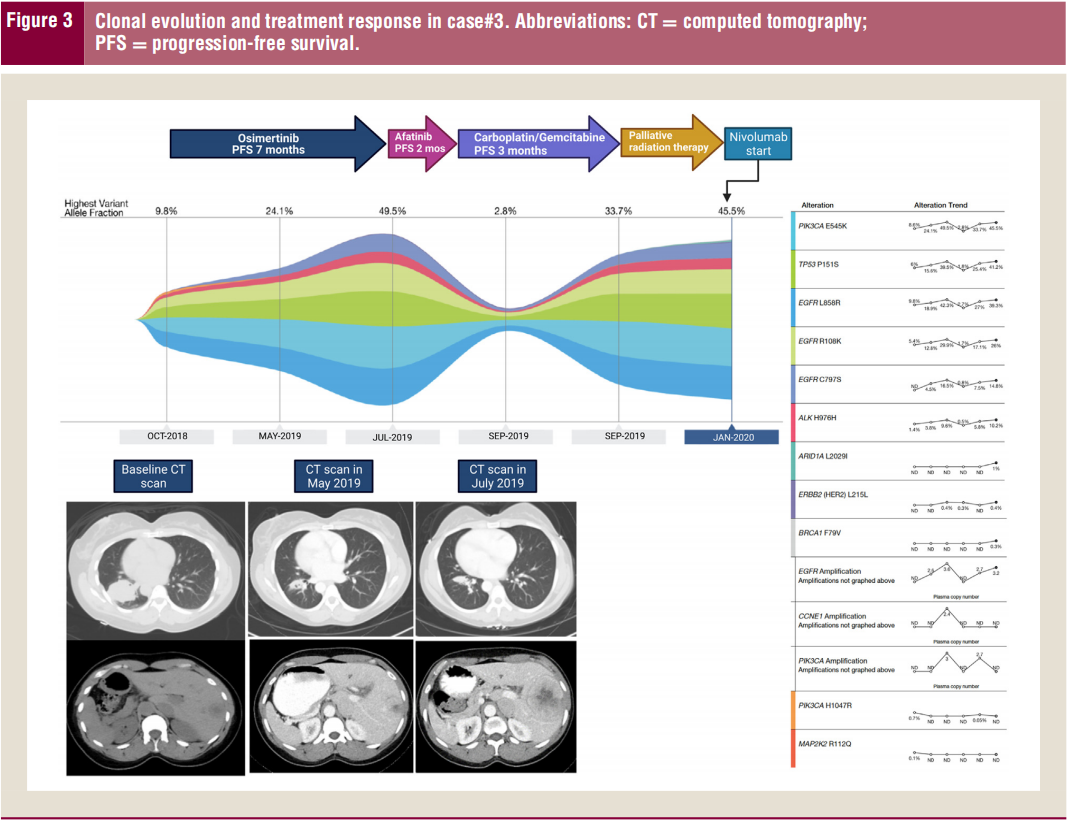
图3
卡铂/吉西他滨治疗4个周期后的CT显示左肺疾病进展,沿L3椎体和股骨近端骨转移灶增大,担心即将发生病毒学骨折。重复液体活检显示,已知EGFR突变的cfDNA百分比升高(L858R 27.0%,R108K 17.1%,C797S 7.5%)。患者接受了股骨髓内钉和姑息性放射治疗。此后患者开始接受纳武利尤单抗治疗。
讨 论
在过去几年中,奥希替尼在大多数国家成为携带常见EGFR突变NSCLC患者的新标准一线治疗。然而,获得性耐药后的最佳治疗方案仍未确定。迄今为止,在接受奥希替尼治疗的患者中,已经描述了多种耐药机制,获得性EGFR C797S突变是最常见的一种。
液体活检,即cfDNA分析,是晚期NSCLC患者治疗中的重要工具,可能提供关于抗癌治疗的选择压力下肿瘤基因型和克隆进化的有用信息。正如在这3个病例中清晰观察到的那样,液体活检可能使williamhill asia 能够对肿瘤的克隆演变进行微创实时监测,从而识别通过不同治疗线出现的不同基因组选择模式。此外,据报道,在未经TKI和接受过TKI治疗的患者中,在奥希替尼治疗期间cfDNA EGFR突变的早期清除均与结局改善相关。
血浆NGS与基于PCR的液体活检检测相比有一些优势,并且最近IASLC的共识声明中声称,血浆NGS是cfDNA肿瘤基因分型的首选方法。这是由于其高灵敏度,以及对不同基因组区域的同时检测,从而可以识别多种获得性耐药机制,且这些机制可以同时发生。最近FLAURA试验中对奥希替尼一线获得性耐药机制的分析表明,在血浆中检测到耐药机制的患者中,有约40%出现多种获得性耐药机制。奥希替尼获得性耐药可能由靶内和脱靶机制共同驱动,这些机制可能包括EGFR的二次突变(如C797S突变)、基因扩增(EGFR或其他基因,如MET)和重排(如NTRK1)。这使得williamhill asia 可以实施靶向治疗策略,例如在MET扩增的患者中联合使用EGFR TKI和MET抑制剂,或者在有继发性突变(如C797S)的患者中使用第一代或第二代EGFR TKI进行再激发策略。EGFR TKI再挑战的概念并不是新的,是基于这样的假设:耐药肿瘤是TKI敏感和TKI耐药细胞的异质性混合,在治疗的选择压力下动态演变,因此,在停止TKI治疗后,生长更快的TKI敏感细胞可能会重新聚集,从而使肿瘤在药物假期后对第二轮EGFR TKI“重新应答”。临床前数据表明,EGFR exon19del/C797S和EGFR L858R/C797S突变很少发生于新发肿瘤,但仍对第一代和第二代EGFR TKIs保持敏感性。在奥希替尼耐药时还可以发现其他继发性突变,其中一些对第一代和第二代EGFR TKIs仍保持敏感性,这进一步证明了在疾病进展时重新评估肿瘤基因型的临床效用。然而,正如在本病例系列中所观察到的,第二疗程EGFR TKI的临床活性具有高度异质性,这反映了肿瘤的克隆演变,以及同时存在的可能影响这些药物敏感性的其他基因组事件。为此目的,液体活检可能特别有吸引力,因为它可以更好地再现肿瘤异质性,克服单一组织样本再次活检的采样偏倚。此外,正如在病例1中观察到的,第一代EGFR TKI再激发可能导致众所周知的获得性耐药机制,如EGFR T790M突变,从而导致疾病进展和对所有临床批准的EGFR TKI耐药。
对于接受奥希替尼一线治疗后出现进展、携带EGFR外显子19del/C797S或EGFR L858R/C797S双突变的特定患者,第一代EGFR TKI可能是一种潜在的治疗选择,从而可以延迟铂类化疗,延长这些患者的无化疗间期。对于这一亚组患者,迫切期待新的有效治疗策略。最近,针对EGFR/MET的全人源双特异性抗体埃万妥单抗(amivantamab)联合第三代EGFR TKI拉泽替尼(lazertinib)在接受过化疗(CHRYSALIS-2)和未经化疗的奥希替尼耐药患者(包括携带C797S突变的患者)中均显示出有前景的活性,以及新型第四代EGFR TKIs(如BLU-945)正在积极的临床开发中,这些可能会进一步改变EGFR突变NSCLC的治疗格局。
参考文献:
Russo, Alessandro et al. “Tracking Clonal Evolution of EGFR-Mutated Non-Small Cell Lung Cancer Through Liquid Biopsy: Management of C797S Acquired Mutation.” Clinical lung cancer vol. 24,7 (2023): 660-665. doi:10.1016/j.cllc.2023.07.003

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















感谢分享!
53
不错,学习了。
55
#非小细胞肺癌# #NGS# #C797S#
65