Adv Sci:徐伟成/郑隆宾/李旭东合作揭示了STAT3-FOXO3信号转导在调节脑卒中模型中神经可塑性的作用机制
2024-07-27 iNature iNature 发表于上海
该研究评估了程序性死亡配体1和肝细胞生长因子工程化间充质干细胞衍生外泌体在增强中风后神经恢复方面的潜力。
中风的治疗策略有限,导致许多患者终身残疾。
2024年7月25日,中国医药大学徐伟成、郑隆宾及国立中兴大学李旭东共同通讯在Advanced Science 在线发表题为“Role of STAT3-FOXO3 Signaling in the Modulation of Neuroplasticity by PD-L1-HGF-Decorated Mesenchymal Stem Cell-Derived Exosomes in a Murine Stroke Model”的研究论文,该研究评估了程序性死亡配体1(PD-L1)和肝细胞生长因子(HGF)工程化间充质干细胞衍生外泌体(EXO-PD-L1-HGF)在增强中风后神经恢复方面的潜力。
XO-PD-L1-HGF可有效内吞到靶细胞中,显著降低H2O2诱导的神经毒性并增加体外抗凋亡蛋白。EXO-PD-L1-HGF通过抑制T细胞增殖和增加CD8+CD122+IL-10+调节性T细胞的数量来减轻炎症。静脉注射EXO-PD-L1-HGF可通过中风后CXCR4上调和神经胶质细胞中的积累,靶向缺血脑梗塞周围区域的基质细胞衍生因子1α(SDF-1α+)细胞。EXO-PD-L1-HGF通过STAT3-FOXO3信号级联促进内源性Nestin+神经祖细胞(NPC)诱导的神经发生,这在细胞存活和神经保护中起着关键作用,从而减轻梗塞面积并增强小鼠中风模型中的神经功能恢复。此外,免疫调节CD19+IL-10+和CD8+CD122+IL-10+细胞数量的增加,以及促炎细胞数量的减少,在缺血脑中创造了抗炎微环境。因此,采用EXO-PD-L1-HGF干预的创新方法,针对SDF-1α+表达,调节免疫系统,增强常驻nestin+NPC的激活,可能会显著改变大脑微环境并创造一个有利于诱导中风后神经可塑性再生的生态位。

中风是全球第二大死亡原因。缺血性中风是一种血管阻塞时发生的医疗紧急情况。值得注意的是,约75%的中风幸存者会留下中风后遗症,包括瘫痪、抑郁、言语障碍和视力障碍。尽管组织纤溶酶原激活剂溶栓治疗和血管内血栓切除术可用于治疗急性缺血性中风,且治疗窗口较短,但超过1000种新药临床试验未能开发出安全有效的中风治疗方法。因此,有必要制定有效的治疗策略来改善中风和其他残疾患者的大脑恢复。
间充质干细胞(MSCs)是再生医学和免疫疗法中用于细胞疗法的最常用细胞类型之一,可改善脑血管疾病的神经功能。由于MSC具有免疫调节特性,它可以抑制各种免疫效应细胞的激活并促进免疫调节功能。MSC是具有自我更新和多谱系分化能力的多能成体干细胞。由于旁分泌信号传导是MSC治疗效果的基础作用机制,因此MSC衍生的外泌体通常比基于细胞的疗法更容易制造且更安全(没有不必要的植入)。
外泌体是一类纳米颗粒,直径在30-200纳米范围内,用于包裹许多生物活性分子,例如脂质、蛋白质、信使RNA(mRNA)、长链非编码RNA(lncRNA)和微小RNA(miRNA)。这些生物分子是由母细胞(即产生外泌体的细胞)决定的不同有效载荷。外泌体充当信使,将这些生物分子运送到受体细胞,在那里它们被选择性吸收以影响各种细胞活动,包括基因表达、细胞通讯、免疫反应和组织修复。此外,由于外泌体具有天然来源、纳米级尺寸、低免疫原性和穿越各种生物屏障的能力,因此被认为是靶向治疗的有前途的药物载体。因此,MSC衍生的外泌体在促进各种中枢神经系统疾病模型中的神经可塑性和神经功能恢复方面发挥着重要作用。
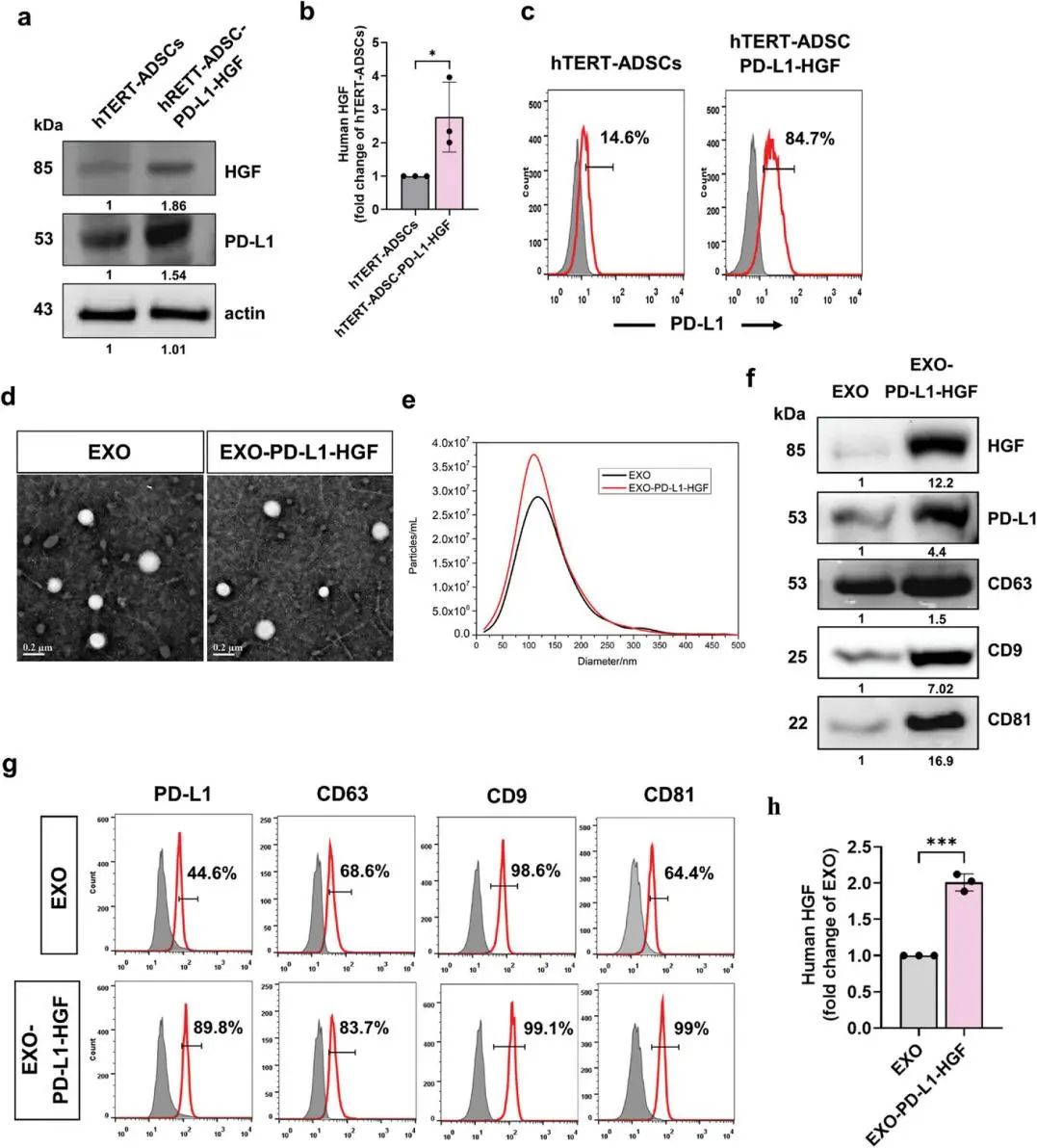
PD-L1-HGF修饰的hTERT-ADSC衍生外泌体的表征(图源自Advanced Science )
众所周知,程序性死亡-1(PD-1)表达于活化的T细胞和B细胞的细胞表面,与其配体程序性死亡配体1(PD-L1)相互作用,为调节细胞活化和增殖提供抑制信号。通过PD-1和PD-L1通路诱导信号传导会导致T细胞衰竭,进而抑制小鼠中风模型中中枢神经系统的炎症级联反应。此外,肝细胞生长因子(HGF)治疗可增强神经前体细胞(NPC)的增殖和分段神经血管重塑,从而在中风动物中诱导长期神经保护。鉴于上述证据,HGF和PD-L1的组合可以作为开发神经发生和炎症治疗干预措施的创新基因工程候选物。
脑室下区(SVZ)神经源性微环境内源性Nestin+蛋白+NPC的增强增殖大大促进了神经可塑性。在中风诱导过程中,SVZ内大量的nestin+NPC从其初始迁移路线转向梗塞周围区域,这表明它们可能在中风后恢复中发挥作用。FOXO3通过诱导自我更新基因程序来调节NPC的稳态,以保持细胞静止并防止过早分化。缺氧缺血诱导FOXO3上调与以下假设有关:使用特定治疗策略激活FOXO3表达可促进NPC增殖,从而促进中风后恢复。
由于MSCs具有PD-L1和HGF的遗传表达,因此对这些细胞进行基因工程改造以过度表达这两种分子可能是挽救中风损伤的神经胶质组织以提高治疗效果的良好策略。本研究探讨了EXO-PD-L1-HGF在促进缺血性中风后神经保护、抗炎和神经发生的治疗潜力。通过探索STAT3-FOXO3信号轴的分子机制,新型无细胞治疗产品EXO-PD-L1-HGF激活的内源性Nestin+NPC可能增强缺血性中风后的神经功能恢复。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404882
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















中风的治疗策略有限,导致许多患者终身残疾。
8
#中风# #神经可塑性# #STAT3-FOXO3#
11