BMC Complement Med Ther:网络药理学及实验验证研究通关藤注射液调节骨肉瘤细胞凋亡的潜在机制
2024-02-03 医路坦克 MedSci原创 发表于上海
本文鉴定通关藤注射液(TGT)的有效成分。结合网络研究TGT治疗骨肉瘤的临床前疗效及机制药理学和实验验证。
骨肉瘤是一种常见的原发性骨恶性肿瘤,多见于青少年和儿童。高遗传和病理异质性是该病的显著特征。据研究,局限性骨肉瘤患者的5年总生存率在65 - 75%之间,而复发转移性肿瘤患者的5年生存率仅为20%。骨肉瘤细胞通常表现为高度和局部侵袭性生长。通过联合手术、化疗(包括顺铂、阿霉素、甲氨蝶呤)和放疗可以抑制肿瘤的生长和扩散。然而,传统的治疗方法可能不能始终如一地产生骨肉瘤的预期结果,并且化疗耐药性的发展仍然是治疗无效的重要因素。新的治疗方法,如基于免疫的靶向治疗,可以通过靶向免疫检查点来克服肿瘤微环境的免疫抑制。然而,由于骨肉瘤患者的多样性,还需要进一步的临床研究。因此,寻找具有同等疗效和较少不良反应的骨肉瘤替代疗法和自然疗法备受关注。

中药和自然疗法含有多种物质,可以靶向多种分子途径,从而提高癌症治疗的疗效,最大限度地减少药物的负面反应。通关藤注射液(TGT)主要由从马氏藤茎中提取的可溶性化合物组成。作为一个中医配方,经常被用于治疗癌症的处方。已被批准用于食管癌、胃癌、肺癌、肝癌等恶性肿瘤的辅助治疗。患者对TGT的耐受性一般较好,常与顺铂、紫杉醇等化疗药物联合使用,可显著延长癌症患者的生存期。大量证据表明,TGT衍生的C21类固醇对多种癌细胞系,包括A549、Caco-2、HepG2、K562、PC-3和sacc - 83具有非凡的抑制作用。这一发现有可能显著提高与癌症作斗争的个体的福祉。然而,TGT对骨肉瘤的影响研究有限,其潜在机制尚不清楚。
霍普金斯教授是英国邓迪大学的药理学家,他介绍了网络药理学方法来解决中医复杂的本质。这种方法有助于建立一个连接组分、靶点、疾病和分子通路的综合网络。此外,分子对接可以通过模拟配体与受体之间的相互作用来预测配体与受体之间的结合亲和力。随着生物信息学技术的融合,网络药理学已成为预测中药作用于疾病的分子水平生物学机制、快速发现潜在活性药物和靶点的重要领域。因此,本研究首先通过网络药理学和体外实验探讨TGT对骨肉瘤的治疗潜力。这些发现为进一步探索TGT的治疗机制提供了有价值的支持。
方法:利用网络药理学方法鉴定TGT抗骨肉瘤的有效成分和靶点;williamhill asia 构建了一个由“活性成分-疾病-靶标途径”和蛋白质-蛋白质相互作用组成的网络PPI (tion)网络。利用靶器官网络来研究核心靶点在组织中的分布。随后,对核心目标进行了基因本体(GO)功能富集和京都基因百科基因组(KEGG)分析。比较了受体与配体之间的结合能对接。此外,采用SwissADME预测药物的药代动力学特性。最后进行实时聚合酶链反应(RT-PCR)、细胞增殖实验、形态学分析、细胞凋亡实验、采用线粒体膜电位(MMP)检测和Western blotting对电位进行确认TGT治疗骨肉瘤143B和SAOS2的机制。
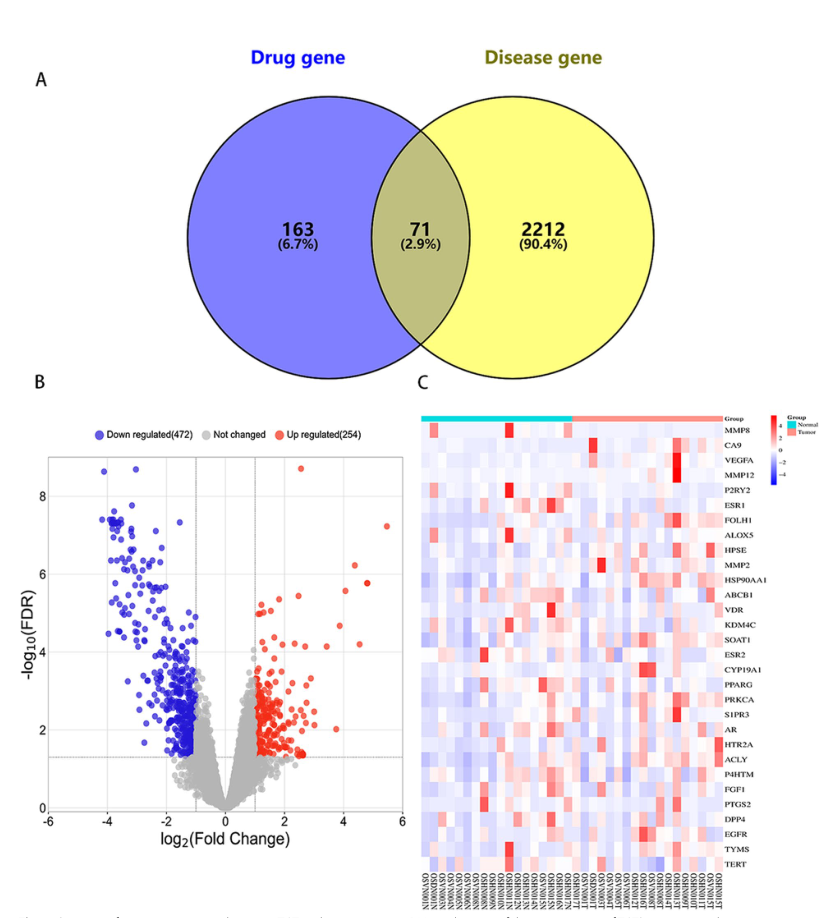
TGT与骨肉瘤共同靶点的筛选。TGT有效成分靶基因与骨肉瘤靶基因的维恩图。B GSE99671系列差异表达基因的火山图。下调基因用蓝色表示,上调基因用红色表示。C热图显示GSE99671系列中71个交叉靶点中前30个差异表达基因
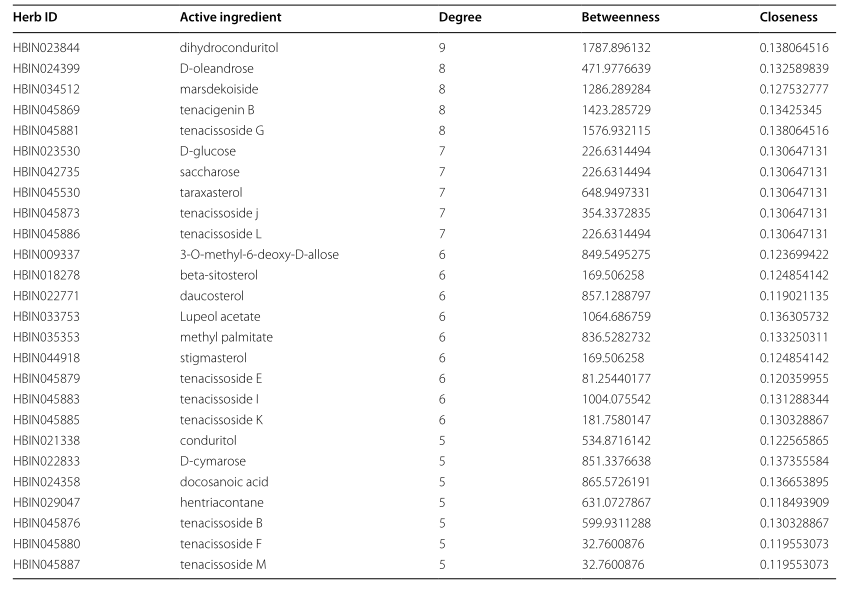
TGT治疗骨肉瘤的26种必需成分
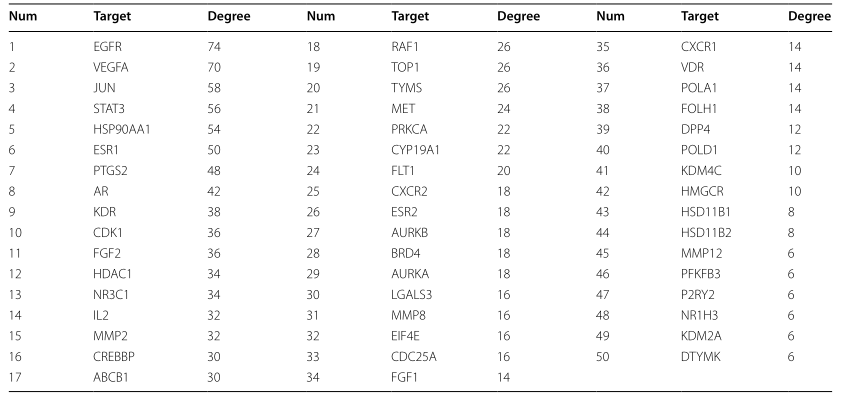
TGT治疗骨肉瘤的50个靶点
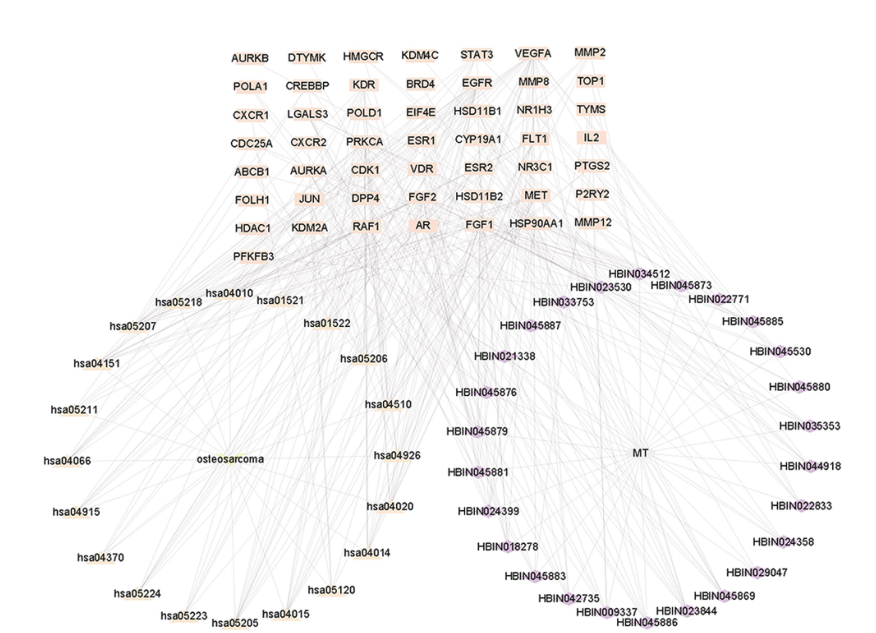
有效成分-疾病-靶点-通路”图说明TGT治疗骨肉瘤。矩形节点表示目标,三角形节点表示路径,菱形节点表示化合物
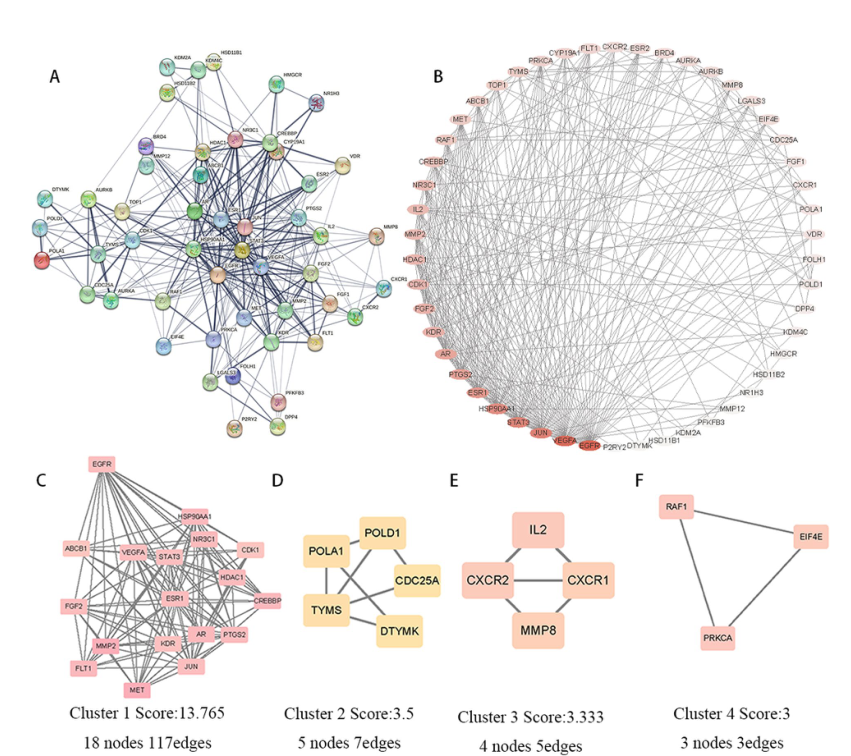
TGT治疗骨肉瘤的PPI网络。A使用String数据库构建PPI网络。B使用Cytoscape软件可视化PPI网络。颜色强度表示目标的度数值,颜色越深表示度数越高。使用MCODE插件对PPI网络进行聚类分析
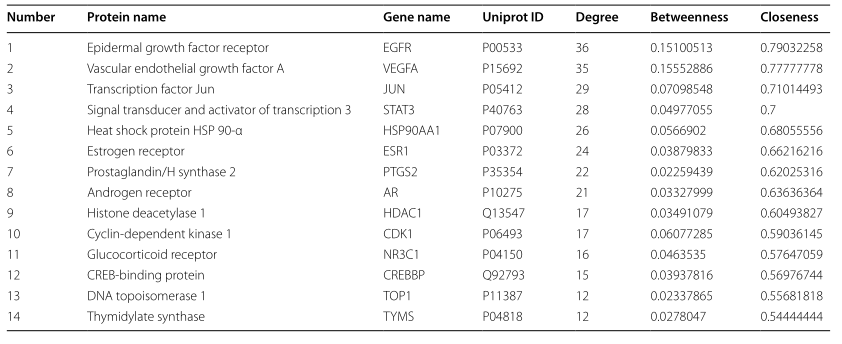
TGT治疗骨肉瘤的14个关键靶点信息

构建了TGT靶蛋白与16个靶器官的连接网络
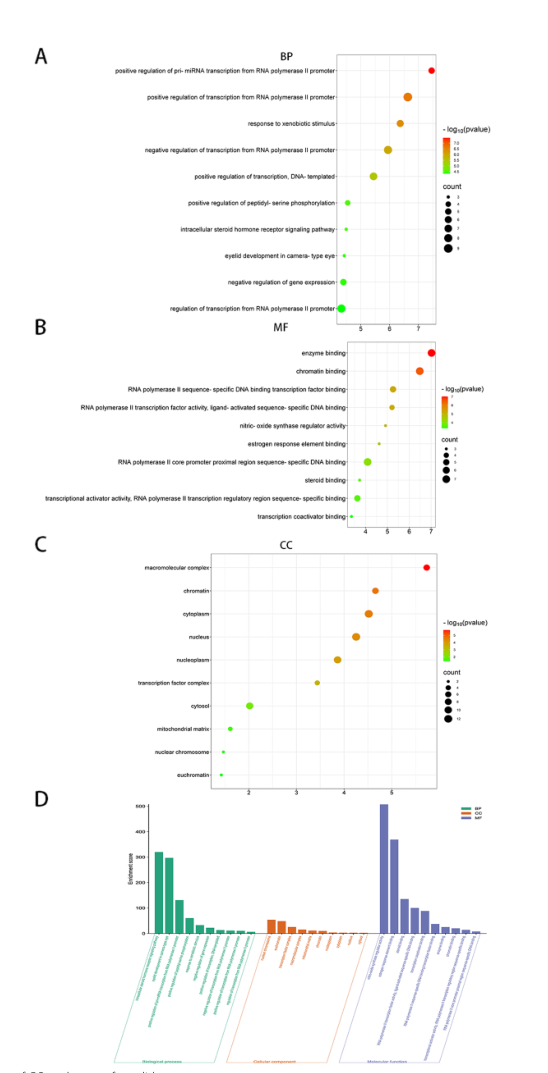
候选基因氧化石墨烯途径的气泡图
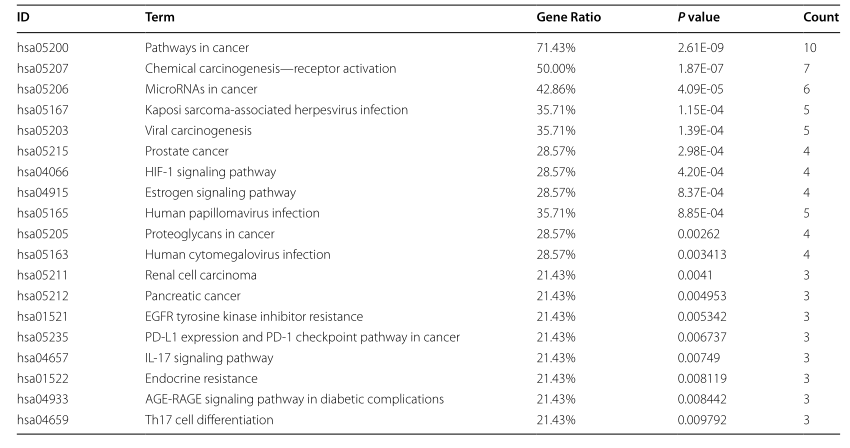
使用DAVID数据库获取的19条KEGG通路信息
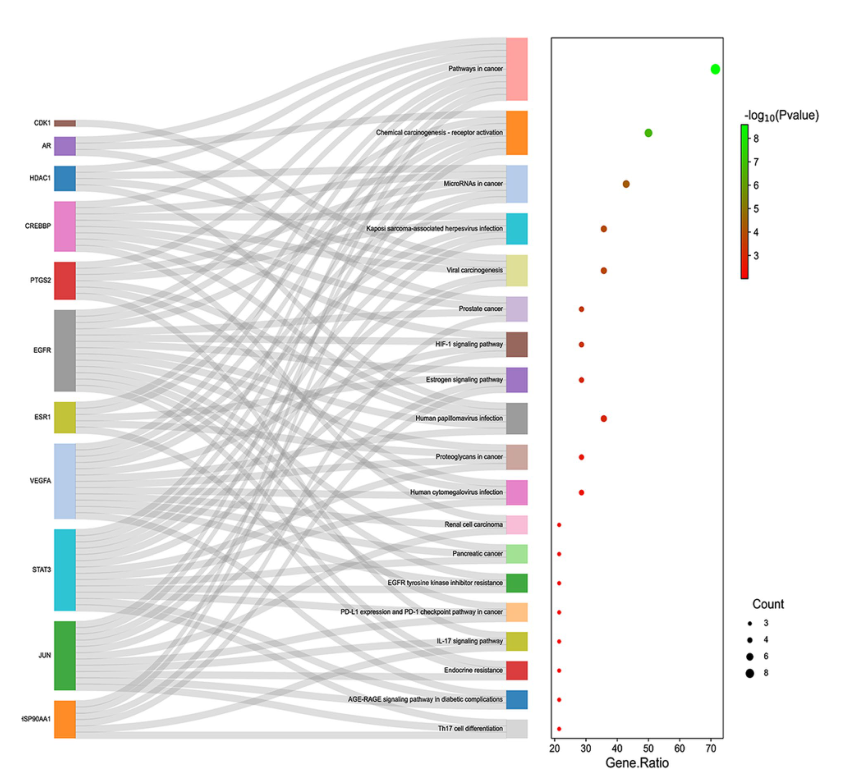
候选基因KEGG通路的Sankey图。左边的矩形代表目标基因,而右边的矩形代表途径
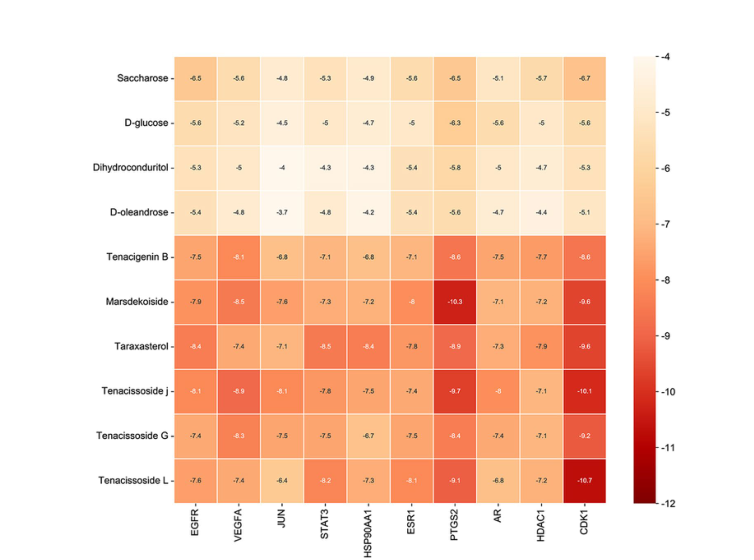
配体与受体之间结合能(kcal/mol)热图

前十位靶基因及其最稳定结合物的结合能信息
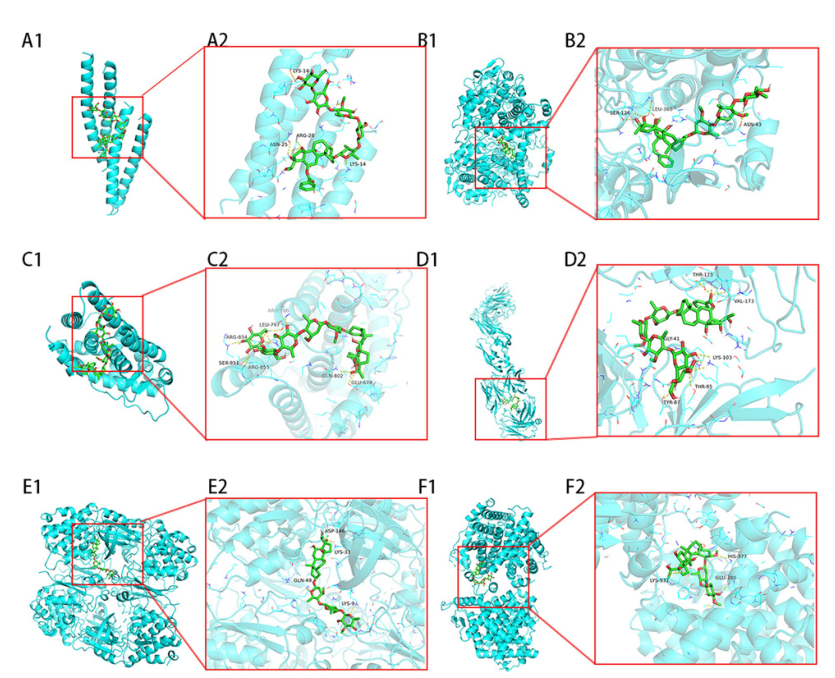
重要活性成分与靶蛋白的分子对接结果。蓝色部分表示目标蛋白质,而绿色部分表示化合物。黄色虚线表示配体和受体之间的相互作用。A JUN与Tenacissoside J, (B) PTGS2与marsdekoide, (C) AR与Tenacissoside J, (D) VEGFA与Tenacissoside J, (E) CDK1与Tenacissoside L, (F) ESR1与Tenacissoside L形成稳定复合物
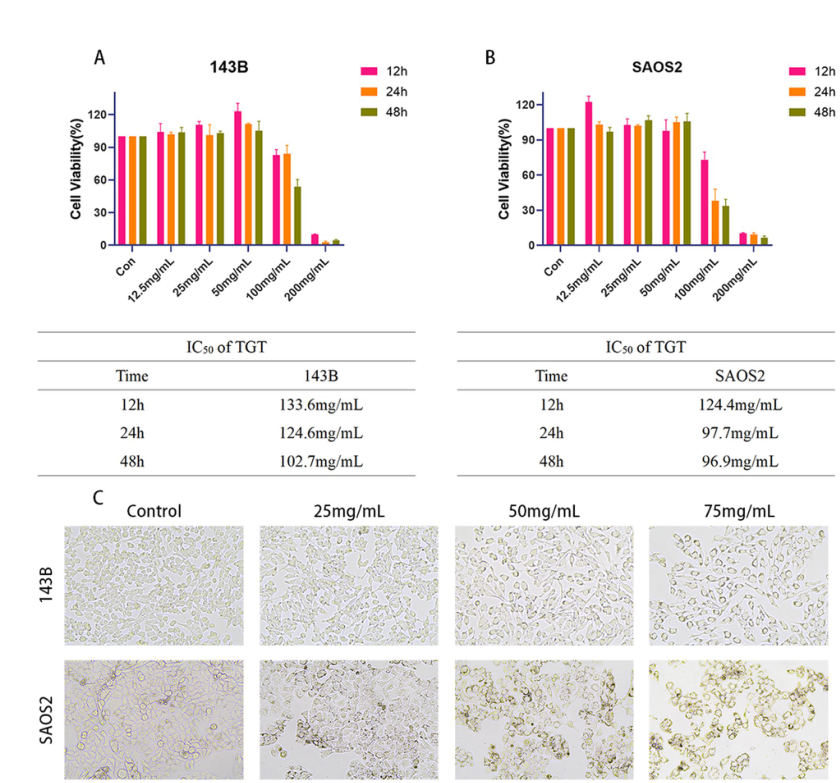
TGT对骨肉瘤细胞增殖的抑制作用A 143B细胞经不同浓度TGT处理12、24和48小时后的细胞活力测定。B SAOS2细胞经不同浓度TGT处理12、24和48小时后的细胞活力测定。C不同浓度TGT处理143B和SAOS2骨肉瘤细胞的形态学变化。数据以mean±SD (n = 5)表示。
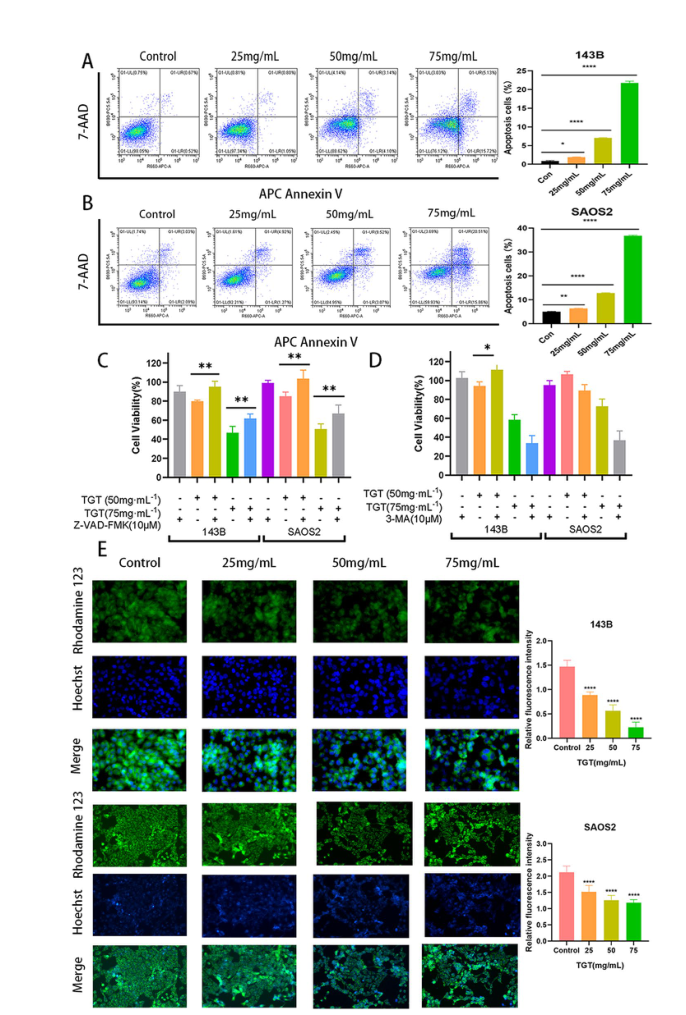
TGT诱导骨肉瘤细胞凋亡。(A-B)流式细胞术检测TGT诱导143B和SAOS2细胞凋亡。(C) TGT对骨肉瘤细胞的细胞毒作用可以通过与凋亡抑制剂Z-VAD-FMK共给药而逆转。(D) TGT与自噬抑制剂3-MA共给药仅在低浓度下逆转对骨肉瘤143B细胞的细胞毒性作用。(E)荧光显微镜下观察TGT处理后骨肉瘤细胞MMP的变化。数据以mean±SD表示(n = 5)。与对照组相比,*P < 0.1, **P < 0.01, ****P < 0.0001
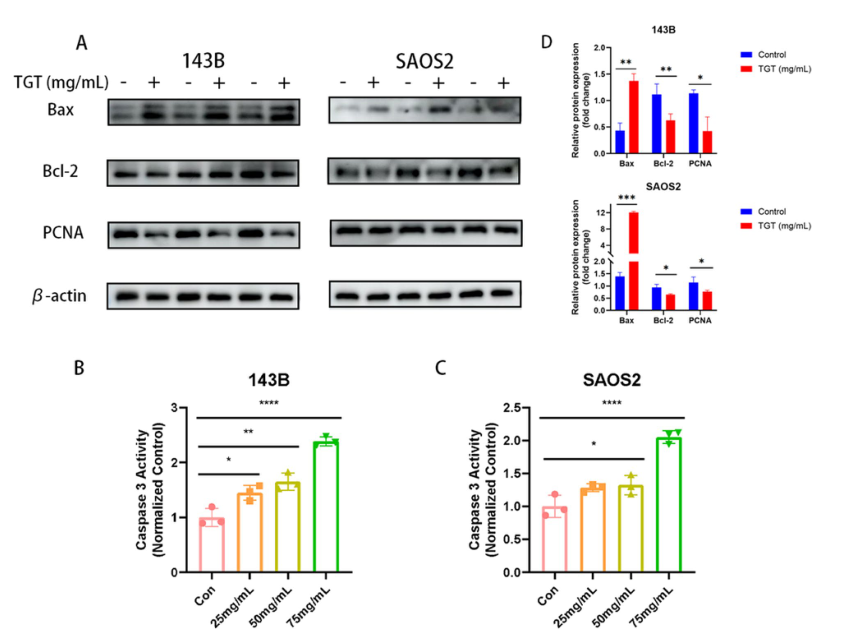
TGT对骨肉瘤细胞凋亡相关蛋白表达的调控。TGT显著促进促凋亡蛋白Bax的表达,抑制抗凋亡蛋白Bcl-2和增殖相关蛋白PCNA的表达。负号(-)为对照组,加号(+)为75mg /mL TGT处理组。TGT显著增强(B) 143B细胞和(C) SAOS2细胞的Caspase-3酶活性。数据以mean±SD (n = 3)表示。*P < 0.1, **P < 0.01, ****P < 0.0001

TGT调控骨肉瘤细胞143B和SAOS2中关键靶基因的表达。TGT浓度为75 mg/mL。A JUN, (B) TYMS, (C) HSP90AA1, (D) HDAC1, (E) CDK1, (F) ESR1, (G) TOP1, (H) EGFR, (I) STAT3, (J) NR3C1, (K) VEGFA, (L) AR, (M) CREBBP, (N) PTGS2。数据以mean±SD表示(n = 4)。与对照组相比,*P < 0.1, **P < 0.01, ***P < 0.001, ****P < 0.0001
结果:共获得54个TGT化学成分和71个与骨肉瘤相关的靶点。通过分子对接技术,天竺葵苷B、马氏菊苷、天竺葵甾醇、天竺葵苷G、天竺葵苷-在各种化合物中,鉴定出Tenacissoside J和side L是TGT的主要活性成分。靶器官分析提示TGT可能通过免疫调节发挥抗骨肉瘤作用。KEGG富集分析显示TGT可通过抑制HIF-1信号引发骨肉瘤细胞凋亡,肿瘤中PD-1的通路和表达调控以及PD-1检查点通路。SwissADME数据库预测Tenacigenin B和Taraxasterol具有最佳的药物相似性。体外研究也表明,TGT抑制骨肉瘤细胞的活性并诱导其形态学改变。它降低了MMP水平,通过增加Bax表达和Caspase-3活性,降低Bcl-2表达,从而引发细胞凋亡具有抗骨肉瘤作用的。同时,RT-PCR实验证实TGT通过影响JUN、HSP90AA1、HDAC1、CDK1等关键因子水平,控制肿瘤免疫应答,抑制癌细胞的增殖和扩散。
结论:本研究准确预测了TGT治疗骨肉瘤的有效成分、靶点和途径。体外实验证实了tgt诱导骨肉瘤细胞凋亡的分子机制。这些结果为TGT作为骨肉瘤的临床辅助药物提供了理论和技术支持。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#骨肉瘤# #网络药理学# #通关藤注射液#
56
不错,学习了。
28