别等!转移性去势抵抗性前列腺癌要尽早检测HRR基因,首个重磅研究出炉
2024-06-20 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在调查在使用雄激素受体信号抑制剂(ARSi)或紫杉类药物开始一线(1L)治疗的mCRPC患者中,与体细胞/胚系HRR变异(尤其是BRCA1/2)相关的发生率和结局。
虽然胚系BRCA突变与前列腺癌(PC)的不良预后相关,但对同源重组修复(HRR)基因的体细胞/胚系变异与转移性去势抵抗性前列腺癌(mCRPC)治疗结局之间的关联了解有限。本研究旨在调查在使用雄激素受体信号抑制剂(ARSi)或紫杉类药物开始一线(1L)治疗的mCRPC患者中,与体细胞/胚系HRR变异(尤其是BRCA1/2)相关的发生率和结局。
CAPTURE研究汇集了来自四项多中心观察性研究的729名mCRPC患者的数据。纳入标准包括1L ARSi或紫杉烷治疗,足够的肿瘤样本和生物标志物panel检测结果。患者通过二代测序进行了配对的正常和肿瘤DNA分析,使用定制的基因panel,包括ATM、BRCA1、BRCA2、BRIP1、CDK12、CHEK2、FANCA、HDAC2、PALB2、RAD51B和RAD54L。根据体细胞/胚系变异将患者分为:BRCA1/2突变(BRCA);BRCA1/2以外的HRR突变(HRR非BRCA);无HRR变异(非HRR)。无BRCA1/2突变的患者归为非BRCA。研究评估了影像学无进展生存期(rPFS)、无进展生存期2(PFS2)和总生存期(OS)。

729例患者中,BRCA亚组96例(13.2%),HRR非BRCA亚组127例(17.4%),非HRR亚组506例(69.4%)。BRCA患者的所有结局均显著差于非HRR或非BRCA患者(P<0.05),BRCA患者的PFS2和OS显著短于HRR非BRCA患者(P<0.05)。HRR非BRCA患者的rPFS、PFS2和OS均显著短于非HRR患者。探索性分析提示,对于BRCA患者,与1L治疗选择(ARSi或紫杉类药物)或体细胞/胚系变异相关的治疗结局没有显著差异。
与非BRCA亚组(无论是HRR非BRCA还是非HRR)相比,BRCA亚组中mCRPC患者的预后更差。尽管存在异质性,但HRR非BRCA亚组的预后较非HRR亚组差。早期筛查HRR基因突变,尤其是BRCA1/2基因突变,对改善mCRPC患者预后至关重要。
-
近1/3的mCRPC患者有≥1个HRR变异;约13%的患者存在BRCA1/2基因变异;
-
有BRCA1/2变异(无论是体细胞还是胚系)的患者的结局均比无BRCA1/2变异的患者差;
-
不同1L治疗方案(ARSi或紫杉类)对有BRCA1/2变异患者的治疗结局无显著差异;
-
识别体细胞/胚系HRR变异,即BRCA1/2,是靶向治疗和改善预后的关键。
研究背景
前列腺癌(PC)在分子和临床层面上都是一种异质性疾病,大多数分子事件的临床意义仍有待阐明。DNA损伤修复(DDR)机制,尤其是同源重组修复(HRR)通路,在晚期PC中经常发生变异。高达30%的转移性去势抵抗性PC(mCRPC)患者存在DDR基因变异,最常见的是与HRR相关的基因变异。对去势抵抗时来自前列腺肿瘤原发灶和转移灶的配对样本所做的分析提示,这些突变发生在晚期PC进化的早期。
在前列腺肿瘤中发现的DDR变异中,有很大一部分是胚系起源的。BRCA2胚系突变一直与不良临床结局相关。尽管有上述发现,但除了使用多聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)之外,关于BRCA1/2或其他HRR基因的体细胞和胚系变异在为PC患者选择最合适治疗方法方面的潜在效用,目前尚无结论数据。PARPi已被证明在某些与HRR直接或间接相关的DDR基因变异(尤其是BRCA1/2变异)的mCRPC患者中显示出显著的疗效和临床获益。然而,其他标准治疗[包括雄激素受体信号传导抑制剂(ARS)和紫杉类药物]的相对疗效,以及体细胞突变和胚系突变(尤其是BRCA1/2基因突变)对治疗结局的影响尚未完全了解。
这项观察性研究的目的是评估mCRPC患者的体细胞和胚系变异的发生率,以及发病特征和结局。本研究的重点是比较有和无BRCA1/2或其他HRR突变,并开始使用ARSi或紫杉类药物进行一线(1L)治疗的mCRPC患者的治疗模式和结局。
研究方法
每个基因变异被分类为体细胞或胚系变异,并被分类为导致双等位基因或单等位基因功能缺失(LOF)。双等位基因LOF:两个体细胞致病性或可能致病性(P/LP)变异;1个胚系P/LP变异和1个体细胞P/LP变异;1个P/LP变异和杂合性缺失(LOH);或者一个基因的完全或部分纯合缺失。单等位基因LOF:1个胚系P/LP变异;1个体细胞P/LP变异;或者一个基因的完全或部分杂合缺失。有≥1个基因变异的病例也被分层分类进行亚组分析:BRCA,如果有≥1个BRCA1/2基因发生突变;或HRR非BRCA,如果研究panel中有≥1个基因变异,但不是BRCA1/2。在非BRCA亚组中,BRCA1/2基因未发生变异;可能存在其他HRR基因突变,但这些突变并非纳入亚组的必要条件。
研究结果
基线人口统计学和疾病特征:
729例1L mCRPC患者中,96例为BRCA1/2突变(BRCA亚组),127例为BRCA1/2以外的其他HRR突变(HRR非BRCA亚组),506例为无HRR突变(非HRR亚组;图1 A)。非BRCA亚组包括来自HRR非BRCA和非HRR亚组的所有患者(n=633)。
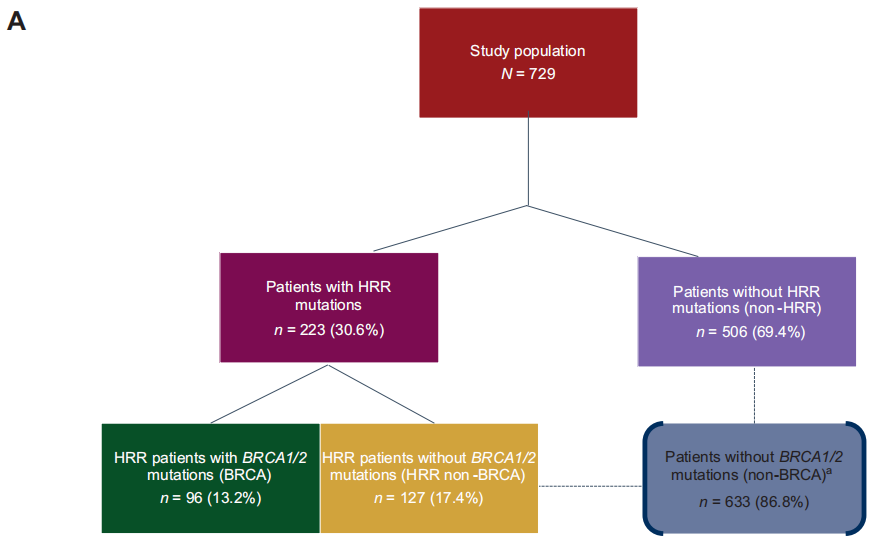
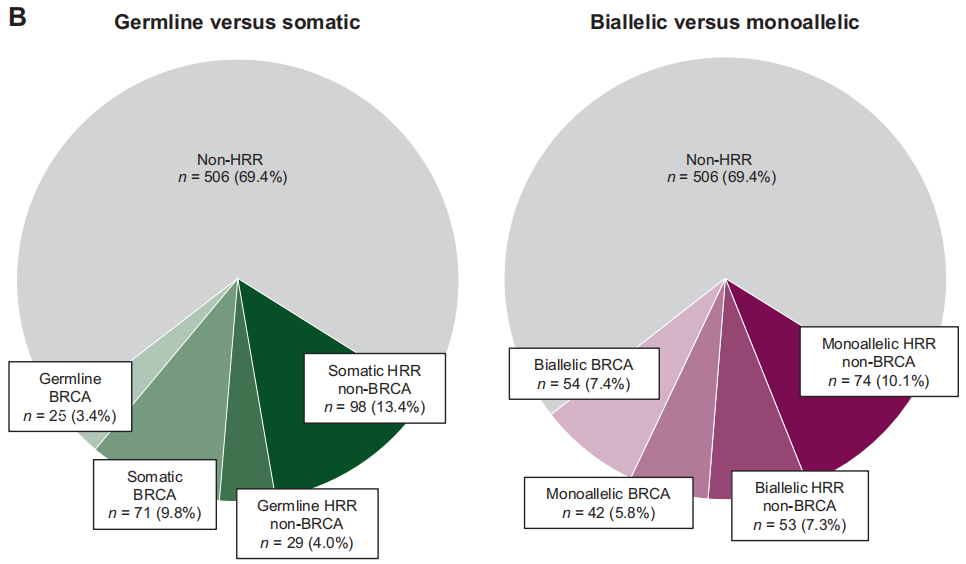

图1
近半数(47.2%)的患者在诊断时已出现转移性PC。大多数患者仅接受ADT治疗转移性激素敏感性前列腺癌(mHSPC),分别只有8.1%、1.0%和0.1%的患者接受ADT联合多西他赛、ADT联合ARSi或ADT联合多西他赛和ARSi。从ADT到发生去势抵抗的中位时间为25.0个月。开始1L治疗的中位年龄为72.2岁;13.3%的患者有内脏转移,53.1%的患者ECOG评分≥1分。分析中观察到的基线特征见表1。校正后,各亚组的基线特征相似(SMD<0.1)。
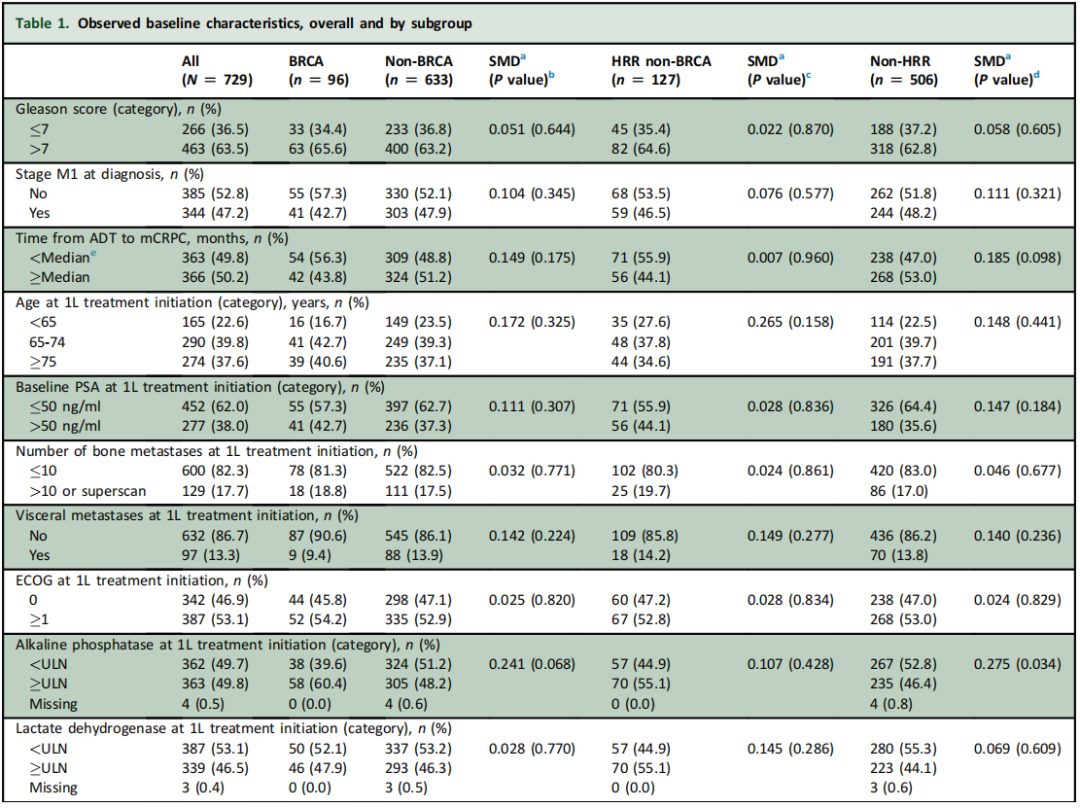
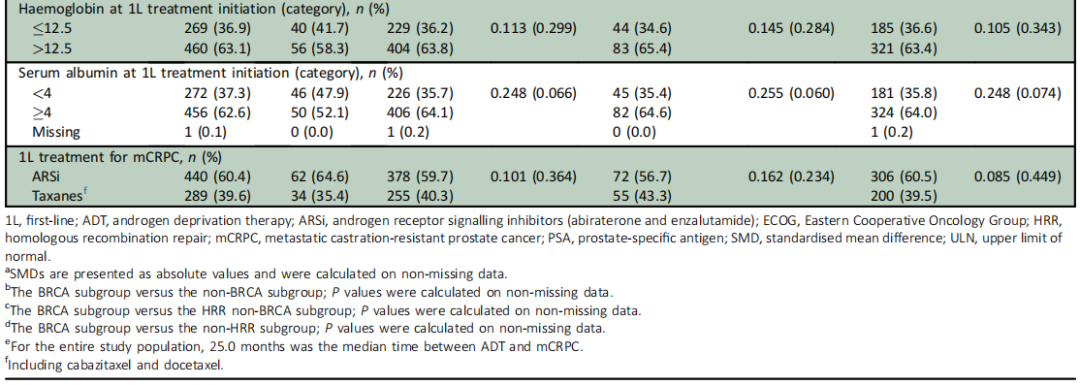
表1
在所有患者中,60.4%的患者接受了ARSi 1L治疗mCRPC[39.5%的患者给予醋酸阿比特龙加泼尼松(AAP),20.9%的患者给予恩杂鲁胺]。其余(39.6%)接受紫杉醇类药物1L治疗(多西他赛:37.6%;卡巴他赛:2.1%)。大多数患者(80.7%)接受了2L治疗,其中52.3%接受多西他赛治疗(占全队列的42.4%)。超过一半的患者(57.5%)继续接受3L治疗。
HRR变异的频率和类型:
在研究人群中,223例(30.6%)患者存在≥1个HRR变异。在该队列中,96/223(43.0%)有BRCA1/2变异(BRCA亚组;在总人口中,BRCA1:2.6%;BRCA2:10.7%;BRCA1/2:13.2%),而127/223(57.0%)有BRCA1/2以外的HRR变异(HRR非BRCA亚组;占总人口的17.4%;图1A)。除BRCA2,最常见的3种HRR基因变异是ATM(8.4%)、FANCA(5.2%)和HDAC2(2.9%)。5.5%的患者报告有>1个HRR基因突变,其中大多数病例(3.7%)涉及BRCA1/2。
在7.8%的患者中发现致病性或可能致病性胚系突变,包括BRCA2(n=19;2.6%),ATM(n=14;1.9%),CHEK2(n=7;1.0%),BRCA1(n=6;0.8%),BRIP1(n=4,0.5%),RAD54L(n=2;0.2%),FANCA(n=2;0.2%)和PALB2(n=2;0.2%)。在BRCA亚组[71/96(74.0%) vs 25/96(26.0%)]和HRR非BRCA亚组[98/127(77.2%) vs 29/127(22.8%)]中,体细胞突变比胚系突变更常见(图1B)。与其他基因变异患者相比,BRCA1/2基因变异患者同时发生体细胞或胚系变异的频率更高[27/96(28.1%) vs 13/127(10.2%)]。
在BRCA患者中,双等位基因变异比单等位基因变异更常见[54/96(56.25%) vs 42/96 (43.75%)],BRCA1(84%单等位基因)和BRCA2(65%双等位基因)之间有显著差异。在HRR非BRCA亚组中,大多数患者表现为单等位基因突变[74/127(58.3%) vs 53/127(41.7%);图1B]。
BRCA 和非 BRCA 亚组之间的基线特征和结局比较:
在BRCA和非BRCA亚组之间,基线特征仅观察到微小差异(表1)。校正后,这些亚组之间的基线特征无显著差异(所有SMD均< 0.1)。
在BRCA亚组中,64.6%的患者因mCRPC接受了ARSi 1L治疗,而在非BRCA亚组中,这一比例为59.7%(表1)。AAP是1L组中使用频率最高的ARSi。32.3%的BRCA患者和38.4%的非BRCA患者给予1L多西他赛治疗。与非BRCA患者相比,更多的BRCA患者接受了2L治疗(91.7% vs 79.0%),但两个亚组中接受3L治疗的患者比例相似(57.3% vs 57.5%)。在BRCA和非BRCA亚组中,最常用的2L治疗均为多西他赛(BRCA:53.1%;非BRCA:40.8%),最常用的3L治疗是卡巴他赛(BRCA:29.2%;非BRCA:23.5%;图2)。分别有4.2%和0.5%的BRCA亚组和非BRCA亚组接受了3L PARPi治疗。
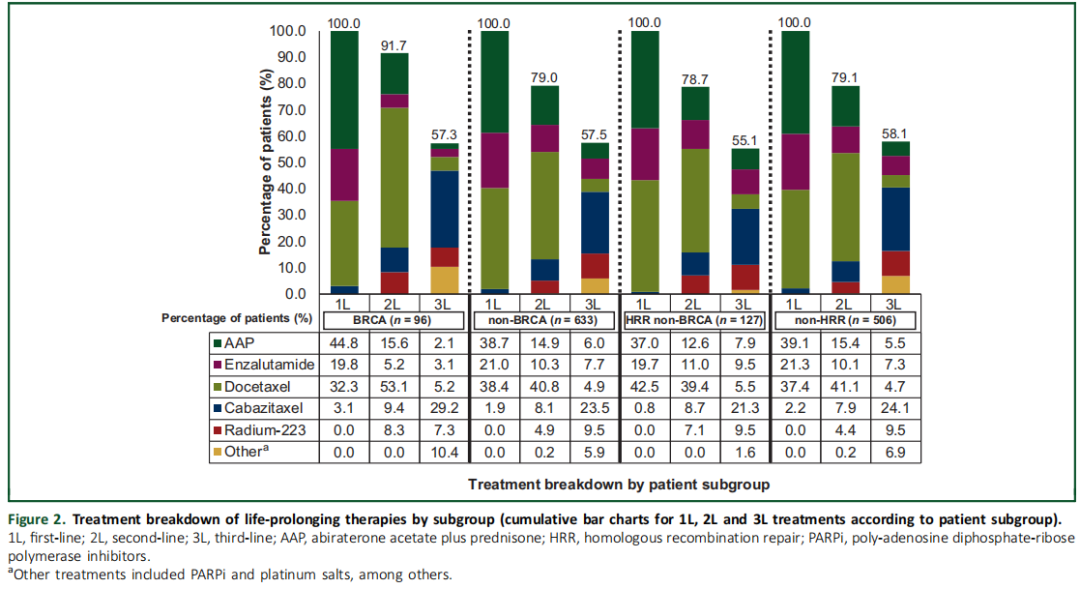
图2
经过人群加权后,BRCA亚组和非BRCA亚组的中位rPFS分别为7.1个月和10.3个月[HR 1.7(95%CI 1.3-2.2);P<0.001;图3 A]。BRCA亚组的中位TTTD(停止治疗时间)为6.4个月,而非BRCA亚组为6.9个月[HR 1.4(95%CI 1.2-1.8);P<0.001]。BRCA患者的中位PFS2和TTCP(临床进展时间)均比非BRCA患者短3个月以上[PFS2:12.6个月 vs 15.9个月;HR 1.8(95%CI 1.4-2.3);P<0.001;图 4 A;TTCP:9.7个月 vs 13.0个月;HR 1.5(95%CI 1.1-2.0);P=0.006]。BRCA亚组的中位OS为19.4个月,而非BRCA亚组为27.9个月 [HR 2.0(95%CI 1.6-2.5);P<0.001;图5 A]。

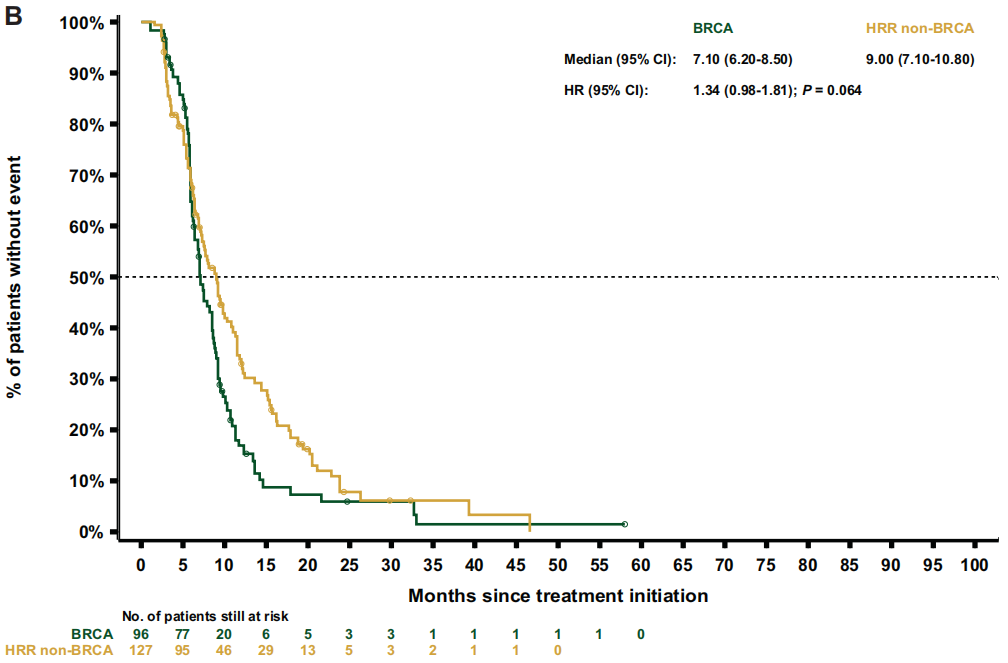
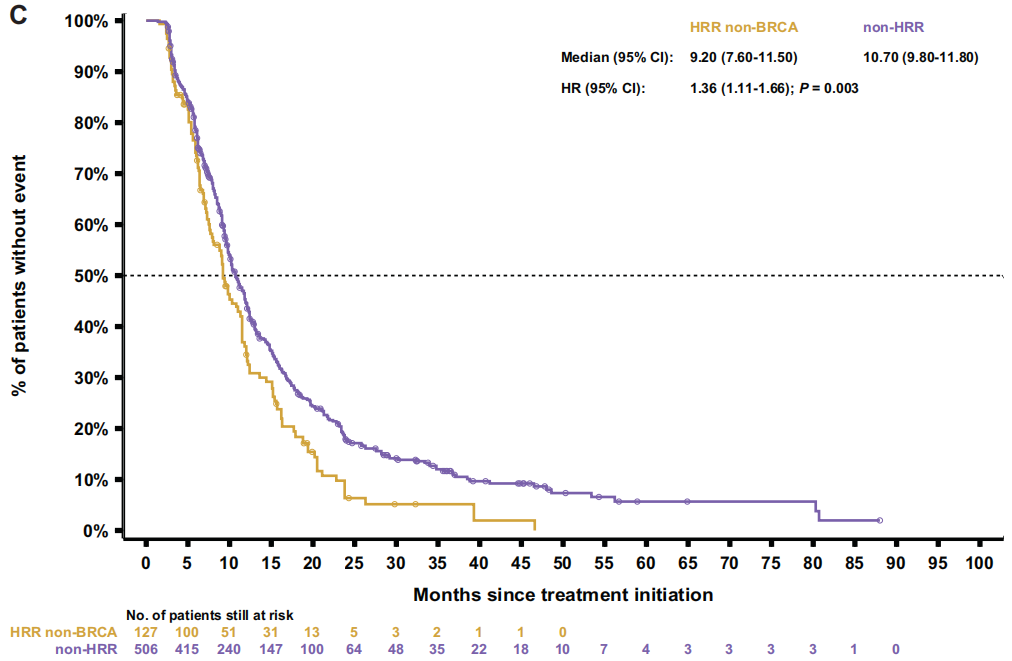

图3
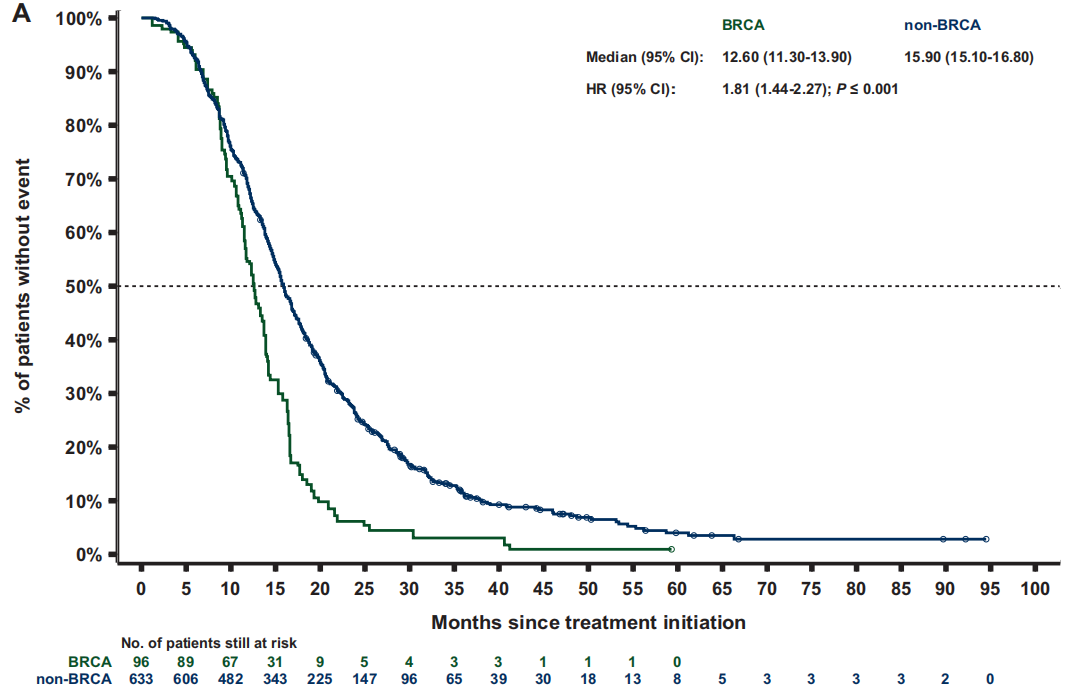
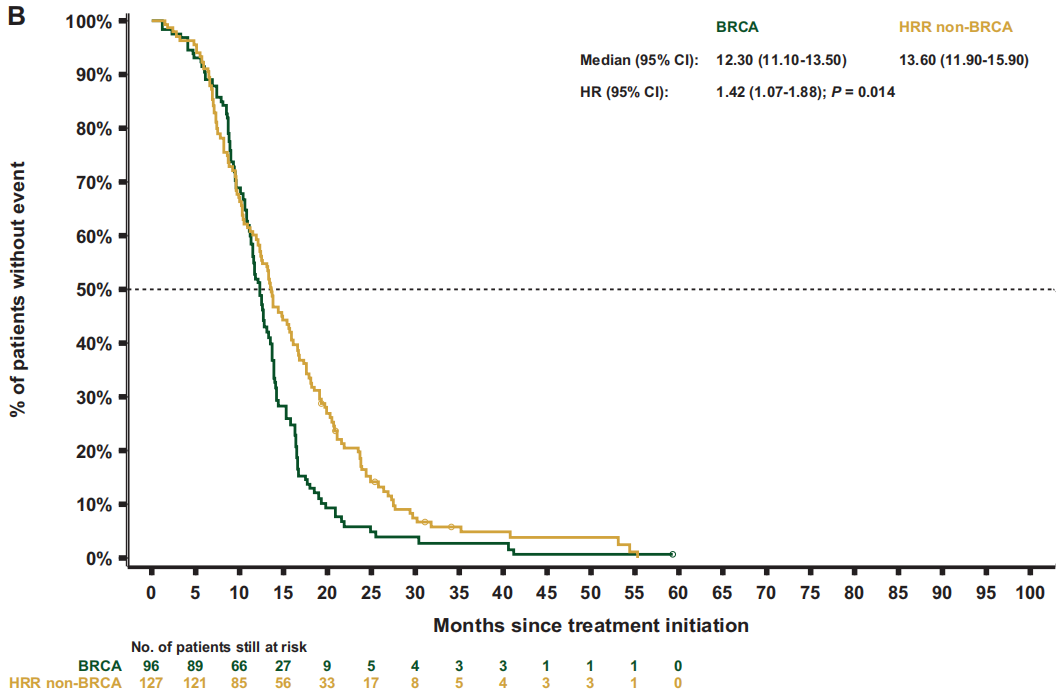
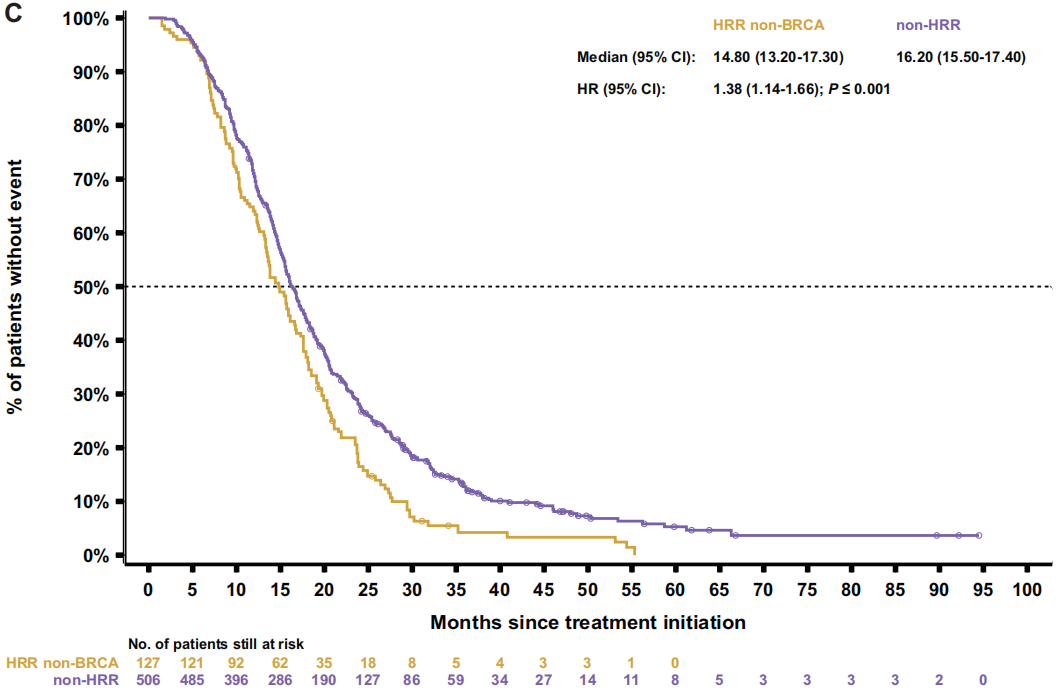

图4
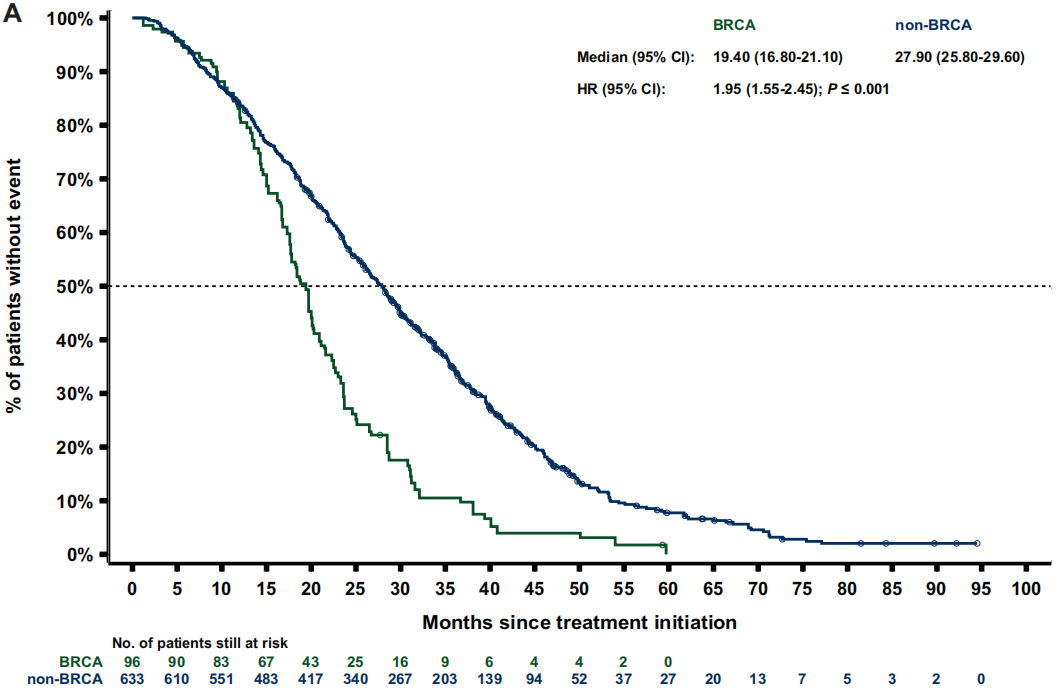
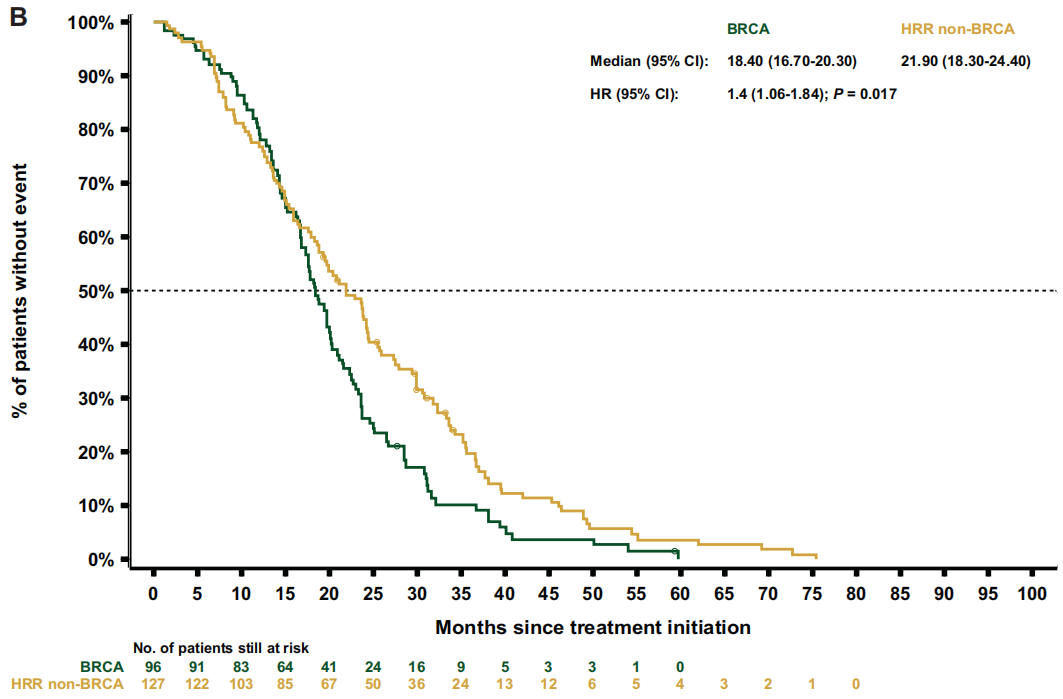
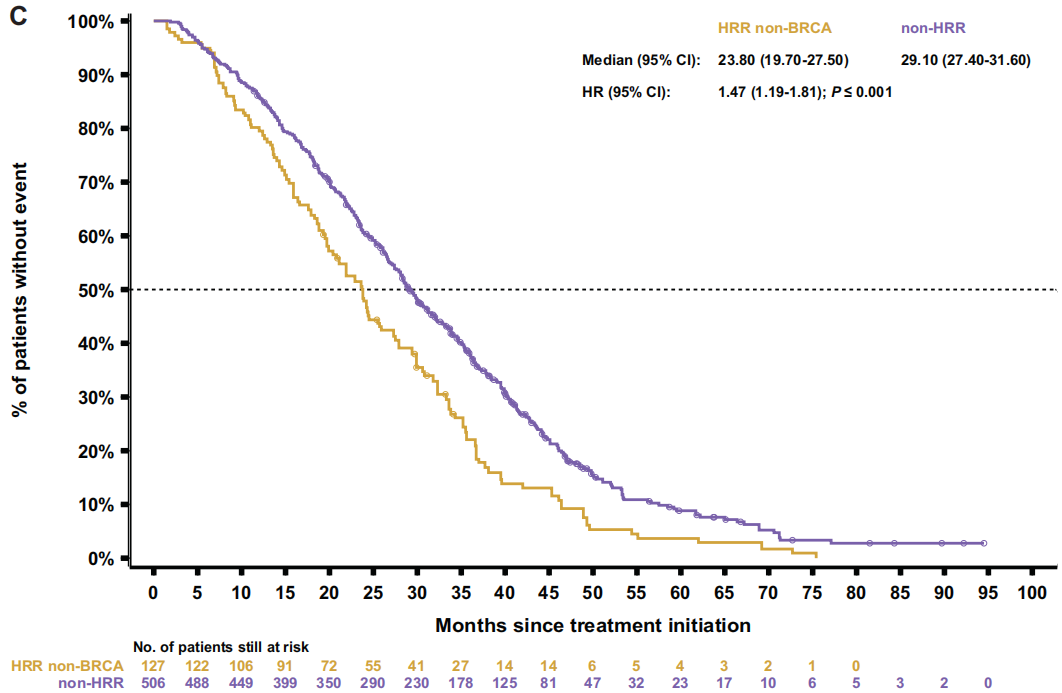

图5
对于BRCA患者,与1L治疗选择相关的任何结局均无显著差异。然而,BRCA患者的加权基线特征在治疗组之间并不完全平衡。
BRCA、HRR非BRCA和非HRR亚组之间的基线特征和结局比较:
在BRCA、HRR非BRCA和非HRR亚组之间,观察到的基线特征只有微小差异(表1)。校正后,这些亚组的基线特征之间无显著差异(SMD<0.1)。
关于治疗结局,重新加权后的数据显示,BRCA亚组的中位rPFS(7.1个月)短于HRR非BRCA亚组[9.0个月;HR 1.3(95%CI 1.0-1.8);P=0.064;图3B] 或非HRR亚组[10.8个月;HR 1.8(95%CI 1.4-2.4);P<0.001] 。BRCA和HRR非BRCA亚组的中位TTTD和TTCP相似[TTTD:6.4 vs 6.4 个月;HR 1.3(95%CI 1.0-1.7);P=0.076;TTCP:9.1个月 vs 10.0 个月;HR 1.1(95%CI 0.8-1.5);P=0.581],但与非HRR患者相比,BRCA患者的中位TTTD和TTCP显著缩短[TTTD:6.4个月 vs 7.0 个月;HR 1.5(95 CI 1.2-1.8);P<0.001;TTCP:9.8个月 vs 15.5个月;HR 1.6 (95%CI 1.2-2.2);P=0.002]。与HRR非BRCA亚组相比,BRCA亚组的中位PFS2[12.3 vs 13.6 个月;HR 1.4 (95%CI 1.1-1.9);P=0.014;图4B]和OS[18.4 vs 21.9个月;HR 1.4 (95%CI 1.1-1.8);P=0.017;图5B] 更短。同样,BRCA患者的中位PFS2和OS也显著短于非HRR患者[PFS2:12.7 vs 16.4个月;HR 1.9(95%CI 1.5-2.4);P<0.001;OS:19.4 vs 29.1个月;HR 2.1(95%CI 1.7-2.7);P<0.001]。
随后比较了两个非BRCA亚组(HRR非BRCA和非HRR)。HRR非BRCA患者始终表现出比非HRR患者更差的结果,包括rPFS[9.2 vs 10.7个月;HR 1.4(95%CI 1.1-1.7);P=0.003;图3C]、TTTD [6.6 vs 7.0个月;HR 1.3(95%CI 1.0-1.5);P=0.017]、TTCP [10.7 vs 14.9个月;HR 1.6(95%CI 1.3-2.0);P<0.001],PFS2[14.8 vs 16.2个月;HR1.4(95%CI 1.1-1.7);P<0.001;图4C]和OS[23.8 vs 29.1个月;HR 1.5(95%CI 1.2-1.8);P<0.001;图5C]。
研究者还在BRCA和HRR非BRCA亚组中进行了探索性分析。在BRCA亚组中,有BRCA2(vs BRCA1)变异的患者,中位rPFS、PFS2和OS较低,而在有体细胞(vs胚系)变异的患者和有双等位基因(vs单等位基因)变异的患者,中位rPFS较高,但中位PFS2和OS较低。然而,这些比较均未达到统计学显著性。在HRR非BRCA亚组中,有胚系变异的患者有结局较好的趋势,尤其是OS[24.3个月vs 20.8个月;HR 0.6(95%CI 0.4-1.0);P=0.028]。
讨 论
研究者发现BRCA患者(有体细胞/胚系变异)的治疗结局显著差于非BRCA和HRR非BRCA患者。据研究者所知,这项观察性队列研究是第一个全面评估体细胞和胚系HRR变异对1L mCRPC患者结局影响的研究。
已有多项研究描述了晚期PC中存在HRR变异,但由于人群遗传背景、使用的基因panels和报告的变异类型的差异,HRR变异的发生率和分布存在差异。此外,研究PARPi(伴或不伴AAP)在mCRPC中的益处的临床试验纳入了直接或间接参与HRR的不同基因,因此对HRR作为生物标志物的定义存在异质性,甚至有争议。例如,PROFOUND和PREVALENCE研究分别分析了15个和11个基因,结果发现存在差异。在PROFOUND和PREVALENCE研究分析的2792例和14073例样本中,分别有28%和14.0%的样本有≥1个HRR变异。与CAPTURE研究相似,在这两项研究中,BRCA2是最常见的变异基因,但发生率有相关差异(8.7%和4.4%),其他基因如ATM(5.9%和2.9%)、CDK12(6.3%和1.7%)、CHEK2(1.2%和2.2%)和BRCA1(1.0%和0.5%)也有显著差异。重要的是,PREVALENCE研究表明,体细胞和胚系HRR变异的频率可能在不同地理区域存在差异。总体而言,本研究结果更接近于PROFOUND中报告的结果,因为本研究发现30.6%的患者有HRR变异;但个体基因的频率不同。与这两项研究和其他研究相比,CAPTURE的独特之处在于分析了所有患者的体细胞和胚系样本,并纳入了克隆性单等位基因缺失(一种通常被漏报的变异)。致病性或可能致病性胚系突变的发生率与之前研究中的情况相似。
大多数关于前列腺肿瘤HRR变异的报告未能区分体细胞/胚系起源,关于其预后意义的数据也不确定。HRR变异的作用大多是在临床试验中结合特定治疗干预措施进行评估的,其预后价值尚不明确。作为例外,CDK12失活(主要由于体细胞突变)和胚系BRCA2突变一直与侵袭性表型相关。PROREPAIR-B是唯一一项前瞻性研究胚系突变对mCRPC结局影响的研究。在PROREPAIR-B中,BRCA2患者的中位特异性PC生存期仅为非BRCA2患者的一半(17.4个月 vs 33.2个月,P=0.027)。其他DDR基因突变患者的生存期也较短(28.6个月 vs 33.1个月),但差异无统计学意义。
与CAPTURE研究结果一致,评估ARSi联合PARPi作为1L mCRPC治疗获益的3项III期试验最近提示,肿瘤中有HRR变异(尤其是BRCA1/2)的患者在接受ARSi治疗作为标准治疗时,可能比非HRR患者进展得更快。与本研究进一步一致的是,这些试验报告称,在接受ARSi治疗时,HRR患者(包括BRCA患者)的结局比非HRR患者差。在PROPEL试验中,对于BRCA、HRR和非HRR患者,对照组(AAP+安慰剂)的中位rPFS分别为8.4个月、13.9个月和19.0个月。TALAPRO-2对照组患者接受了恩杂鲁胺+安慰剂治疗,HRR和非HRR患者报告的中位rPFS分别为16.4个月和22.5个月。在MAGNITUDE研究中,对照组中接受AAP治疗的 BRCA和HRR患者的中位rPFS分别为10.9个月和13.7个月。对于非HRR患者,该疗法被宣告无效,但与COU-AA-302研究的实验组进行的naïve间接比较显示(在HRR突变状态不明且未接受过化疗的mCRPC患者中),中位rPFS为16.5个月,这进一步支持了上述观察结果和此处提出的结果。这些发现凸显了BRCA患者的不良预后以及确定最合适的1L治疗的重要性。
在本分析中,ARSi是最常用的一线治疗。无论选择何种1L治疗方案(ARSi vs 紫杉类药物)),BRCA变异均与不良结局相关,但由于两种治疗方案之间的基线特征不平衡,因此对这些比较的解读受到限制。对PROREPAIR-B进行的一项探索性分析(纳入了14例胚系BRCA2突变携带者)提示,接受多西他赛作为1L mCRPC治疗的携带者的结局比接受ARSi治疗的携带者差,但关于在未经治疗的mCRPC患者中,在ARSi和紫杉醇之间选择时考虑BRCA1/2突变状态的价值,目前尚无定论数据。重要的是,在未暴露于ARSi的BRCA患者中,上述三项III期试验(PROPEL、TALAPRO-2和MAGNITUDE)已经证明,对于1L mCRPC,在ARSi的基础上加用PARPi可改善结局。例如,在MAGNITUDE研究中,接受尼拉帕利+AAP治疗的BRCA患者的中位rPFS(19.5个月)超过接受安慰剂+AAP治疗的患者(10.9个月)。对于后续治疗方法(当这些患者已经对一种ARSi进展时),在PROFOUND和TRITON-3试验中,与接受第二种ARSi相比,奥拉帕利或卢卡帕利单药治疗延长了生存期。值得注意的是,TRITON-3也证明了在既往ARSi治疗的BRCA患者中,与多西他赛相比,卢卡帕利具有优效性。即使进展至多线治疗后,PARPi对BRCA患者仍有明显益处。虽然尚未阐明早期使用PARPi和延迟使用PARPi的潜在获益,但这些药物是唯一证明对BRCA携带者结局有积极影响的药物。回顾性分析提示,这些肿瘤也可能对铂类药物敏感。因此,提前紧急识别这些患者并为其提供PARPi治疗似乎是明智的。
本探索性分析表明,BRCA2和BRCA1可能具有不同的预后意义,但上述注意事项(样本量有限和基线特征不平衡的探索性分析)仍然适用。其他研究提示,PARPi在这两组患者中具有不同的活性。HRR非BRCA变异是一个异质性群体,其中一些基因的LOF可能影响临床结局并使细胞对PARPi敏感,而其他基因的LOF可能不会。需要更多的研究来完全阐明个体HRR基因的临床意义。
CAPTURE利用了来自PROCURE网络的数据,该网络是一个结构良好的数据源,为其他出版物做出了贡献,并且可能是欧洲最大的晚期PC的真实世界证据队列之一。通过从观察性和低干预研究中提取数据,从而反映医疗机构治疗模式的多样性,本研究减轻了临床试验中的历史问题——获取和选择偏倚。此外,纳入试验要求患者符合1L mCRPC的条件,但在这种情况下,近60%的患者接受了≥3种后续治疗,而其他研究中只有一半的mCRPC患者接受了2L治疗。截至2020年招募结束,PARPi的使用主要限于临床试验,并且有BRCA或其他HRR变异的患者中只有<5%接受了PARPi治疗。这使得分析这些突变对mCRPC常规治疗反应的影响成为可能。
本研究有一些局限性。首先,由于纳入期的原因,只有一小部分(10%)mHSPC患者接受了强化治疗,大多数情况下包括ADT+多西他赛。这不再反映mHSPC的标准治疗,本研究无法评估更新后的治疗建议对HRR变异患者结局的潜在影响,这一点应在未来的研究中进行分析。同样,本试验纳入的患者在随访期间均未接受镥-177治疗。
其次,本研究panel中的一些基因(即HDAC2、FANCA、ATM和CDK12)和包括的变异类型(即单个有害突变或杂合缺失)是有争议的,因为它们可能与同源修复缺陷(HRD)无关。这些基因被纳入PARPi临床试验的基因panels。这些研究在分析的所有基因中都包含了单个有害突变,其依据是经过更深入的分析后,在最初检测到单个变异的病例中,多达80%可以发现BRCA2的二次打击。本研究还纳入了克隆杂合缺失,以反映III期研究(如MAGNITUDE或AMPLITUDE(NCT04497844))中纳入的人群。由于本研究和包括单基因突变或杂合缺失患者的临床试验都没有在这些病例中证明HRD或单倍体不足的证据,本研究集中在预后价值,而不是这些变异对PARPi的敏感性。然而,研究者进行了额外的敏感性分析,在排除有争议的事件(例如FANCA和/或HDAC2(n=11)的杂合缺失)后,结果未显示显著差异。
最后,尽管样本量大,但一些变异的数量少,限制了研究者充分探索某些基因和治疗效果的能力。BRCA1与BRCA2、体细胞与胚系突变以及双等位基因与单等位基因突变的比较分析应谨慎解读;这些分析是探索性的,因为患者数量少,并且亚组之间的基线预后变量可能不平衡。在BRCA和非BRCA患者中研究不同治疗(紫杉类药物vs ARSi)的影响时,也遇到了类似的样本量问题。由于对BRCA和非BRCA患者使用了单独的IPTW模型,因此不能直接从这些分析中得出BRCA和非BRCA亚组间疗效的比较。
本研究结果表明,BRCA1/2变异对mCRPC患者的预后有负面影响,无论其来源于体细胞还是胚系。早期识别BRCA患者并采用有效的治疗方法对改善其预后至关重要。需要进一步的研究来调整这些患者的最佳管理策略。
参考文献:
Olmos D, Lorente D, Alameda D, et al. Treatment patterns and outcomes in metastatic castration-resistant prostate cancer patients with and without somatic or germline alterations in homologous recombination repair genes. Ann Oncol. 2024;35(5):458-472. doi:10.1016/j.annonc.2024.01.011
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#前列腺癌# #紫杉类药物# #雄激素受体信号抑制剂#
25