Stem Cells:首次证实放疗能将乳腺癌细胞转变为癌干细胞
2012-02-15 towersimper 生物谷
癌干细胞靶向治疗(上面)和常规癌症治疗(下面)之间的区别示意图。图片来自维基共享资源。 乳腺癌干细胞被认为是肿瘤复发的唯一来源,同时已知它还能够抵抗放射疗法而且对化学疗法也没有良好反应。 如今,来自美国加州大学旧金山分校强森综合癌症中心放射肿瘤科的研究人员第一次报道放射疗法尽管在每次治疗期间杀死一半的肿瘤细胞,但是它也能够将其他癌细胞转变为抵抗治疗的乳腺癌干细胞。 这些乳腺癌干细胞的产生
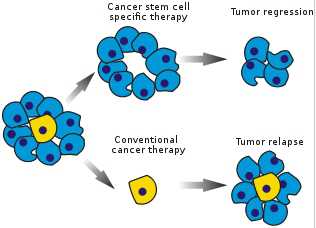
癌干细胞靶向治疗(上面)和常规癌症治疗(下面)之间的区别示意图。图片来自维基共享资源。
乳腺癌干细胞被认为是肿瘤复发的唯一来源,同时已知它还能够抵抗放射疗法而且对化学疗法也没有良好反应。
如今,来自美国加州大学旧金山分校强森综合癌症中心放射肿瘤科的研究人员第一次报道放射疗法尽管在每次治疗期间杀死一半的肿瘤细胞,但是它也能够将其他癌细胞转变为抵抗治疗的乳腺癌干细胞。
这些乳腺癌干细胞的产生抵消了放射治疗其他方面的高度有效作用。这项研究通讯作者Frank Pajonk博士是放射肿瘤学副教授,也是强森综合癌症中心研究员。他说,如果科学家能够揭示这一机制和阻止这种转化的发生,对乳腺癌进行放射治疗可能变得更加有效。
Pajonk也是加州大学洛杉矶分校再生医学和干细胞伊莱和伊迪特-布罗德中心(Eli and Edythe Broad Center of Regenerative Medicine and Stem Cell Research at UCLA)的一名科学家。他说,“williamhill asia 发现这些诱导性乳腺癌干细胞(induced breast cancer stem cell, iBCSC)是放射诱导的细胞途径激活而产生的,不过在再生性医学中相同细胞途径的激活也被用来重编程正常细胞为诱导性多功能干细胞(induced pluripotent stem cell, iPSC)。发现这些乳腺癌使用相同的重编程途径反击放射治疗是非常有意义的。”
2012年2月13日,这些研究结果在线发表在得到同行评鉴的《干细胞》期刊上。
这篇研究论文陈述到,“控制乳腺癌干细胞的放射治疗抵抗性和放射治疗期间产生新的iBCSC可能最终改善治疗效果,同时可能允许以降阶梯的方式降低当前给乳腺癌病人施加的总放射剂量,从而降低急性不良反应和长期不良反应。”
在乳腺癌中,乳腺癌细胞大量存在,但是乳腺癌干细胞存在的数量极其稀少。在这项研究中,Pajonk和他的研究小组首先消灭数量稀少的乳腺癌干细胞,然后剩余的乳腺癌细胞经过放射线照射后就被移植到小鼠身上。
利用Pajonk和他的研究小组开发的可视化癌干细胞的一种独特性成像系统,研究人员能够观察到在放射治疗后,它们作出反应并开始产生iBCSC。Pajonk说,这种新产生的iBCSC显著性地类似于未接受放射时在肿瘤中发现的乳腺癌干细胞。
研究小组也发现相比于未接受放射时iBCSC起源的乳腺癌细胞,iBCSC形成肿瘤的能力增加了30多倍。
Pajonk说,这项研究将乳腺癌的两种竞争性理论模型---克隆进化(clonal evolution)和层次组织(hierarchical organization)统一起来,就像它提示着那样,未受干扰的生长中肿瘤维持小量癌干细胞。然而,如果遭受到来自许多种威胁癌干细胞数量的胁迫因素的挑战,乳腺癌细胞产生iBCSC,而且这种新生产的iBCSC可能与已存活下来的癌干细胞一起重新入住肿瘤之中。
Pajonk说,“关于这项研究真正激动人心的是,它让williamhill asia 对放射与癌细胞之间的相互作用有了更加复杂的了解,而不只是放射导致DNA损伤和细胞死亡。”
Pajonk强调乳腺癌病人不应当被这些研究发现吓到,如果他们的肿瘤专家推荐的话,还是应当继续接受放射治疗。
他说,“放射是对抗乳腺癌的一种极其强大的工具。如果williamhill asia 能够揭示驱动这种转化的机制,williamhill asia 可能能够阻止它发生并使得放射疗法更加有威力。”
Radiation-induced Reprograming of Breast Cancer Cells
Chann Lagadec, Erina Vlashi, Lorenza Della Donna, Carmen Dekmezian, Frank Pajonk
Breast cancers are thought to be organized hierarchically with a small number of breast cancer stem cells (BCSCs) able to re-grow a tumor while their progeny lack this ability. Recently, several groups reported enrichment for BCSCs when breast cancers were subjected to classical anticancer treatment. However, the underlying mechanisms leading to this enrichment are incompletely understood.
Using non-BCSCs sorted from patient samples, we found that ionizing radiation reprogrammed differentiated breast cancer cells into induced BCSCs (iBCSCs). iBCSCs showed increased mammosphere formation, increased tumorigenicity and expressed the same stemness-related genes as BCSCs from non-irradiated samples. Reprogramming occurred in a polyploid subpopulation of cells, coincided with re-expression of the transcription factors Oct4, Sox-2, Nanog, and Klf4, and could be partially prevented by Notch inhibition.
We conclude that radiation may induce a BCSC phenotype in differentiated breast cancer cells and that this mechanism contributes to increased BCSC numbers seen after classical anti-cancer treatment.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言









#CEL#
49
#Cell#
57
#首次证实#
65
#stem cells#
55
#stem cell#
66
#癌细胞#
48
#STEM#
42
#癌干细胞#
44
#cells#
47