AJHG:跨6个不同种族/民族表观基因组关联研究揭示吸烟与DNA甲基化的联系
2024-04-01 测序中国 测序中国 发表于陕西省
该研究是迄今为止规模最大的多种族研究之一,突出显示了内部尼古丁摄入量与DNA甲基化的跨种族/民族特异性关联,揭示内部尼古丁摄入量是吸烟相关疾病的强有力预测因子。
吸烟是肺癌的主要高危因素,约85%肺癌病人都有吸烟史;流行病学研究表明,吸烟相关肺癌风险因种族/民族而异,并与吸烟者每支香烟中尼古丁和致癌物的摄取量(总尼古丁当量,TNEs)差异相关。已有研究揭示,与欧裔美国人相比,非裔美国人每吸一支香烟后尿液中TNE水平更高,这与其相应的吸烟相关肺癌风险水平一致;夏威夷原住民和拉丁裔每支香烟的TNE摄取量与欧裔美国人相似,但与其相应的吸烟相关肺癌风险水平不一致。
识别吸烟的表观遗传特征将有助于人们更好地预测吸烟相关疾病的风险,DNA甲基化与吸烟状态密切相关,可能介导对健康的影响,但目前人们对其与香烟内部摄入量之间的关联性研究有限。当前,许多表观基因组关联研究(EWAS)均集中于自报的吸烟状态,其中最大的一项研究跨16个流行病学队列,其报告了吸烟者和从未吸烟者在1,405个基因(包括AHRR、F2RL3和GPR15等)2,600多个CpG位点的差异甲基化。这些研究主要在欧洲血统的人群、美国印第安人、非裔美国人和拉丁裔中进行,缺乏其他代表性较低的人群数据,所得结果的普适性有限。
近日,美国夏威夷大学癌症研究中心、凯克医学院的科研人员在American Journal of Human Genetics上发表了题为“Epigenome-wide association study of total nicotine equivalents in multiethnic current smokers from three prospective cohorts”的文章。研究团队在3个前瞻性队列中对跨6个不同种族/民族的2,728名参者进行血液白细胞全表观基因组关联研究(EWAS),分析了吸烟摄入量(通过检测TNEs)与DNA甲基化之间的关联。DNA甲基化是一种特殊的表观遗传变化,可以改变许多生物过程。在多种族队列(MEC)中发现,TNEs与超250个基因组区域中408个CpG位点的差异DNA甲基化相关,其中45个是新位点,51个位点经外部验证。综上,该研究是迄今为止规模最大的多种族研究之一,突出显示了内部尼古丁摄入量与DNA甲基化的跨种族/民族特异性关联,揭示内部尼古丁摄入量是吸烟相关疾病的强有力预测因子。

文章发表在AJHG
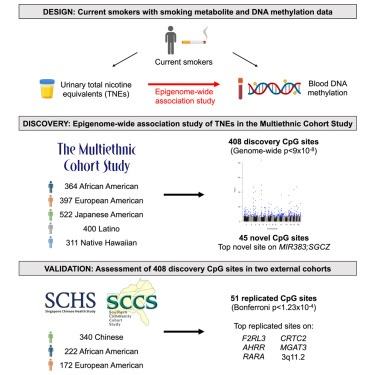
研究概要
研究团队使用在三个大型前瞻性队列的6个不同种族/民族群体中进行了EWAS,包括多种族队列研究(MEC)、新加坡华人健康研究(SCHS)和南部社区队列研究(SCCS),使用Infinium MethylationEPIC v1.0 BeadChip阵列(EPIC)检测了参与者的尿液TNEs和DNA甲基化(图1)。在发现队列MEC(n=1994)中,TNEs与250多个基因组区域的408个CpG位点与存在显著关联,有207个位点存在于HM450K芯片上,而201个是EPIC芯片独有的;最显著位点被注释为AHRR、F2RL3、RARA、GPR15、PRSS23和2q37.1,这些位点的甲基化程度都随着TNE的增加而降低。此外,85个(20.8%)位点与先前EPIC注释文件的SNP重叠。但研究团队在上述位点中并未观察到表观遗传学多峰分布,这表明变异主要受到遗传多态性的影响。
在上述408个CpG位点中,根据种族或民族的不同,有两个位点存在显著的异质性:与其他种族和民族相比,CYTH1基因的一个位点仅在吸烟的非裔美国人中显示出变化;MYO1G基因上的另一个位点与吸烟的拉美裔人的表观遗传变化联系更紧密,这些基因执行与癌症进展和其他疾病过程相关的功能。
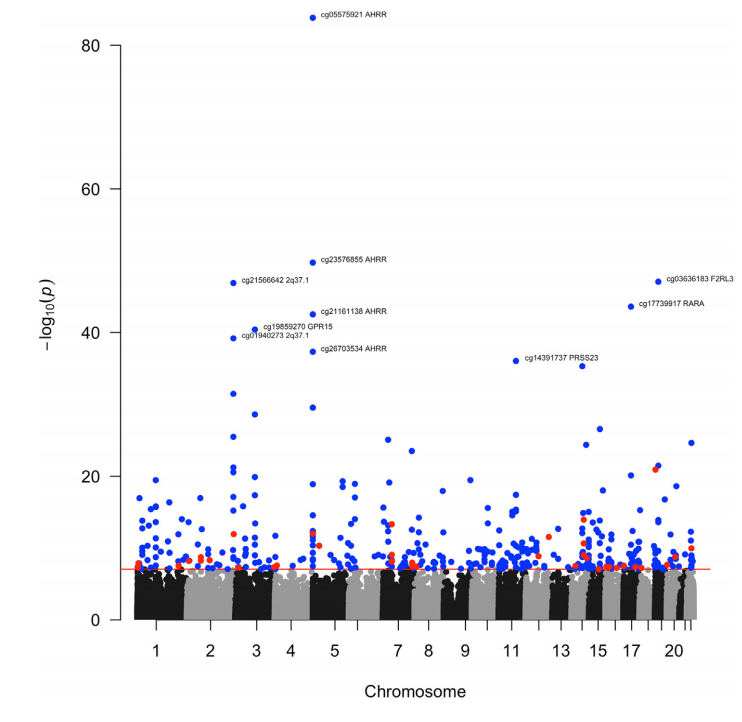
图1. TNEs发现性元分析EWAS的曼哈顿图
基于上述分析结果,研究团队共鉴定了45个新的CpG位点,其中42个是EPIC芯片所特有(图2),这些位点在先前研究中并未发现与任何吸烟指标(如吸烟状态、每天吸烟量、包年数、烟碱)相关;TNEs的增加与45个新位点中的39个(86.7%)DNA甲基化呈负相关(每增加一个TNEs对数单位,平均甲基化b值下降范围为0.0035–0.0147)。在所有45个新位点中,最显著的CpG位点位于17q21.32(cg21901790)、SLC28A1(cg22548335)、CXXC5(cg10185953)和SPTBN1(cg09465516)。
研究团队发现,上述45个新位点被注释到了39个基因中,其中有8个是先前未发现与吸烟相关DNA甲基化相关联的基因,即MIR383;SGCZ、SVILP1、EDEM2、LINC01411、LINC01475、PIK3C2G、C16orf96和CLDN11。在这些新基因中,最显著的位点是MIR383;SGCZ中的cg03748458,其与TNEs呈负相关。MIR383基因位于SGCZ的内含子中,编码microRNA-383(miR-383),其在许多类型的癌症中作为肿瘤抑制miRNA起作用。
已有研究表明,MIR383基因的表达在非小细胞肺癌中下调,但并未报道该基因的DNA甲基化与吸烟或肺癌风险的关联。此外,最近一项针对苏格兰Generation Scotland队列18,000名成年参与者的研究揭示,cg03748458位点也与慢性阻塞性肺病(COPD)相关。
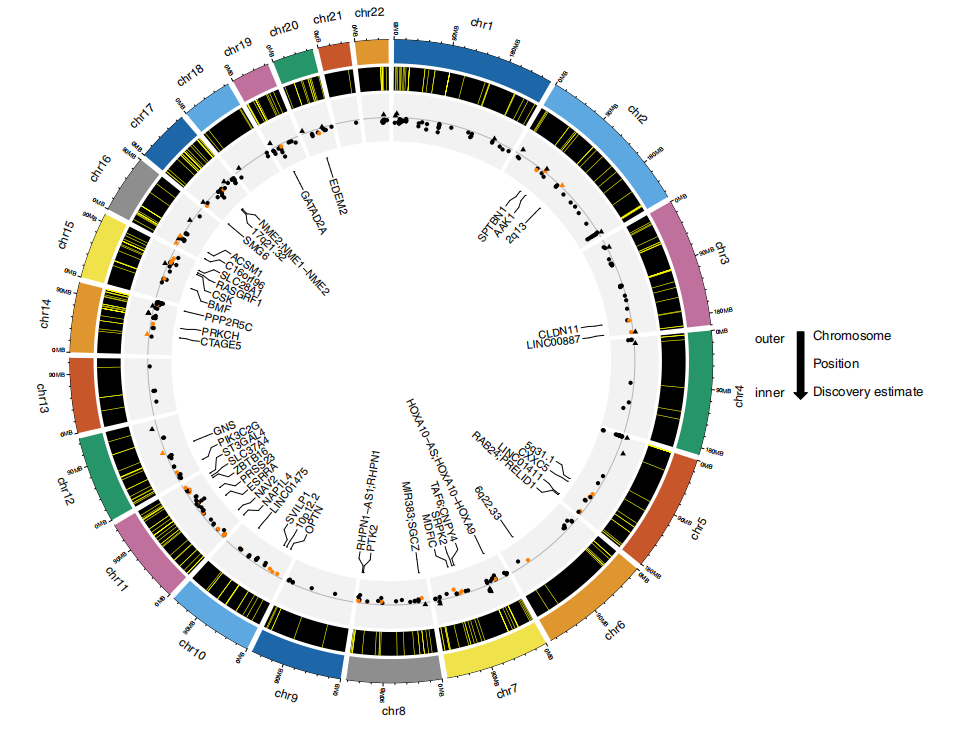
图2. 在TNEs发现性EWAS中408个显著结果的圆形基因组图。
接下来,研究团队收集了SCHS(n=340)和SCCS(n=394)队列参与者的TNEs和DNA甲基化数据,对上述408个CpG位点进行验证(图3)。结果显示,有51个CpG位点被复制,达到了Bonferroni校正的显著性阈值;TNEs的增加与几乎所有(51个中的50个)的位点DNA甲基化水平降低相关。最具统计学意义的复制结果包括已知的与吸烟相关的CpG位点,如F2RL3(cg03636183)和AHRR(cg05575921、cg25648203、cg23576855),以及较少报道的吸烟相关CpG位点,如RARA(cg17739917)、CRTC2(cg22441770)、MGAT3(cg05086879)、F2RL3(cg21911711)、3q11.2(cg04180924)和12p13.32(cg09842685)。
在更宽松的显著性阈值p < 0.01下,还有120个额外的位点(总共171个)在SCHS和SCCS中得到复制,这些复制位点的参数估计与发现阶段的估计方向和大小非常相似,这表明吸烟的最强表观遗传标记在多个种族/民族群体中是一致的。此外,研究团队还发现TNEs显著介导了每天吸烟量与15个位点的DNA甲基化之间的关联(平均介导比例为22.5%–44.3%)。
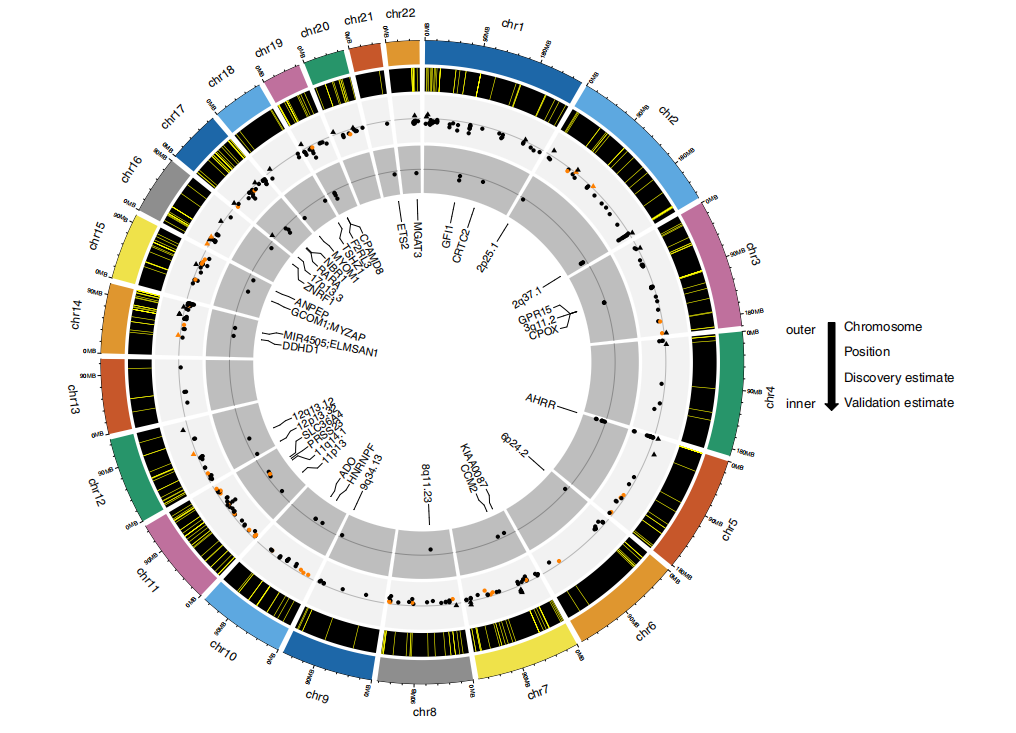
图3. TNEs发现性EWAS中408个显著结果和验证分析中的51个显著结果的圆形基因组图
综上所述,研究团队在三个队列研究中对跨六个种族/民族的个体进行了血液白细胞EWAS,共发现408个与吸烟有关的CpG位点,其中45个为新位点、51 个经过外部验证、2个因种族或民族而异。该研究揭示TNEs显著介导了吸烟摄入量与DNA甲基化之间的关联,并强调内部吸烟剂量相关的表观遗传修饰在多个种族和民族人群中的普遍性。这项研究提供了有关吸烟影响健康机制的额外信息,以及不同人群之间的差异,有助于人们更好地预测、早期发现和治疗吸烟相关疾病。”
论文原文:
Brian Z. Huang, Alexandra M. Binder. et al. Epigenome-wide association study of total nicotine equivalents in multiethnic current smokers from three prospective cohorts. AJHG 2024. DOI:https://doi.org/10.1016/j.ajhg.2024.01.012
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#吸烟# #DNA甲基化#
38