Science颠覆性发现:抑癌基因突变后,通过逃避免疫系统监控而导致癌症
2021-09-22 “E药世界”公众号 “E药世界”公众号
,癌症——作为“众病之王”,却仿佛一道难以攻克的天堑,至今仍未被人类所战胜。
随着科技进步和医学发展,许多令古代医师束手无策的疾病在当下都逐一被缓解,甚至彻底治愈。然而,癌症——作为“众病之王”,却仿佛一道难以攻克的天堑,至今仍未被人类所战胜。
破解癌症发生发展的机制对癌症的治疗是至关重要的。肿瘤抑制基因的突变被认为是导致癌症的重要原因,长期以来,科学家们一直认为,基因突变促使癌细胞不受控制地生长。然而,一项最新研究却表明,实际情况比这要复杂得多。
2021年9月16日,哈佛医学院的研究人员在国际顶尖学术期刊 Science 发表了题为:The adaptive immune system is a major driver of selection for tumor suppressor gene inactivation 的研究论文。
该研究发现,有超过100个突变的肿瘤抑制基因并不是直接作用于癌细胞,促使它们疯狂生长,而是采用“曲线救国”的方式——阻止免疫系统识别和摧毁肿瘤组织。这才是肿瘤组织不受控增殖的真实原因。
众所周知,许多癌细胞系都具有无限增殖的潜力,这被认为是肿瘤抑制基因突变的结果。但通常情况下,免疫系统会将癌细胞视为一种新兴的病原体,并试图将其消灭。因此,癌细胞仅仅拥有无限增殖的能力还远远不够,还必须通过基因突变进化出逃脱免疫系统监控的能力。
打个比方,这就像著名的科幻电影《黑客帝国》中,主角尼奥(癌细胞)脱离“矩阵”(人体)的掌控后,就会被无数黑衣人(免疫系统)的追捕,尼奥想要获得自由,就必须彻地击败或做好伪装瞒过黑衣人。而对于癌细胞来说,后者无疑更容易做到。
在这项研究中,研究团队利用CRISPR技术构建了7500个肿瘤抑制基因单突变的肿瘤细胞系,将这些细胞植入到小鼠体内。而这些小鼠也分为两组,对照组的野生型小鼠的免疫系统完好无损,实验组则为免疫缺陷小鼠。

基于CRISPR技术筛选肿瘤生长所需的基因突变
研究人员使用基因分析来确定哪些突变基因在肿瘤形成中起作用。他们发现,在每一种测试的肿瘤细胞系中,相对于免疫缺陷小鼠,野生型小鼠身上长出来的肿瘤存在肿瘤抑制基因缺失的显着富集。其中,三分之一的肿瘤抑制基因是通过免疫逃避作用的。
研究团队还将研究重点聚焦于一种特殊的基因——GNA13,并以此阐明了这一过程的发生机制。通过对该基因的深入研究,研究人员发现,该突变为癌细胞做了伪装,使得免疫系统的T细胞无法检测到它们。
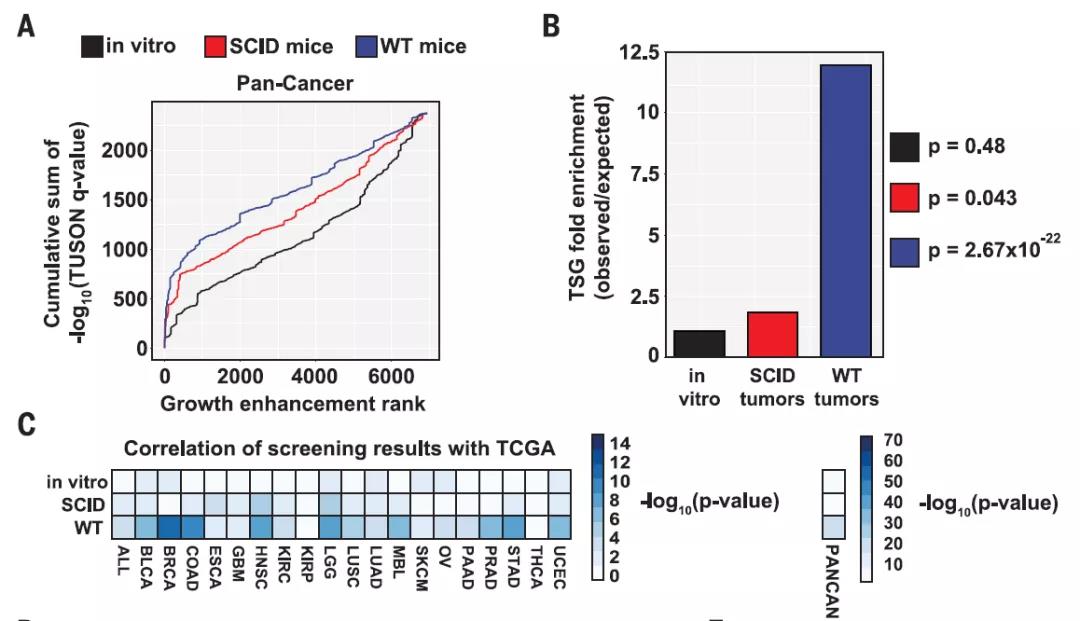
GNA13缺失的抑瘤作用是由于CCL2的表达和分泌的增加,从而导致肿瘤巨噬细胞的增加
本研究的通讯作者 Stephen Elledge 博士表示:“令人震惊的是,这些基因突变都在教导癌细胞如何逃避免疫系统,而不是简单地说‘生长,生长,生长!’”
突变的肿瘤抑制基因及其产生的蛋白质是癌症药物开发中常见的靶点,但有些却令人沮丧地难以捉摸,比如p53。本月早些时候,范德堡大学的一个团队发表的一项研究表明,非整倍体的染色体异常现象在p53突变的细胞中很常见,他们认为这一发现可以为针对这种异常蛋白的药物开发提供信息。
此外,今年6月,瑞典卡罗林斯卡学院的 Galina Selivanova 等人在 Cancer Discovery 上发表文章显示,可以通过MDM2抑制剂来重新激活正常的p53。因此,MDM2抑制剂联合其他抑制免疫检查点的药物,可以更好地抑制癌细胞生长。
Stephen Elledge 博士认为,他们的研究提供了一份肿瘤抑制基因列表,这有助于科学家们更好地了解癌症是如何逃避免疫系统的。他说道:“肿瘤可能使用了数百种途径实现免疫逃避,而发现这些途径可能会激发治疗癌症的新方法。”
原始出处:
TIMOTHY D. MARTIN, et al. The adaptive immune system is a major driver of selection for tumor suppressor gene inactivation. Science,2021.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#抑癌#
62
#抑癌基因#
64
#致癌#
59
#癌基因#
59
#SCIE#
54