总生存率近70%!《柳叶刀》子刊:治疗晚期癌症,创新疗法优化多项临床结局
2024-05-15 医学新视点 医学新视点 发表于上海
德曲妥珠单抗是一种靶向HER2的新型ADC疗法,由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(喜树碱类衍生物DXd)连接组成。
抗体偶联药物(ADC)是一类将靶标特异性的单克隆抗体与高杀伤性的细胞毒性药物(也称有效载荷)通过特定连接头偶联起来的靶向生物药,其利用单克隆抗体作为载体,将小分子细胞毒性药物高效地靶向运输到目标肿瘤细胞中。
德曲妥珠单抗(trastuzumab deruxtecan,T-DXd)是最具代表性和最受关注的新一代ADC之一。发表于The Lancet Oncology的一项研究(DESTINY-PanTumor01)结果显示,在接受过大量治疗且携带特定HER2激活突变的多种肿瘤类型患者中,德曲妥珠单抗表现出抗肿瘤活性和持久应答。

截图来源:The Lancet Oncology
HER2是一种酪氨酸激酶受体,参与刺激细胞增殖、分化和存活的信号通路。HER2激活突变或是多种癌症的致癌驱动因素。靶向HER2的疗法给多种类型肿瘤的治疗带来了新的选择。德曲妥珠单抗是一种靶向HER2的新型ADC疗法,由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(喜树碱类衍生物DXd)连接组成。该疗法在不同HER2表达水平的实体瘤中均显示出抗肿瘤活性。
-
2024年4月美国癌症研究协会(AACR)大会期间公布了DESTINY-Lung05研究结果,该研究表示,在既往经治HER2突变NSCLC中国患者中,采用德曲妥珠单抗治疗可给患者带来近60%的客观缓解,同时患者疾病控制率超过90%。
-
既往Annals of Oncology发表DESTINY-Breast01试验的更新累积生存结局(中位随访时间26.5个月)数据显示,在既往接受过大量治疗的HER2阳性转移性乳腺癌患者中,德曲妥珠单抗具有持续的抗肿瘤活性:经独立中心审评评估的ORR为62.0%(95% CI,54.5%~69.0%),其中分别有54.9%和7.1%的患者达到部分缓解和完全缓解。
-
The Lancet Oncology之前发表研究(DESTINY-Gastric02)表示,在HER2阳性晚期胃癌或胃食管交界处癌患者中,采用德曲妥珠单抗治疗可分别使38%(95% CI 27.3~49.6)(主要分析)和42%(95% CI 30.8~53.4)(更新分析)患者获得客观缓解。
-
此外,之前有研究者还评估了德曲妥珠单抗在HER2突变型NSCLC、HER2过表达型胃癌和结肠癌、HER2低表达转移性乳腺癌、HER2过表达型泛癌种(即不区分原发灶器官)中的治疗应用,这些试验的分析结果显示,该疗法可为其他多种类型HER2过表达癌症患者以及HER2低表达转移性乳腺癌患者带来一致的有临床意义的生存获益。
目前德曲妥珠单抗已有多个适应证在全球多个国家获批上市。其中包括:获得美国FDA批准用于HER2突变NSCLC、HER2阳性或低表达乳腺癌、HER2阳性胃癌和胃食管交界处腺癌等。在中国,德曲妥珠单抗已获得中国国家药品监督管理局(NMPA)批准用于HER2阳性或低表达乳腺癌治疗。2024年4月,德曲妥珠单抗获得美国FDA批准具有“不限癌种”适应证,用于既往经治、无法切除或转移性HER2阳性(免疫组化[IHC]3+)实体瘤成年患者。
发表于The Lancet Oncology的这项研究(DESTINY-PanTumor01),目的是在接受过大量治疗且携带特定HER2激活突变的多种肿瘤类型患者中,评估德曲妥珠单抗的疗效和安全性。这项开放标签、2期研究于2020年12月30日~2023年1月25日期间在亚洲、欧洲和北美共29家医学研究中心进行,纳入102例年龄为18岁或以上、东部肿瘤协作组表现状态为0或1分、携带特定HER2激活突变的不可切除或转移性实体瘤、在既往治疗后出现疾病进展或没有令人满意的替代治疗选择的患者,并将其安排接受德曲妥珠单抗5.4 mg/kg静脉输注、每3周一次。
102例患者中,有62例(61%)女性和40例(39%)男性,患者中位年龄为66.5岁。患者既往治疗方案中位数为3种。至数据截止日期(2023年1月25日),中位随访时间为8.61个月。在随访期间,每3个月评估一次患者的生存情况和随后的抗癌治疗效果。研究者对所有接受至少一剂德曲妥珠单抗的患者的抗肿瘤活性和安全性进行了分析。
主要终点为通过独立中心审评评估确认的客观缓解率(定义为确定的完全缓解或部分缓解的患者比例)。研究结果显示,经独立中心审评评估确认的客观缓解率为29.4%(95% CI 20.8~39.3;102例患者中有30例)。
次要终点包括由研究者评估确认的客观缓解率,独立中心审评和研究者评估的缓解持续时间、疾病控制率、无进展生存期、6个月和12个月时存活且无进展的患者比例和总生存期。
-
研究者评估确认的客观缓解率为32.4%(95% CI 23.4~42.3;102例中有33例)。
-
在有客观缓解的患者中,经独立中心审评评估的中位缓解持续时间无法估计(95% CI 6.8~无法估计)。根据研究者评估,中位缓解持续时间为11.0个月(95% CI 7.9~18.1)。
-
独立中心审评评估的6周时疾病控制率为75.5%(95% CI 66.0~83.5,n=77),研究者的评估为70.6%(95% CI 60.7~79.2,n=72)。
-
102例患者中,61例(60%)经独立中心审评存在无进展生存事件,75例(74%)经研究者评估存在无进展生存事件。6个月时存活且无进展的患者比例为41.4%(95% CI 30.8~51.6),12个月时存活且无进展的患者比例为30.9%(95% CI 20.6~41.8)。
-
经独立中心审评的中位无进展生存期为5.4个月(95% CI 2.7~7.1),经研究者评估的中位无进展生存期为4.4个月(95% CI 2.8~5.6)。
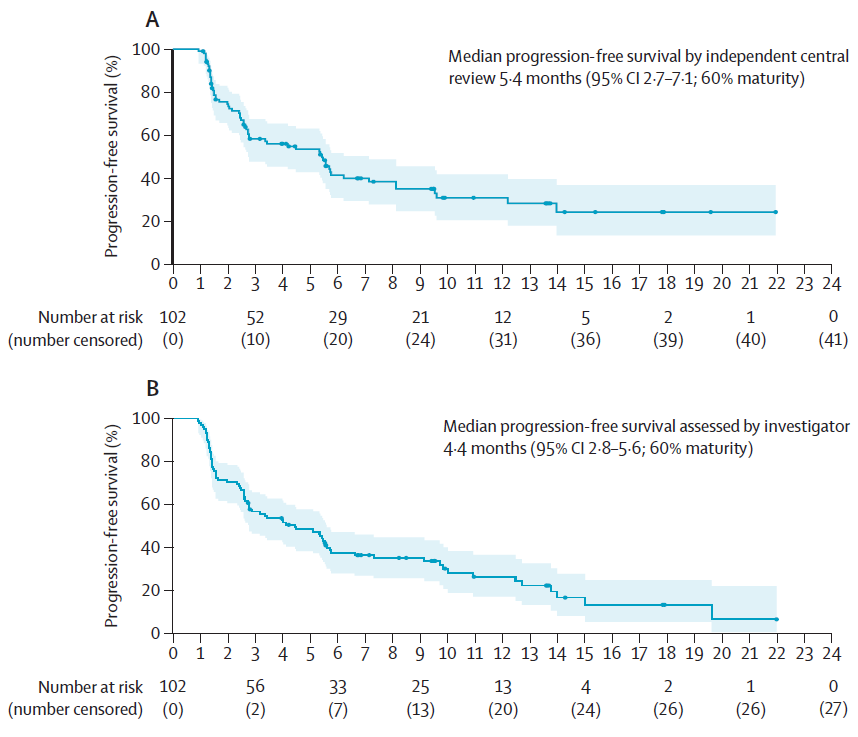
▲在接受德曲妥珠单抗治疗的患者中,经独立中心审评(A)和研究者(B)评估的无进展生存期(图片来源:参考资料[1])
-
102例患者中有58例(57%)在数据截止时死亡。6个月总生存率为67.6%(95% CI 57.4~75.9),12个月总生存率为46.3%(95% CI 35.7~56.3)。中位总生存期为10.9个月(95% CI 8.3~14.9)。
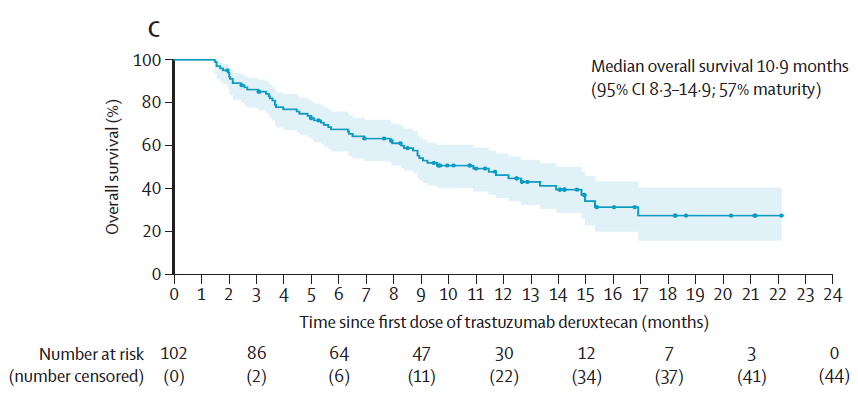
▲接受德曲妥珠单抗治疗患者的总生存期(图片来源:参考资料[1])
102例患者中有52例(51%)发生3级或更严重的治疗相关不良事件,最常见的治疗相关不良事件(≥5%)是贫血(16[16%])和中性粒细胞计数减少(8[8%])。
总的来说,在接受过大量治疗且携带HER2激活突变的多种肿瘤类型患者中,德曲妥珠单抗表现出抗肿瘤活性和持久应答,且没有新的安全信号。这些研究结果支持进一步的临床研究,以确定哪些HER2突变实体瘤患者将从德曲妥珠单抗中获益最多。
在癌症治疗领域,ADC凭借在诸多适应证中的优异表现,已经逐渐成为医学领域新的焦点,被誉为癌症治疗的“革命性药物”。根据公开资料不完全统计,目前全球范围内已有8款癌症相关ADC疗法处于3期进行及申请上市阶段(不包括启动中或已暂停试验),针对的适应证主要包括各种类型乳腺癌、非小细胞肺癌、胃癌和膀胱癌等。
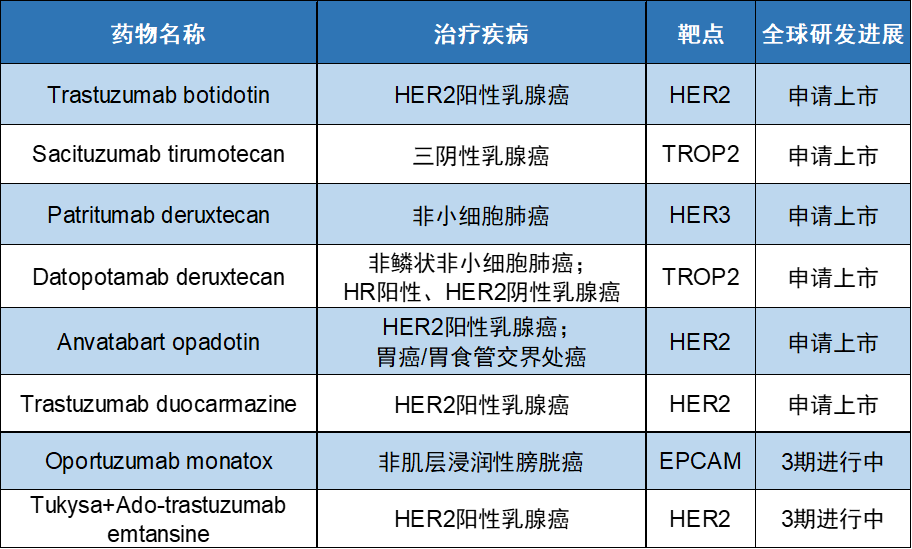
参考资料
[1] Li BT, et al., (2024). Trastuzumab deruxtecan in patients with solid tumours harbouring specific activating HER2 mutations (DESTINY-PanTumor01): an international, phase 2 study. Lancet Oncol, doi: 10.1016/S1470-2045(24)00140-2.
[2] Najjar MK, et al., (2022). Antibody-Drug Conjugates for the Treatment of HER2-Positive Breast Cancer. Genes (Basel), doi:10.3390/genes13112065.
[3] FDA grants accelerated approval to fam-trastuzumab deruxtecan-nxki for unresectable or metastatic HER2-positive solid tumors. Retrieved April 5, 2024 from https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2.
[4] Van Cutsem E, et al., (2023). Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol, doi: 10.1016/S1470-2045(23)00215-2.
[5] Mosele F, et al., (2023). Optimizing the potential of antibody-drug conjugates in oncology. Ann Oncol, doi: 10.1016/j.annonc.2023.08.020.
[6] CT248/7 - Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2 mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Retrieved April 8, 2024 from https://www.abstractsonline.com/pp8/#!/20272/presentation/11569.
[7] 重磅 | 优赫得®在华获批作为首个针对HER2低表达转移性乳腺癌的抗HER2靶向疗法. Retrieved April 8, 2024 from https://www.astrazeneca.com.cn/zh/media/press-releases/2023/07-12-01.html.
[8] Saura C, et al., (2023). Trastuzumab Deruxtecan in Previously Treated Patients With HER2-Positive Metastatic Breast Cancer: Updated Survival Results From a Phase 2 Trial (DESTINY-Breast01). Ann Oncol, doi:10.1016/j.annonc.2023.12.001.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#癌症# #德曲妥珠单抗#
26