北京理工大学李玉婧AM:水凝胶介导重塑癌症相关成纤维细胞可协同增强骨肉瘤的化学免疫治疗
2024-01-02 BioMed科技 BioMed科技 发表于上海
北京理工大学李玉婧助理教授、国家纳米科学中心孟幻研究员和北京大学人民医院Ran Wei等人开发了一种序列纳米复合水凝胶,它可重塑CAF的行为,增强骨肉瘤中的肿瘤浸润T细胞。
在骨肉瘤中,免疫疗法通常面临癌症相关成纤维细胞(CAFs)带来的障碍,这些成纤维细胞分泌密集的细胞外基质成分和细胞因子,从而限制免疫疗法的效果。然而,有研究认为直接去除CAFs可能并不见效的,甚至会促进肿瘤转移的发生。
为了应对这一挑战,北京理工大学李玉婧助理教授、国家纳米科学中心孟幻研究员和北京大学人民医院Ran Wei等人开发了一种序列纳米复合水凝胶,它可重塑CAF的行为,增强骨肉瘤中的肿瘤浸润T细胞。在富含基质的骨肉瘤模型中,CAF抑制剂(Nox4抑制剂,Nox4i)可有效对抗CAF激活,克服T细胞排斥机制,然后通过程序性L-Dox触发免疫原性细胞死亡(ICD)。而将共递送凝胶与αPD-1检查点抑制剂相结合,则进一步增强了其在原位骨肉瘤模型中的有效性。免疫表型数据显示,肿瘤T细胞浸润的显著增强可在动物水平上发挥更加有利的抗肿瘤免疫。相关工作以“Synergistic Chemoimmunotherapy Augmentation via Sequential Nanocomposite Hydrogel-Mediated Reprogramming of Cancer-Associated Fibroblasts in Osteosarcoma”为题发表在Advanced Materials。

【文章要点】
在骨肉瘤中,肿瘤微环境(TME)可能具有免疫抑制作用,可使T细胞等免疫细胞的浸润和攻击更具挑战性。肿瘤的细胞外基质组成、免疫抑制细胞的存在和免疫检查点分子的表达等因素共同促成了所谓的“T细胞排斥机制”。具体而言,骨肉瘤TME是一种复杂的环境,其中肿瘤细胞与多种基质细胞共存,包括肿瘤相关成纤维细胞(CAFs)。研究表明,CAFs通过表达多种生长因子(包括TGF-β和血管内皮因子)来协调肿瘤进展和侵袭。一方面,CAFs通过产生一系列细胞因子如CTLA-4、IL-1和TGF-β来调节T细胞免疫。另一方面,CAFs通过分泌丰富的胶原蛋白和其他物质,有助于在肿瘤组织周围形成物理屏障,阻碍药物有效渗透到骨肉瘤中。因此,在本研究中,作者利用羧甲基壳聚糖和四价聚乙二醇的可注射混合物形成纳米水凝胶,用于控制释放强效CAF抑制剂Nox4i和脂质体阿霉素(L-Dox),以在原位给药时诱导免疫原性细胞死亡(图1)。
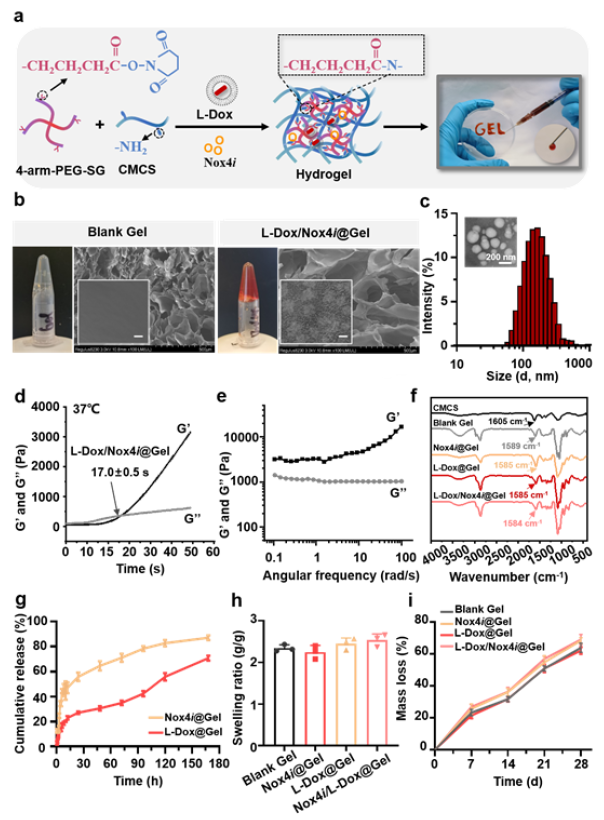
图1 水凝胶制备
最近的研究已经发现,, Nox4i具有精确的靶向和对TME的独特作用。Nox4i可特异性地将CAFs恢复到正常状态,有效调节T细胞胞吐,缓解间充质高血压,并增强T细胞和抗肿瘤药物的浸润。由于其亲水性,水凝胶中的Nox4i优先释放,并作用于肿瘤间质中的CAFs,促进随后L-Dox的递送并促进T细胞浸润。在这种顺序递送系统中,结合αPD-1后可在体内产生优异的协同化疗-免疫疗法抗肿瘤效果(图2)。
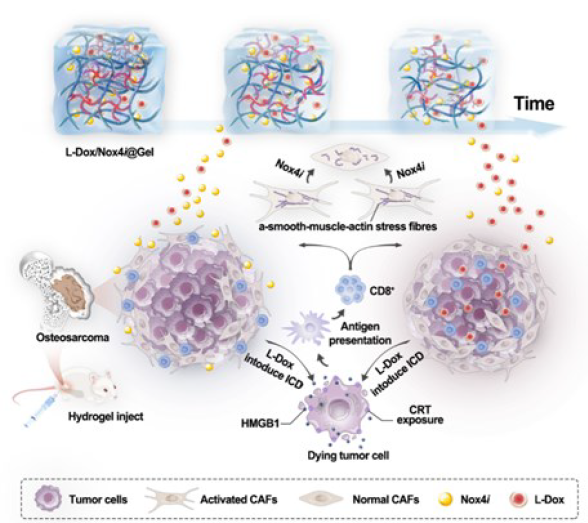
图2 抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202309591
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#骨肉瘤# #水凝胶#
53
好文章,谢谢分享。
36
学习了,谢谢分享
40