ESMO Open:接or不接?对于抗癌治疗患者,BNT162b2 COVID-19疫苗效果如何?
2021-09-11 MedSci原创 MedSci原创
抗肿瘤治疗患者对BNT162b2新冠mRNA疫苗的体液免疫反应降低,尤其是接受化疗或利妥昔单抗的患者。
COVID-19大流行已席卷全球,影响超过1.8亿人,至今已导致400多万人死亡。虽现有证据表明实体肿瘤患者对COVID-19通常能产生类似于非癌症患者的免疫反应,但他们患重症COVID-19的风险仍然较高,应优先接种疫苗。然而,在接受治疗的癌症患者中,COVID-19疫苗接种的安全性和有效性尚不清楚。
pixabay
本研究在2021年2月15日和3月2日间,召集159名实体肿瘤患者和41名血液恶性肿瘤患者。其中7名癌症患者(4%)在研究开始前至少14天已有PCR确诊的SARS-CoV-2感染。200例患者均接受了BTN162b2疫苗初次接种,197例(98.5%)接受了加强接种。其中188名患者(95.4%)在21(±2)天后加强接种,9名患者(4.6%)由于主动感染或癌症治疗相关并发症而延迟了加强接种。健康对照组中的所有受试者均接受初次及加强接种,间隔为21天。
1、安全性和耐受性
最常报告的局部不良反应是注射部位的轻度到中度疼痛。严重反应发生在1%的初始接种和3%的加强接种中 (图2A) 。报告局部疼痛和发红的患者在加强接种中的比例较高(21.5%vs9%;10.2%vs3%)。对于接受靶向/激素治疗的患者,在加强接种后报告局部不良反应的比例高于初始接种(32.5% 对 516.3%),其他组别无显著差异。所有局部不良反应均在 3 到 5 天内解决。
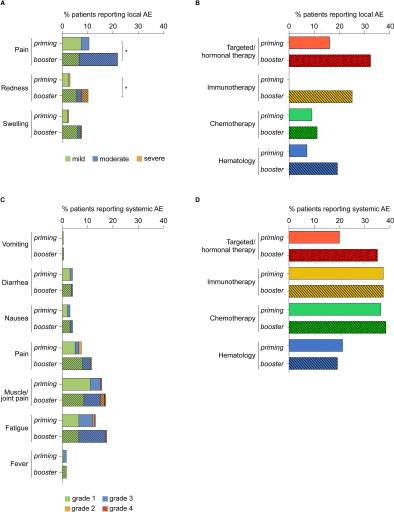
图2:局部和全身性不良事件bnt162b2 疫苗接种后七天内报告。报告不良反应患者比例表示该组中的患者占比(初次接种:n=41 血液学组群, n=80靶向/激素治疗组,n=63化疗组,n=16免疫治疗组;第二次疫苗剂量:n=41血液学组,n=80靶向/激素治疗组,n=60化疗组,n=16免疫治疗组)(B组和D组)。空白条为初次接种后报告不良反应,而破折号条代表加强接种后报告不良反应,p<0.05。
在每次接种后报告的全身不良反应类似,其中疲劳(初次接种 13%,加强接种17.5%) 和肌肉/关节疼痛(初次接种15.5%, 加强接种17%) 是最常见的 (图2C)。严重全身不良反应报告在两剂接种后均低于2%(疲劳在0.5%,肌肉/关节疼痛在1%;图2C. )在两剂接种后,系统性不良反应发生比例在所有研究组中都相似 (图2D).
本次共报告了7例严重不良反应。一名口服卡普西他宾治疗的第四期乳腺癌患者有非致命性肺栓塞。众所周知,癌症患者发生血栓事件的风险较高,调查人员认为这与疫苗无关,而与癌症有关。两名患者报告短暂性轻度神经疾病(接种疫苗后5-6天),在48小时内消失,脑磁共振成像正常,没有血栓或免疫病因证据。在研究期间,有四名患者死亡。三例被认为与BNT162b2疫苗无关而与癌症有关的死亡。一名患者死于心肌梗死。
2、疫苗诱导的抗体应答和免疫应答的有效性
接受化疗的实体肿瘤患者在加强接种后28天SARS-CoV-2 RBD-IgG抗体几何平均滴度(GMT)明显低于健康对照组(GMT分别为2955.04IU/mL [95% CI 2280.17-3829.65]和234.05 IU/mL [95% CI 122.10-448.66])。血液癌患者的SARS-CoV-2 RBD-IgG滴度(GMT 17.61 IU/mL [95% CI 7.17-43.24])明显低于健康对照组,也低于所有其他癌症队列。在接受靶向/激素治疗的实体肿瘤接种患者和健康对照组之间,在加强接种28天的SARS-CoV-2 RBD-IgG抗体水平没有差异(GMT 1844·93 IU/mL [95% CI 1383.57-2460.14]),这两个队列都可以被分类为高应答。在免疫治疗队列中,高反应者的比例为80%,与健康对照组相似。
然而,与健康对照组相比,化疗和血液学队列中高应答者的百分比(分别为55%和29%)显著降低。在化疗队列中,“非循环”亚组和“循环”亚组之间没有差异。在血液学队列中,利妥昔单抗队列中的SARS-CoV-2 RBD-IgG水平(GMT 4.12iu /mL [95% CI 2.25 -7.52])低于既往异体造血干细胞移植患者(GMT 610.67iu /mL [95% CI 148.77-2506.63])。此外,在接受cd20抗体利妥昔单抗(7%)的患者中,高反应率明显低于之前接受同种异体造血干细胞移植(82%)的患者。
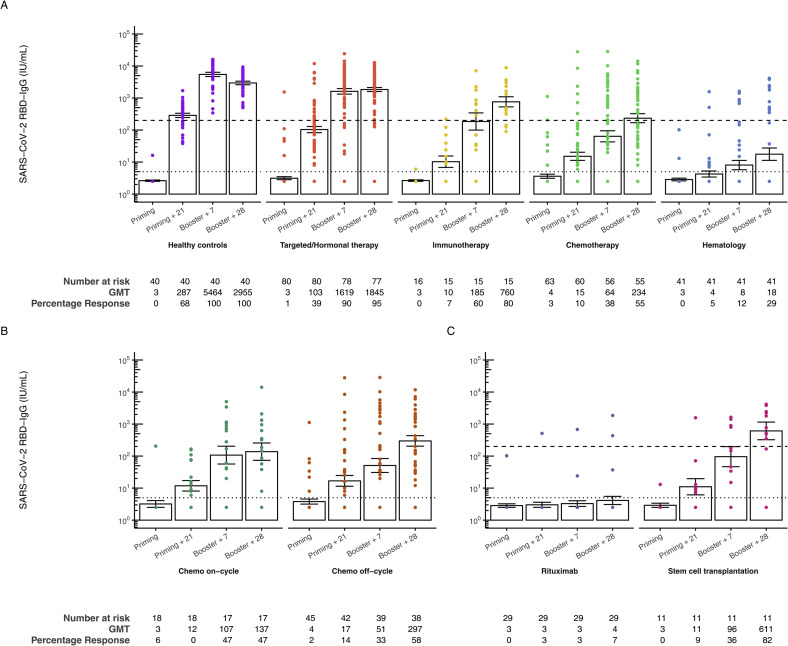
治疗队列随时间变化的变化与健康对照组显著不同,主要是在基线和初始接种后21天之间,这表明接受治疗的癌症患者出现了延迟抗体反应。
通过分析对武汉SARS-CoV-2野生型株的抗S1抗体应答和体外50%中和滴度(NT50),本研究将更深入地评价疫苗诱导的体液免疫应答。NT50健康对照组(GMT122.63 (95% CI 76.85 - 195.67)和接受目标靶向/激素治疗患者(GMT188.69 (95% CI 83.22 - 169.30])是类似的,而接受免疫治疗、化疗、以及血液癌症患者显著降低(GMT分别为34.55 (95% CI 11.67 - -102.23);24·54 [95% CI 14·50-41·52]和8.68 [95% CI 5.55-13.57])。此外,利妥昔单抗队列的中和能力极低,仅一名患者的NT50高于检测限度。
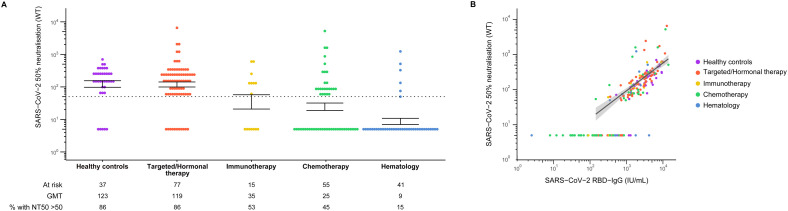
在接受加强接种的所有患者中,52%的患者在初次及加强接种之间至少进行了一次SARS-CoV-2核酸检测,其中只有两名患者(均接受靶向/激素治疗)检测呈阳性,1例无症状,1例中度。在加强剂量后的3个月内,三名癌症患者(两名接受靶向/激素治疗,一名患血液系统恶性肿瘤)在加强接种后(17、38和39天后)检测出SARS-CoV-2阳性。接受激素治疗的患者在加强接种28天出现了适当的免疫应答(抗rbd IgG滴度1825iu /mL),解释其无症状感染。接受利妥昔单抗治疗的患者在加强接种28天后未表现出任何体液免疫反应迹象,这解释了COVID-19重症感染并住院两周的情况。
这项研究表明,虽然积极治疗的癌症患者(包括免疫治疗的患者)对BNT162b2 COVID-19疫苗耐受性良好,但部分癌症患者仍缺乏有效免疫反应的能力,尤其是接受化疗或利妥昔单抗治疗的患者。因此,在这些情况下,群体免疫和自我保护至关重要,这些患者的照顾者、家庭成员和/或密切接触者应尽早接种疫苗。此外,这项研究提出了第三剂疫苗接种以提高癌症患者的免疫力的问题,因为最近已经证明这可以显著改善BNT162b2疫苗的免疫原性。
综上所述,BNT162b2疫苗对正在接受抗肿瘤治疗的癌症患者是安全的。但SARS-CoV-2 RBD-IgG抗体水平的降低表明有效性降低,考虑到癌症患者重症COVID-19的风险增加,这具有重要的公共卫生意义。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言









#抗癌治疗#
73
#PE#
65
#SMO#
54
#ESMO#
70
本研究在2021年2月15日和3月2日间,召集159名实体肿瘤患者和41名血液恶性肿瘤患者。。
82
疗效只是效果的众多方面之一,还要看对患者的获益,包括生活质量等因素共同决定效果的
88
疗效只是效果的众多方面之一,还要看对患者的获益,包括生活质量等因素共同决定效果的
79
BNT162b2疫苗对正在接受抗肿瘤治疗的癌症患者是安全的。但SARS-CoV-2 RBD-IgG抗体水平的降低表明有效性降低,考虑到癌症患者重症COVID-19的风险增加,这具有重要的公共卫生意义。
98