最新ACS Nano:多模式成像引导干细胞眼压治疗
2024-07-16 BioMed科技 BioMed科技 发表于上海
研究提出 PAOFM 成像方法,用金纳米粒子簇标记干细胞,对其迁移和行为进行无创纵向监测,有望增强再生细胞治疗。
干细胞疗法作为治疗各种退行性疾病的有前景的治疗方法,越来越受到关注。再生医学的临床和临床前研究都因缺乏能够评估移植后干细胞迁移和行为的技术而受到阻碍。
在本研究中,密歇根大学安娜堡分校Yannis M. Paulus、Xueding Wang和Abigail T. Fahim等人提出了一种创新的PAOFM成像方法,通过多模式光声显微镜(PAM)、光学相干断层扫描(OCT)和超小型链状金纳米粒子簇(GNC)纳米传感器提供的荧光成像(FM),对分化为视网膜色素上皮(hiPSC-RPE)细胞的体内人类诱导多能干细胞进行纵向成像。GNC在近红外区域表现出光学吸收峰,解组装后直径为7-8 nm,能够实现肾脏排泄,具有相当的安全性和生物相容性。在临床相关的兔模型中,GNC标记的hiPSC-RPE细胞迁移到RPE变性区域并再生受损组织。研究对hiPSC-RPE细胞的分布和迁移进行了为期6个月的无创纵向监测,这一方法展现出了极高的灵敏度和空间分辨率。这种先进的细胞成像平台有望增强基于再生细胞的治疗。相关工作以“Multimodal Imaging-Guided Stem Cell Ocular Treatment”为题发表在ACS Nano。

【文章要点】
为了研究上述的多模式技术是否允许在体内移植到视网膜下区域后对活的hiPSC-RPE细胞进行成像,作者用超小型生物相容性金纳米传感器探针标记hiPSC-RPE细胞,以对细胞进行PAOFM成像。作者使用脉冲激光烧蚀(PLA)方法的物理方法制造了超小型GNC(图1)。所制造的GNC由3-5个单独的胶体GNP组成,每个胶体GNP的平均直径为7-8 nm,通过使用两种特定肽(CALNN和半胱胺)进行连接。这种方法的一个好处是,所制造的GNC具有大ζ电位值(−41 mV)的自然负电荷,并且非常稳定。这种方法的好处包括:(1)它代表了一种完全绿色的合成方法,可在去离子水中直接产生无毒、胶体稳定、高纯度的金纳米颗粒,不含封端剂或稳定剂。控制这些纳米颗粒的尺寸和尺寸分布可以通过优化激光参数来实现,包括波长、脉冲能量、持续时间和重复率;(2)所得的高纯度和不含封端/稳定剂的GNP能够实现精确的表面功能化,以实现各种类型配体与预定量的偶联。
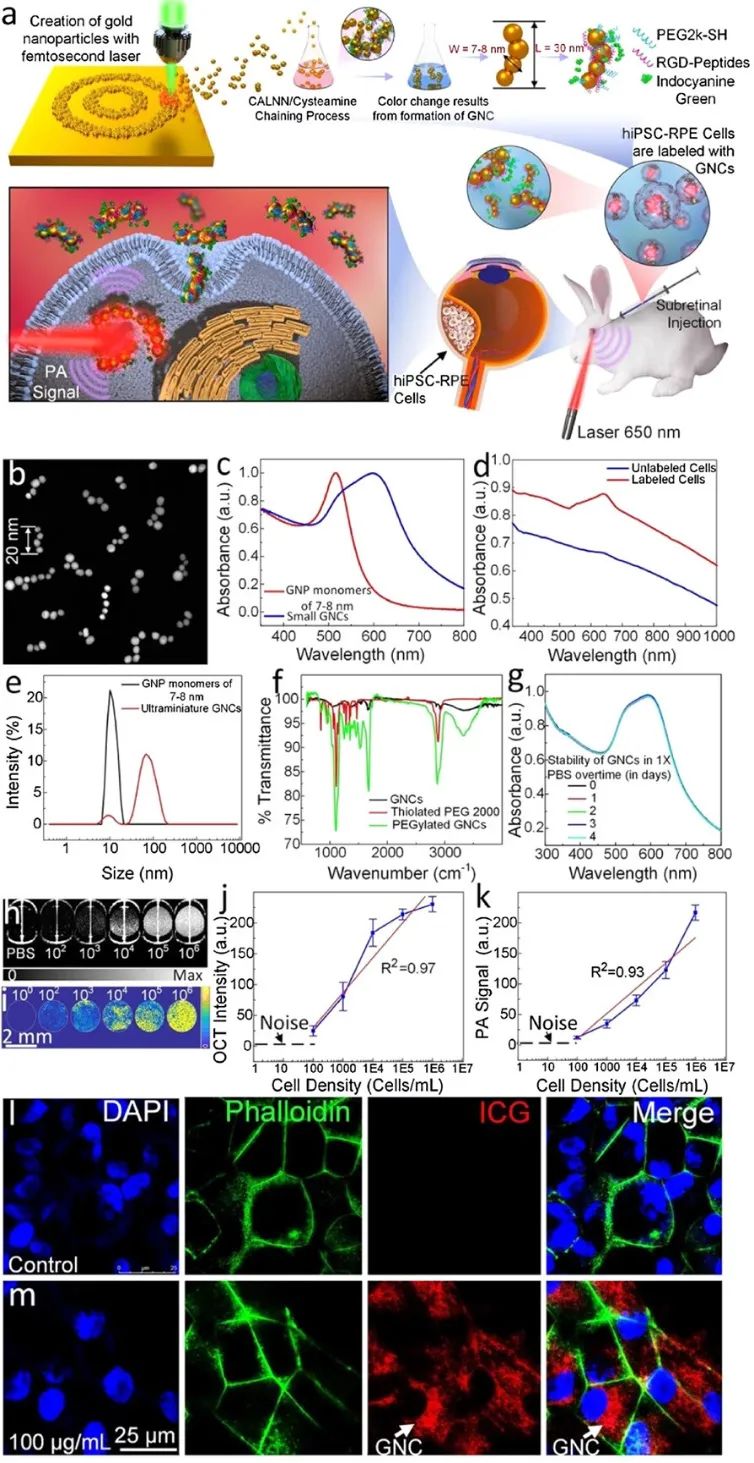
图1 材料制备
基于这一GNC,研究展示了一种多模式PAOFM成像技术,用于追踪移植后的hiPSC-RPE细胞。这种结合PAM、OCT和FM的三维成像系统是一种无创、实时的系统,为体内追踪移植干细胞提供了高空间分辨率和高灵敏度。本研究首次对移植的hiPSC-RPE细胞的位置和迁移模式以及它们对受损RPE细胞进行了纵向可视化和成像。由于其独特的“链”设计,GNCs的光学吸收峰被红移到红/NIR光谱,这成功地避免了与血红蛋白的强光学吸收峰的重叠,并有助于在体内捕获高分辨率图像和跟踪眼组织中的标记干细胞。“链”设计还允许GNCs保持7-8纳米的大小,使其能够通过肾脏排泄(图2)。因此,作者认为这种创新的干细胞成像技术将在生物医学和再生医学中有广泛的应用,包括为追踪干细胞命运提供额外的机会,以研究治疗反应和评估受损组织的再生。
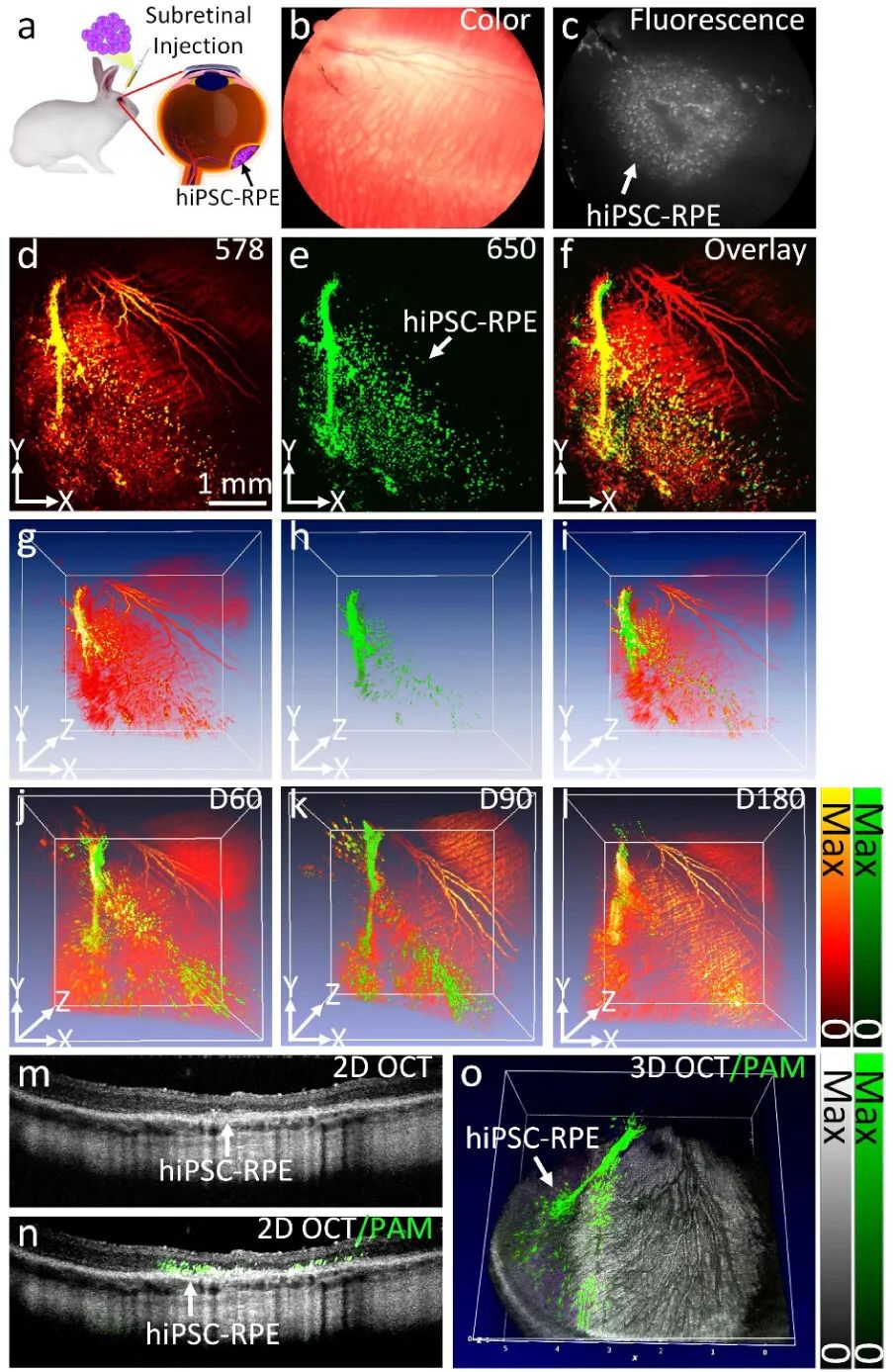
图2 体内PAOFM成像
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c10632
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#干细胞疗法# #PAOFM# #金纳米粒子簇# #纵向监测#
10