Science Advances:在体内植入“细胞药物工厂”,6天清除癌细胞,今年将开展临床试验
2022-03-21 网络 网络
细胞因子(Cytokines)是一类可溶性分子信使,可响应抗原呈递细胞刺激,在体内激活和传递抗病免疫级联反应。在癌症免疫治疗中,外源性细胞因子可启动免疫系统激活以优化获得性抗肿瘤免疫反应。
细胞因子(Cytokines)是一类可溶性分子信使,可响应抗原呈递细胞刺激,在体内激活和传递抗病免疫级联反应。在癌症免疫治疗中,外源性细胞因子可启动免疫系统激活以优化获得性抗肿瘤免疫反应。
许多促炎细胞因子包括白细胞介素2(IL-2)、IL7、IL12、IL15 和干扰素-γ等等已在临床试验中显示出良好的抗肿瘤前景。尤其是IL-2,因为它在调节T细胞等免疫细胞中起着关键作用,因此在癌症免疫治疗中备受关注。
此前,FDA已经批准了两款重组IL-2通过大剂量注射来治疗黑色素瘤和肾癌,然而,血液中IL-2的半衰期仅为数分钟时间,因此需要大剂量输注才能带来显着效果。不幸的是,许多癌症患者在这种大剂量用药时会产生严重副作用,导致多器官损伤,这也阻碍了这种治疗的广泛应用。
近日,美国莱斯大学 Omid Veiseh 等人在 Science 子刊 Science Advances 发表了题为:Clinically translatable cytokine delivery platform for eradication of intraperitoneal tumors 的研究论文。
该研究开发了一种体内“细胞药物工厂”——使用基于天然材料藻酸盐的微型胶囊封装稳定高表达IL-2的工程化人视网膜色素上皮细胞(RPE),将其植入肿瘤附近,在晚期卵巢癌和结直肠癌小鼠模型中,仅6天时间就几乎清除了肿瘤。针对非人灵长类动物食蟹猴的研究也显示,这种“细胞药物工厂”具有良好的耐受性,且显着激活了细胞毒性T细胞的扩增和增殖。
这些研究结果证明了体内IL-2细胞因子工厂在临床前动物模型中的安全性和有效性,为未来的人体临床试验提供了依据。研究团队表示,最快将在今年秋天开始人体临床试验。

肿瘤免疫治疗领域的一个主要挑战是增加肿瘤炎症和抗肿瘤免疫,同时避免细胞因子和其他促炎药物的全身副作用。
白细胞介素2(IL-2)是一种细胞因子,能够帮助免疫系统用来识别和对抗疾病,也是FDA批准的癌症治疗方法。然而,血液中IL-2的半衰期仅为数分钟时间,因此需要大剂量输注才能带来显着效果。不幸的是,许多癌症患者在这种大剂量用药时会产生严重副作用,导致多器官损伤。
为了解决上述难题,研究团队使用PiggyBac转座子系统,让人视网膜色素上皮细胞(RPE)稳定高表达IL-2,然后讲这些工程化细胞封装到基于藻酸盐(从海藻中提取的天然多糖碳水化合物,是一种天然高分子材料,对人体细胞安全无毒)的微型胶囊中。之所以选择人视网膜色素上皮细胞(RPE),是因为该细胞不会致瘤、适合基因改造,而且已经在人体试验中证实了安全性。
将这些工程化细胞封装到微型胶囊后,这些细胞可继续存活,持续稳定产生IL-2,且在体内的持续时间要显着长于未封装的细胞。微型胶囊的存在,保护了这些工程化细胞免受免疫系统的识别和攻击。

但与现有的IL-2治疗方案相比,这种“细胞药物工厂”引发了更强的免疫反应,因为封装了工程化细胞的微型胶囊直接提供更高浓度的IL-2蛋白到肿瘤。而如果直接注射这一浓度的IL-2,将是剧毒的,“细胞药物工厂”的方式将高浓度只控制在肿瘤部位,其他远离肿瘤的部位浓度远低于静脉注射治疗时身体能承受的浓度。
接下来,研究团队进行了小鼠模型实验,实验结果显示,这种“细胞药物工厂”能在短短6天时间内几乎完全清除晚期卵巢癌小鼠模型和结直肠癌小鼠模型体内的肿瘤。这非常令人兴奋,也为临床试验提供了强有力的依据。针对非人灵长类动物食蟹猴的研究也显示,这种“细胞药物工厂”具有良好的耐受性,且显着激活了细胞毒性T细胞的扩增和增殖。
研究团队还表示,将这种“细胞药物工厂”放置在肿瘤旁边,以及围绕这些器官的腹膜内,可用于治疗胰腺癌、肝癌、肺癌和其他器官的癌症。如果需要不同的细胞因子来治疗特定形式的癌症,则可以在微型胶囊中装载不同的工程细胞。
该论文的通讯作者 Omid Veiseh 表示,这项研究的初衷是尽快帮助患者战胜癌症,因此选择了此前已被证明可安全用于人体的成分,而目前的一系列实验证明了这种新型疗法的安全性,预计最早在今年秋天开展人体临床试验。
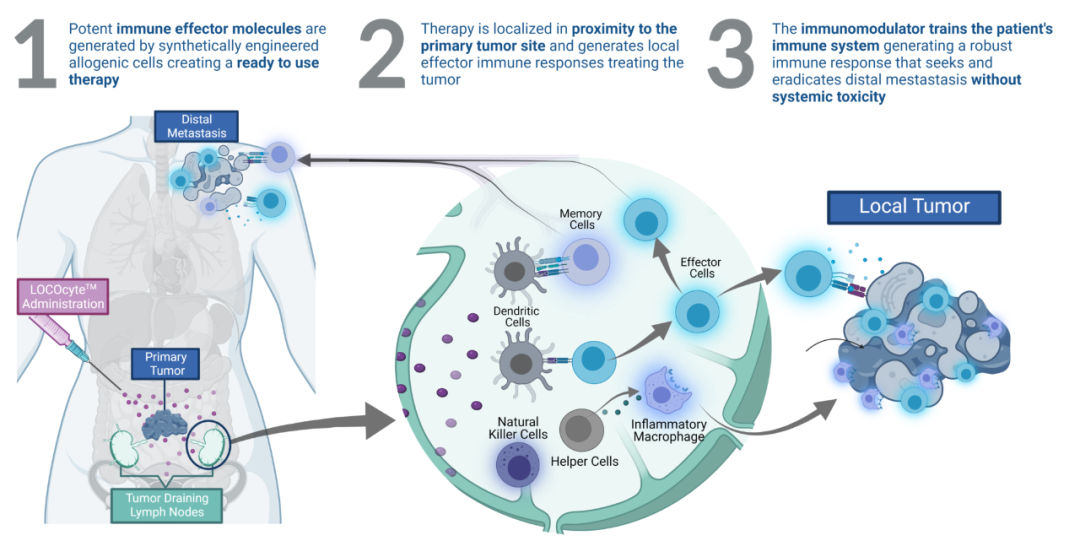
Omid Veiseh 等人基于这些研究成果创立了 Avenge Bio 公司,通过其专有的同种异体LOCOcyte平台,精确递送细胞因子或其他免疫调控分子,对免疫系统进行局部调节,进而促进全身抗肿瘤免疫反应,避免传统免疫疗法的毒性作用,从而开发处根除顽固性实体瘤的革命性疗法。
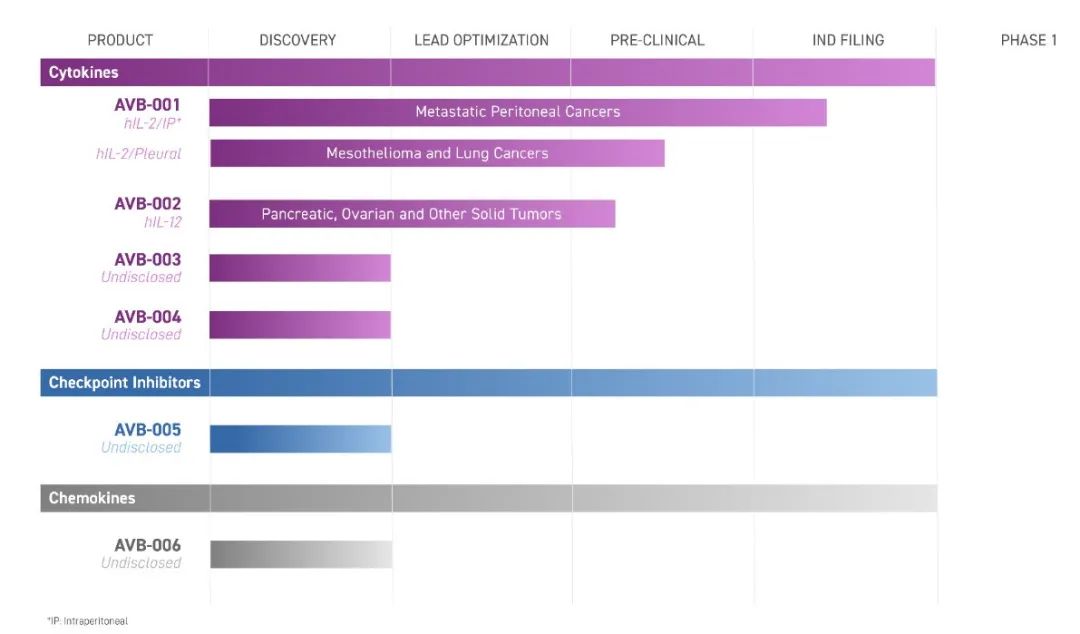
Avenge Bio 公司研发管线
原始出处:
AMANDA M. NASH, et al. Clinically translatable cytokine delivery platform for eradication of intraperitoneal tumors. SCIENCE ADVANCES, 2 Mar 2022, Vol 8, Issue 9.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#癌细胞#
0
#SCIE#
99
#植入#
72