林君/马平安《AFM》:肿瘤微环境激活的金属多酚纳米制剂通过三重调节途径用于超声增强的铁死亡治疗
2024-07-26 BioMed科技 BioMed科技 发表于上海
介绍通过配位驱动自组装制备纳米制剂用于铁死亡治疗,阐述其合成、表征、体外及体内实验效果,表明其可增强肿瘤铁死亡治疗。
铁死亡(Ferroptosis)是一种铁依赖性的、与氧化应激及脂质过氧化相关的程序性细胞死亡模式。通常认为,铁死亡的机制是以细胞内氧化还原稳态失衡和活性氧(ROS)的大量累积为特征。ROS的大量产生和积累会进一步导致脂质过氧化物(LPO)的积聚和脂质修复酶谷胱甘肽过氧化物酶4(GPX4)活性的抑制。然而,肿瘤细胞内过表达的GSH(2-10 mM)以及不够充足的H2O2(50-100 µM)通常导致抗肿瘤疗效不佳。多模式癌症疗法为肿瘤治疗带来了新的契机,在不同机制的协同作用下可以显著提高抗癌功效。多模式治疗过程中丰富的ROS生成(包括羟基自由基(·OH)和单线态氧(1O2))和GSH耗竭能够显著改善癌细胞对氧化应激的敏化作用,从而放大铁死亡疗效。然而,目前大多数多模式疗法要么依赖于多种功能纳米材料和药物分子的复杂组合,要么涉及使用体内降解性/代谢性较差的纳米药物,从而限制了其临床转化能力。因此亟待开发简便合成策略制备纳米药物,用于多种治疗模式的协同应用,以显著提高铁死亡治疗效果。
基于此,中国科学院长春应用化学研究所林君研究员、马平安研究员团队通过配位驱动自组装策略制备了由声敏剂Ce6、GSH耗竭剂萘茜和Fe3+组成的金属多酚纳米制剂(FNCP NFs),将其作为氧化还原稳态破坏剂和ROS产生器,从而实现增强的铁死亡治疗(图1)。FNCP NFs被肿瘤细胞吞噬后,可实现超声促进的肿瘤微环境特异性释放Fe2+、萘茜和Ce6。释放的Ce6作为声敏剂可通过超声激活产生1O2。Fe2+介导的Fenton反应可催化胞内H2O2产生高细胞毒性的·OH,与1O2一起诱导癌细胞凋亡。由声动力治疗(SDT)和化学动力学治疗(CDT)执行过程中产生的ROS可导致LPO的有效积累,从而引发铁死亡。此外,超声促进释放的萘茜和Fe3+/Fe2+自循环价态交替可赋予FNCP NFs持续耗竭GSH的能力,从而放大胞内氧化应激,使GPX4蛋白表达下调,进一步促进SDT/CDT诱导的LPO积累,从而提高铁死亡治疗效率。相关工作以“Tumor Microenvironment-Activatable Metal-Phenolic Nanoformulations for Ultrasound-Boosted Ferroptosis through Triple Regulatory Pathways”为题发表在期刊Advanced Functional Materials上。
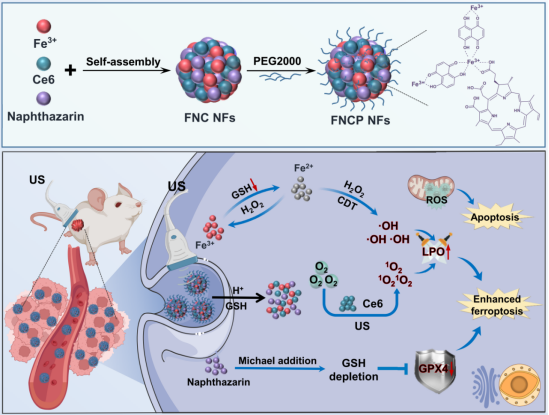
图1. 本工作机理图。
通过扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线光电子能谱技术(XPS)、X射线衍射(XRD)等表征测试证实了FNCP NFs的成功合成,并确定其为无定型结构,Fe的价态为+3价。进一步通过傅立叶变换红外吸收光谱仪(FTIR)、紫外-可见分光光度法(UV-vis)、纳米粒度分析仪等证明了FNCP NFs的成功制备(图2)。
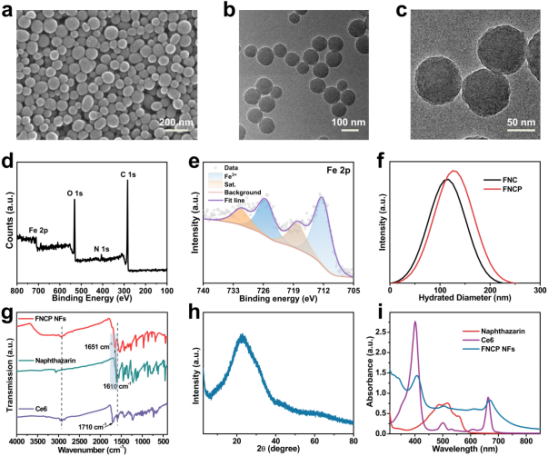
图2. FNCP NFs的合成及表征。
材料的基本表征证实了FNCP NFs的微酸性和GSH双重响应释放特性,并初步验证了FNCP NFs的GSH耗竭、ROS生成以及Fe3+还原能力(图3)。
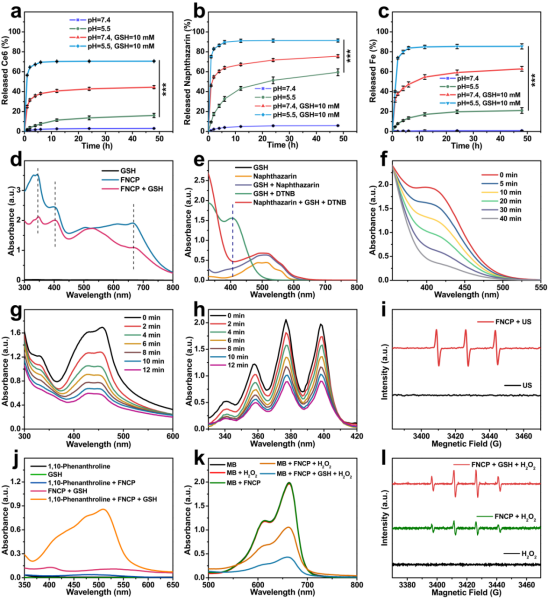
图3. FNCP NFs的基本表征。
细胞实验验证了FNCP NFs的体外抗肿瘤活性及作用机制(图4, 5)。细胞毒性实验表明FNCP NFs对小鼠乳腺癌(4T1)细胞有显著毒性,且在超声条件下表现出增强的细胞毒性。FNCP NFs在超声条件下可引起肿瘤细胞内显著的GSH耗竭、GPX4蛋白表达下调、ROS的大量生成以及LPO的积累,表明SDT、CDT和持续性的GSH耗竭可协同增强铁死亡。三种铁死亡抑制剂(GSH、DL-α-生育酚(VE)和铁抑素-1(Fer-1))能够明显减轻FNCP NFs在超声处理过程中引起的细胞损伤,表明铁死亡在FNCP NFs诱导的细胞死亡中占有重要地位,有利于进一步促进线粒体的损伤。此外,流式细胞术实验证明FNCP NFs在超声辐照下可有效诱导癌细胞发生凋亡。上述细胞实验结果表明,FNCP NFs在超声照射下不仅能够通过SDT/CDT有效产生大量ROS,作为攻击肿瘤细胞的“利剑”,还能通过超声增强释放的萘茜和Fe3+引起的双重GSH耗竭诱导胞内氧化还原环境失衡,从而破坏保卫癌细胞免于ROS攻击的“屏障”,最终导致癌细胞发生凋亡和铁死亡。
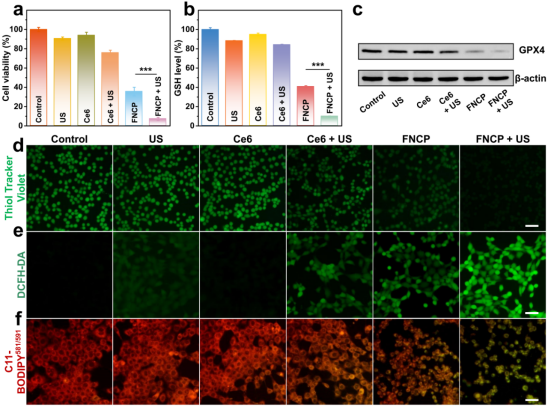
图4. 细胞毒性测试及GSH、GPX4、ROS、LPO水平表征。
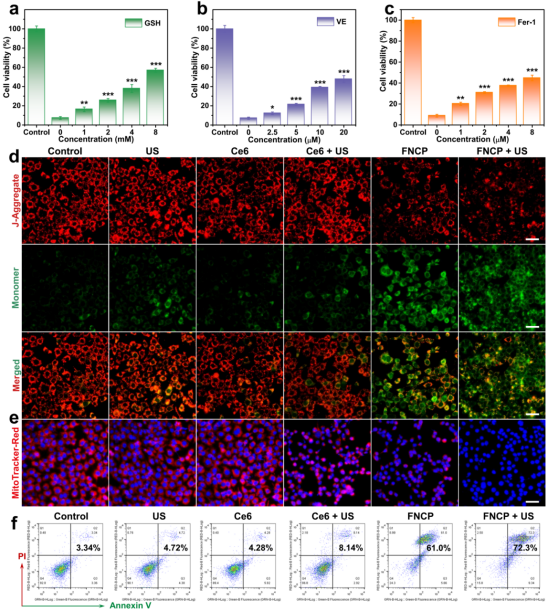
图5. 铁死亡、线粒体膜电位、凋亡水平表征。
最后团队选用BALB/c小鼠构建乳腺癌肿瘤模型来验证FNCP NFs的体内抗肿瘤能力。肿瘤体积变化、切片检测显示FNCP NFs在超声辐照下可显著抑制4T1肿瘤生长(图6)。
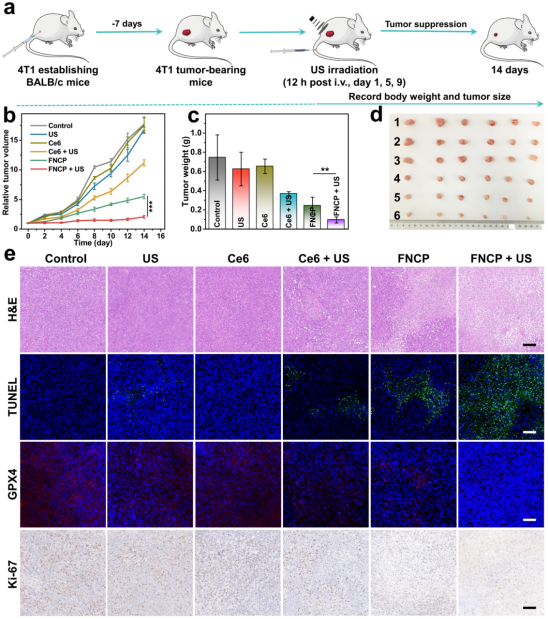
图6. 体内抗肿瘤实验。
综上,本工作通过简单的配位自组装方法构建了一种具有弱酸及GSH响应能力的Fe3+-Ce6-萘茜金属多酚纳米制剂(FNCP NFs)。在超声辐照和肿瘤微环境共同刺激下,FNCP NFs可以快速分解并释放大量Fe2+、Ce6和萘茜。Fe3+与GSH之间的还原反应及萘茜与GSH之间的迈克尔加成反应可导致GSH被大量消耗,从而引起胞内氧化还原环境失衡。同时,GSH的耗竭大幅提高了Fe2+的化学动力学治疗效果和Ce6的声动力治疗效果,从而促进GPX4的下调和LPO的累积,导致肿瘤细胞发生增强的铁死亡。得益于GSH耗竭增强的SDT及CDT协同治疗效果,体外及活体实验结果均充分证明FNCP NFs纳米粒子可以高效抑制肿瘤生长。FNCP NFs的设计和合成扩展了金属多酚网络的生物医药应用,同时为增强铁死亡疗效提供了新的方法。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202407153
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言


















#肿瘤微环境# #铁死亡#
7