JTO真实世界9万+样本:奥希替尼耐药NSCLC的基因突变谱和后续治疗结局
2024-02-04 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究描述了真实世界临床基因组学数据库中奥希替尼治疗后出现获得性 ssEGFRm 和靶内和脱靶耐药的EGFR 突变 NSCLC 的基因图谱,并描述了真实世界奥希替尼后治疗选择和后续患者结局。
随着奥希替尼作为EGFR突变NSCLC标准治疗,需要了解和克服耐药机制。本研究探索了具有EGFR C797S和其他靶内和脱靶耐药机制的NSCLC的基因组学和真实世界治疗情况。查询了 93065 例 NSCLC 患者组织或血液样本的全面基因组测序(CGP)结果,分析奥希替尼 EGFR 第二位点耐药突变(ssEGFRms;C797、L718、G724、G796、L792)。查询了真实世界电子病历来源的去身份信息临床基因组学数据库,包括来自美国约 280 家癌症诊所的接受 CGP 的 NSCLC 患者,以评估奥希替尼后耐药和临床治疗结局。在 239/8845 例(2.7%)EGFR 驱动突变(L858R 或外显子 19 缺失)NSCLC 中发现了 ssEGFRm,最常见的是 C797(71%)、L718(15%)和 G724(9.5%)。不同驱动突变间 ssEGFRms 分布不均;C797 和 G724 强烈倾向于外显子 19 缺失,L718、G796 和 L792 倾向于 L858R。19%的患者(39/205)奥希替尼后CGP检出ssEGFRm;在奥希替尼前/后配对样本中,靶内和脱靶耐药在很大程度上是相互排斥的,分别见于 24% 和 27% 的患者。在 391 例有奥希替尼后治疗数据的患者中,62% 接受了基于化疗的方案,25% 接受了靶向治疗或临床研究药物。奥希替尼进展起的真实世界中位总生存期为 11.4 个月。奥希替尼耐药谱是多种多样的,在组织和液体活检样本中观察到靶内 ssEGFRm 和脱靶耐药。奥希替尼后,患者主要接受基于化疗的方案,结局较差,耐药时 CGP 可能有助于为治疗开发和改善治疗选择提供信息。
研究背景
尽管EGFR靶向治疗的可及性提高了EGFR突变NSCLC患者的生存率和生活质量,但最终会出现获得性EGFR酪氨酸激酶抑制剂(TKI)耐药性。对于产生耐药性的患者,后续预后较差,需要新的治疗策略来改善这些患者的预后。尽管目前的治疗标准未强制要求,但进行基因检测以识别可干预的耐药机制是治疗进展时的最佳实践。在接受一、二代 EGFR 抑制剂治疗的患者中,约 50% 的获得性耐药患者存在 T790M 守门人耐药突变,导致了第三代 EGFR TKI 的开发,包括奥希替尼。将这些疗法用于一线治疗,预防 T790M 的发生,提高了 EGFR 突变肺癌患者的生存率。
奥希替尼的获得性耐药机制更具异质性,较大比例是由旁路激活或未知的耐药机制驱动的。奥希替尼的主要第二位点耐药突变是 EGFR C797S 突变,见于约 7% 的患者,在二线奥希替尼耐药血浆样本中,C797S 的发生率高达 22%-24%。与同时存在的 T790M 突变处于顺式(主要)还是反式结构,会影响对添加老一代 EGFR TKI 的反应,该疗法对反式 EGFR C797S 有活性。获得性 T790M/C797S 顺式突变肿瘤仍对FDA批准的所有 EGFR 靶向疗法耐药。
报道了其他相对少见的EGFR第二位点突变(ssEGFRms),包括铰链袋L792,三磷酸腺苷结合位点L718和P环G724突变,每种突变都会干扰奥希替尼结合,但发生率不确定。这些突变的存在对奥希替尼后治疗有意义,有些可能对老一代TKIs敏感。奥希替尼靶内耐药推动了对获得性ssEGFRm有活性的第四代EGFR抑制剂的临床前和早期临床开发。据报道,约30%的奥希替尼一线治疗患者和28%的二线治疗患者出现脱靶耐药。进一步了解在EGFR突变的NSCLC中观察到的第二位点突变谱,包括脱靶耐药机制,以及与潜在驱动突变和T790M突变的相应关系,可以为该领域的临床管理和治疗开发提供信息。本研究描述了真实世界(RW)临床基因组学数据库(CGDB)中奥希替尼治疗后出现获得性 ssEGFRm 和靶内和脱靶耐药的EGFR 突变 NSCLC 的基因图谱,并描述了真实世界奥希替尼后治疗选择和后续患者结局。
研究结果
患者队列识别
查询了 Foundation Medicine Inc.(FMI)基因组数据库中 93065 例患者组织或液体样本的全面基因组测序(CGP)结果。8845 个样本携带 EGFR L858R 或外显子 19 缺失(ex19del)突变。其中,239 个 2015 年 1 月至 2021 年 12 月期间检测的样本存在 ssEGFRm,位于 C797、L792、L718 或 G724 残基,所有这些都被确定为奥希替尼获得性耐药的驱动因素,提示先前使用过奥希替尼。该队列的临床特征见表1。

表1
次要患者队列来自真实世界临床基因组学数据库CGDB。这个带注释、去身份信息的数据库提供了进一步的治疗状态和临床结局信息,包括 1348 例具有 EGFR L858R 或 ex19del 突变的 NSCLC 患者,其中 1003 例接受了奥希替尼治疗。在这 1003 例接受奥希替尼治疗的患者中,205 例对奥希替尼治疗后采集的活检样本进行了 CGP,391 例患者有后续治疗信息,其中 78 例在奥希替尼后治疗开始前进行了 CGP。队列选择如图1所示。在391例有奥希替尼后治疗信息的患者中,78%在社区接受治疗,18%东部肿瘤协作组体能状态评分(ECOG PS)为2或更高,50%在奥希替尼后接受三线或以上全身治疗。

图1
ssEGFRm谱
查询FMI基因组数据库,看是否存在推定的奥希替尼耐药ssEGFRm,在239/8845个具有经典EGFR驱动突变(外显子19缺失或L858R)的样本(2.7%)中观察到。无法了解治疗史,这可能包括来自所有治疗阶段的样本,包括使用第三代 EGFR TKI 之前,并不代表奥希替尼耐药时的 ssEGFRm 发生率。在 239 个样本检出的 275 个 ssEGFRms 中,最常见的(71%)发生在 C797,几乎所有都导致 EGFR C797S,少数为 C797G 或 C797N。其次是L718(15%),包括L718Q/V/M。G724S(9.5%)、G796 S/R/C(2.5%)和L792H/F(2.2%)突变较少见。此外,54%的样本具有T790M突变,符合一二代EGFR TKI用药史(图2A)。2018年FDA批准奥希替尼用于一线治疗后实践模式发生了变化,与此一致,在C797S突变样本中检测到T790M的频率随着时间的推移而下降,从2016年和2017年的93%下降到2021年的34%。几乎所有样本都检出T790M/C797S 顺式突变,反式突变仅见于 5.5% 的样本。此外,其他ssEGFRms见于6.1%的(528/8606)具有经典EGFR驱动突变但没有推定的奥希替尼耐药突变的样本,以及5.9%的(14/239)具有经典EGFR驱动突变和推定的奥希替尼耐药突变的样本。此外,在13/2012个具有罕见 EGFR 驱动突变但外显子 19 缺失或 L858R 阴性样本中观察到推定的奥希替尼耐药 ssEGFRm。
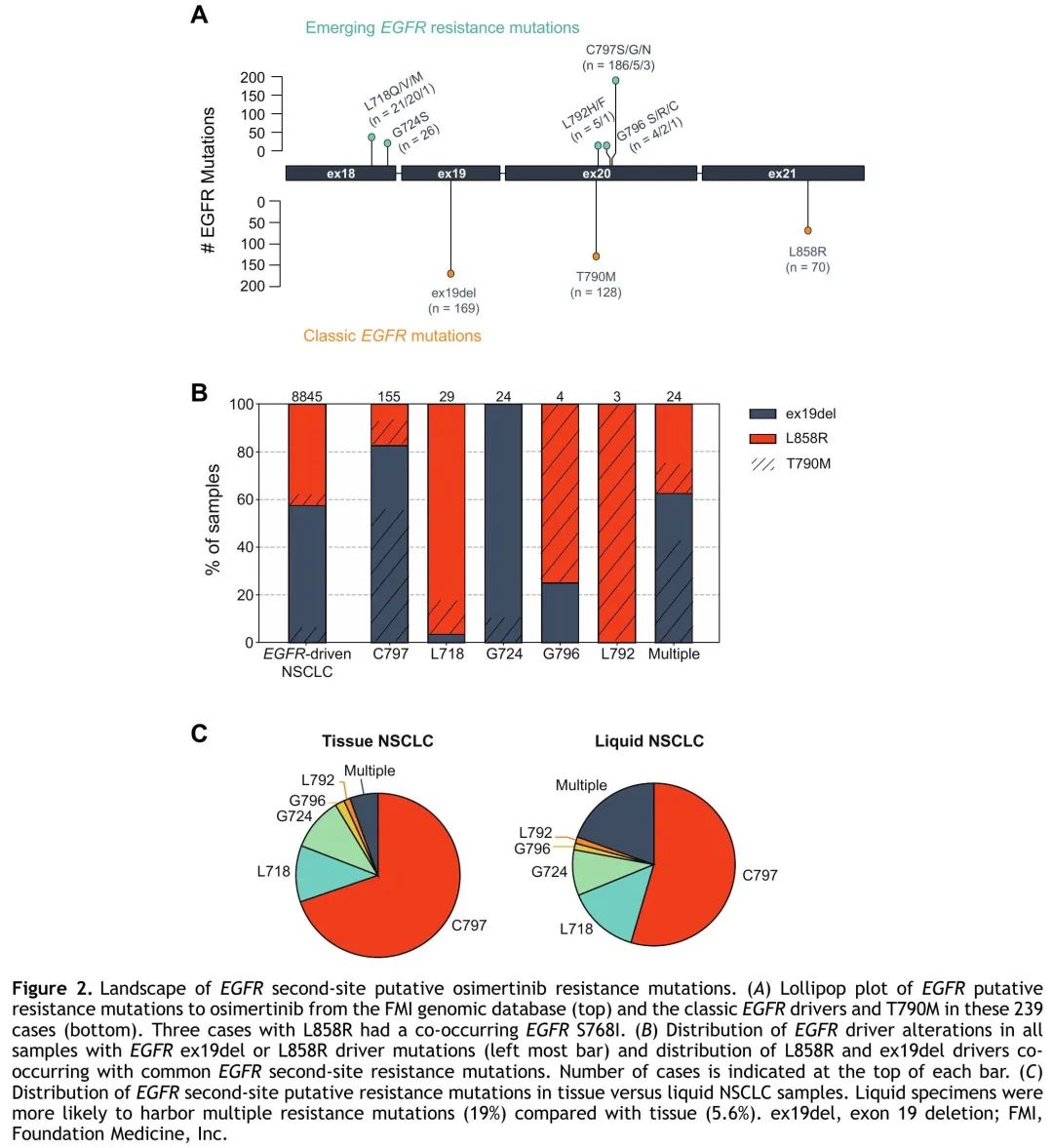
图2
原发性EGFR L858R与ex19del驱动突变肿瘤的ssEGFRm分布存在差异。具有获得性 C797X 突变的患者更有可能携带 ex19del(128 [83%] ex19del vs 27 [17%] L858R,p < 0.001)。在具有G724X突变(只发生于ex19del患者)和多个ssEGFRms的患者中发现了类似的趋势。相反,L718X 突变更常发生于 L858R 患者(28 [97%] L858R vs 1 [3.4%] ex19del,p < 0.001),G796X 和 L792X 也是如此,尽管数量较少。C797X突变患者存在T790M的比例也显著高于L718(66% vs 14%,p < 0.001)或G724(66% vs 13%,p < 0.001)突变患者(图2B)。williamhill asia 探索了 ssEGFRm 样本更广泛的基因图谱,TP53、CDKN2A 和 CDKN2B 是最常见的共突变基因,分别见于 62%、29% 和 26% 的 ssEGFRm 样本。比较有和没有ssEGFRm的EGFR驱动突变样本之间的基因变异频率,CTNNB1是唯一在ssEGFRm样本中显著富集的基因(17% vs 7.8%,p = 0.003)。
与同时检测多个不同的肿瘤克隆一致,液体活检的 ssEGFRm 谱相比组织 CGP 更多样化,单 C797X 突变的患者比例较低(55% vs 70%,p = 0.03),多个 ssEGFRms 的患者比例较高(19% vs 5.6%,p = 0.002)(图 2C)。
具有多个ssEGFRm的样本的基因图谱
在 24/239 个(10%)具有推定的奥希替尼 EGFR 耐药突变的样本中发现了多个 ssEGFRms(图 3A)。在这 24 个样本中,耐药性主要分为三类:多个独立进化的 C797S 突变(n = 10,由不同的核苷酸变改变定义,每个都导致 C797S),C797S 加另一个 ssEGFRm(n = 9),以及没有 C797S 但有 L718Q/L718V 反式突变(n = 5)。在组织和血浆样本中都鉴定出所有三类。在 9 个 C797S 加另一个 ssEGFRm 的样本中,共突变包括 L792H(n = 2,反式)、G796R(n = 2,反式)、L718Q(n = 2,无法评估与呈 C797S 顺式/反式)、C797G(n = 2,反式)、G724S(n = 2,无法评估顺式/反式),以及G796S、L718V、L792F 和 C797N 各1例(均与 C797S 呈反式)。

图3
在21%的(49/239例)患者中,奥希替尼耐药ssEGFRms与其他获得性旁路驱动突变同时发生。不同ssEGFRms之间的旁路突变率无显著差异(p = 0.43)(图3B)。比较组织与液体CGP,16%与30%同时存在ssEGFRm和旁路突变(p = 0.02)。最常见的旁路突变为PIK3CA突变(53%)、KRAS突变(14%)、ERBB2扩增或外显子16缺失(12%)、BRAF V600E或重排(12%)、RET融合(10%)、MET扩增(6.1%)、ALK重排(4.1%)和NTRK1融合(2.0%);12/49 个样本(24%)有多个旁路突变。
接下来,在 132/239 个符合质量控制阈值的样本中,确定变异克隆分数,评估奥希替尼耐药 ssEGFRm 的克隆性。EGFR驱动突变的中位克隆分数大于99%,而ssEGFRm仅为36%,没有和有同时存在的脱靶耐药突变的ssEGFRm的克隆分数为41%和25%(p = 0.02)。
RW队列奥希替尼后基因组学
在CGDB中,对于205例在奥希替尼开始后≥30天收集可及CGP样本的患者,在39例患者(19%)中发现了推定的耐药ssEGFRm,包括30/39例患者(77%)至少一种核苷酸改变导致C797S。在奥希替尼后活检样本中(n = 205),单ssEGFRm见于11%的(12/113)接受奥希替尼一线治疗和20%的(18/92)接受奥希替尼二线或以上(2L+)治疗的患者样本(p = 0.08)。推定脱靶耐药见于 27%的(31/113)一线和 24%(22/92)2L+ 患者(p = 0.63)(图 4A)。在这 205 例患者中,66 例对额外的奥希替尼前活检样本进行了检测,可以与奥希替尼后活检样本进行配对分析。在这些配对样本中,16 例患者(24%)检测到一种或以上靶内耐药 ssEGFRms。18 例患者(27%)检测到推定的脱靶获得性耐药机制,包括NCCN基因、RAS、PIK3CA 或 FGFR 驱动突变,只有 2 例(12.5% 的 ssEGFRm 突变患者)同时检测到靶内和脱靶耐药。在另外 15 例(23%)没有推定耐药突变的患者中,检测到其他可能导致奥希替尼耐药的获得性突变,包括 EGFR 扩增、MTAP 缺失、细胞周期突变、其他 PI3K 通路突变和 MYC/MYCL 扩增。值得注意的是,16%的(7/44)奥希替尼后组织活检样本和 45%的(10/22)奥希替尼后液体活检样本未检测到获得性突变,获得性 MET 扩增(n = 4)、EGFR 扩增(n = 6)和 MTAP 缺失(n = 2)仅见于组织样本。
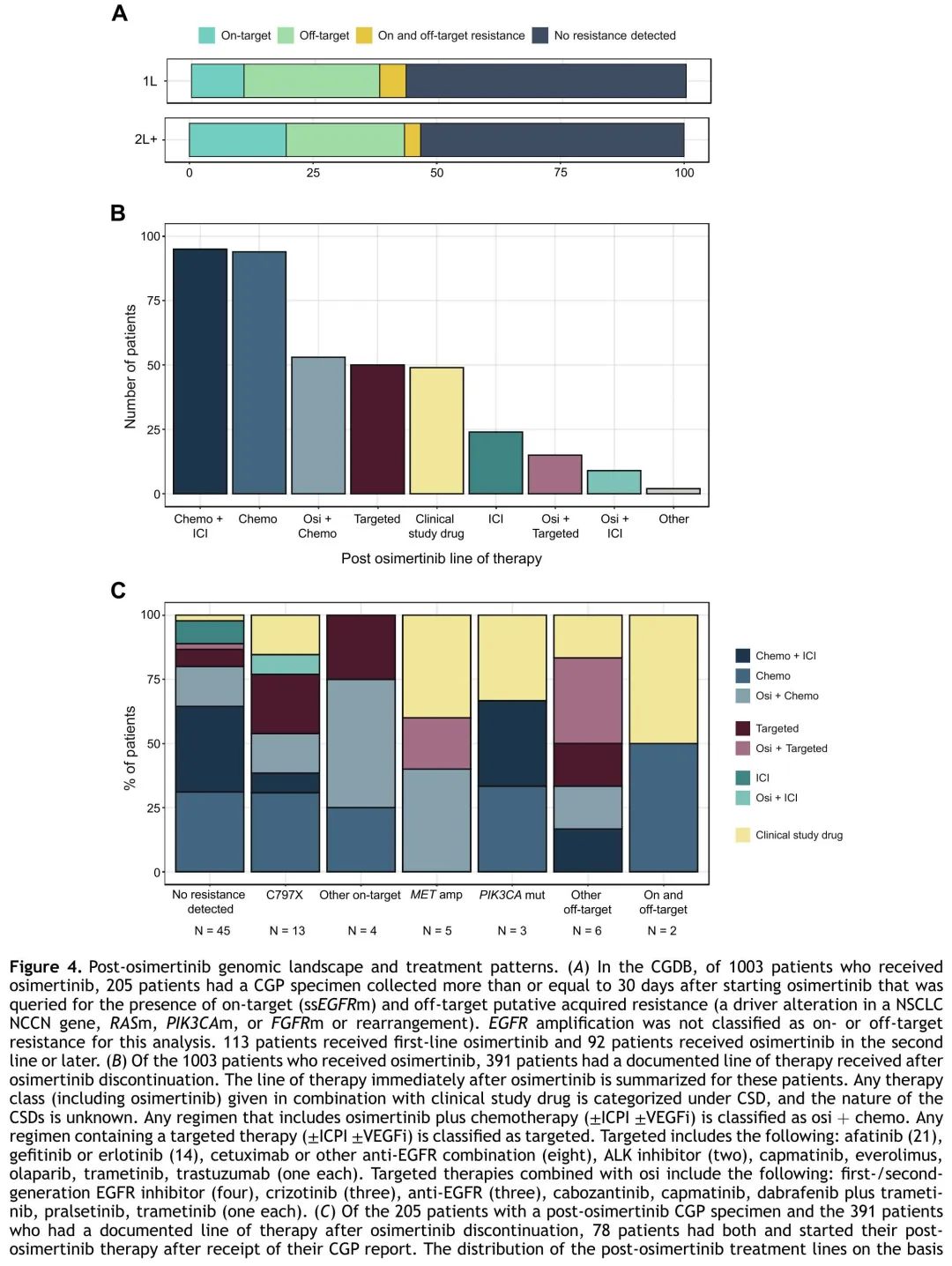

图4
奥希替尼后RW治疗模式及耐药时CGP对决策的影响
在 CGDB 有奥希替尼后治疗信息的 391 例患者中,最常见的奥希替尼后治疗是基于化疗的方案(62%),包括单独化疗(24%)、化疗联合免疫检查点抑制剂(ICI)(24%)或化疗联合奥希替尼(14%)。其次是临床试验入组或后续靶向治疗(图4B)。使用含ICI的方案(单独或与奥希替尼联用)与社区而非学术环境的治疗相关(97% vs 33%,p < 0.001),而临床试验入组倾向于在学术环境中治疗(57% vs 43%,p = 0.41)。
78例患者有奥希替尼治疗之后的后续治疗信息且在后续治疗开始前进行了CGP,对于这些患者,评估了检测结果对真实世界后续下一线治疗选择的影响。基于化疗的方案仍然是最常见的后续策略,无论潜在的基因组特征如何,除了检出可靶向继发性驱动变异(如RET 融合、MET 扩增)的患者,靶向治疗或临床试验入组是这些患者最常见的治疗策略。对于未发现可干预的耐药机制的患者,基于化疗的方案最常见(图 4C)。
最后,评估了奥希替尼后治疗患者的真实世界结局。在CGDB 1003例接受奥希替尼治疗的EGFR突变NSCLC患者中,571例患者在奥希替尼后治疗后出现进展,从奥希替尼治疗进展起的中位真实世界总生存期(rwOS)为11.4个月(图5A)。在 391 例有奥希替尼后治疗信息的患者中,302 例在一线或二线接受奥希替尼治疗,评估了其奥希替尼后治疗的临床结局。在该队列中,rwOS 范围为 5.4 至 17 个月。在接受基于化疗的方案的患者中,奥希替尼后 rwOS 相似,为 8.2 至 9.6 个月。接受靶向治疗(rwOS 17 mo)或接受临床试验治疗(rwOS 11 mo)的患者生存结局最佳。相反,接受 ICI 单药治疗的患者更可能具有较差的 PS(35% ECOG 2+)和较差的 rwOS (5.4 mo)(图 5B)。在 33/78 例奥希替尼后 CGP 发现靶内或脱靶耐药突变的患者中,评估了真实世界无进展生存期。该队列评估奥希替尼后基因组状态与患者结局的相关性效力不足。

图5
讨 论
本研究使用大型基因组数据库(ssEGFRm作为奥希替尼用药史的替代物)和CGDB(有奥希替尼治疗和结局信息)来描述奥希替尼后耐药和临床情况。williamhill asia 评估了已知最大的ssEGFRm队列,包括239例患者至少有一个推定的奥希替尼耐药突变,位于C797、L792、L718或G724。该基因组数据集证实了先前的几项观察结果,包括 C797S 的高比例和 G724 对 EGFR ex19del 驱动疾病的特异性,扩展了对奥希替尼后第二位点突变异质性的了解。williamhill asia 发现,在 2015 年至 2021 年间 239 个进行 CGP 的样本中,T790M 存在于 54% 的样本,在检出的 275 个 ssEGFRms 中,L718X 突变(15%)和 G724S 突变(9.5%)是仅次于 C797S(71%)的常见 ssEGFRms。预计 L718 突变通过空间位阻损害奥希替尼和 C797S 之间的共价键,尽管 G724S 似乎通过构象变化抑制奥希替尼和三磷酸腺苷结合口袋之间相互作用的早期阶段。该数据集还强调了肿瘤异质性,不仅在于靶内和脱靶耐药之间,还在于靶内耐药机制内部。在williamhill asia 的基因组数据库中,10%的具有ssEGFRm的EGFR驱动NSCLC具有多个ssEGFRm,并且在几乎所有病例中,这些耐药突变都处于反式结构,提示不同的肿瘤克隆起源。这种效应在液体样本中最为明显,这符合液体活检能够捕获来自不同疾病部位的总体DNA。多个处于反式结构的不同核苷酸改变均导致 C797S 突变,提示肿瘤克隆之间趋同进化为一种共同的耐药机制。在具有多个 C797S 克隆的 15 个样本中,一个还具有 EGFR L792H 突变和 PIK3CA E545K 突变,另一个同时存在 BRAF 内含子 8 重排。然而,应该注意的是,由于该队列缺乏临床注释,这些患者可能接受了奥希替尼以外的其他治疗,这可能导致更复杂的耐药情况。
ssEGFRm的发生,特别是与T790M处于顺式结构时,带来了治疗挑战。正在开发新型EGFR抑制剂,包括对C797S或C797S/T790M有活性的第四代抑制剂,使得识别这些突变与患者治疗更相关。如果这些药物在经治患者群体中有效,将提出一个问题,即一线使用以预防获得性靶内耐药的好处,以及哪些患者群体最有可能获益于这一策略。EGFR 驱动突变间获得性 C797S 突变率的差异(其中 ex19dels 富集)提出了一个问题,即先发制人的 C797S 靶向疗法(如果存在)是否对 ex19del 阳性疾病的益处最大,尽管这需要在前瞻性数据集中进行验证。
CGDB为整合有关临床管理和生存结局的信息提供了一个强大的工具,有助于了解不同实践环境中奥希替尼耐药NSCLC的真实世界实践。该临床注释数据集还使williamhill asia 能够评估奥希替尼治疗患者的耐药模式,其中一些患者在奥希替尼治疗前后都进行了CGP。在CGDB队列中观察到多样的ssEGFRm模式,以及已知和潜在新型脱靶耐药机制。在奥希替尼进展时收集的CGP活检样本中,靶内和脱靶耐药在很大程度上是相互排斥的。与最近的报告一致,williamhill asia 观察到,一线奥希替尼后脱靶耐药相比靶内耐药富集,尽管williamhill asia 承认脱靶和靶内耐药的定义的差异可能导致研究之间的差异。在williamhill asia 的基因组分析中,21%的ssEGFRm样本同时存在推定脱靶耐药机制,可能或可能不是从奥希替尼使用中直接获得的,而在williamhill asia 的 CGDB 奥希替尼前后配对活检样本分析中(n = 66),只有 2 例同时存在靶内和脱靶获得性推定耐药突变,占 ssEGFRm 病例的 12.5% 或整个队列的 3%。在CGDB中,4/44例奥希替尼后组织活检样本观察到获得性MET扩增,但在液体活检样本中未观察到。同样,仅在组织样本中观察到获得性EGFR扩增和MTAP缺失,这可能是由于液体样本肿瘤分数不足时难以检测基因拷贝变化。
本研究中,奥希替尼后 OS 为 11.4 个月,远低于 FLAURA 研究中一线奥希替尼 38.6 个月的中位 OS,或 AURA3 研究二线奥希替尼 27 个月的 OS,可能反映了真实世界患者群体中更大的虚弱和合并症、疾病表现的敏锐度或奥希替尼后管理的差异。对奥希替尼后结局的分析虽然纳入的患者数量较少,但提示识别可干预的获得性耐药突变的潜在生存获益,以及个体化基因检测指导的下一线治疗策略的潜在益处,尽管这受到许多混杂因素的限制。包括在三级医疗中心接受治疗的可能性较高,临床试验资格标准要求良好的体能状态和可控的中枢神经系统疾病,以及临床稳定性能够在开始下一线治疗之前等待NGS检测。即使存在这些潜在的混杂因素,后续接受靶向治疗的患者 ECOG PS≥2 的比例第二高,rwOS 仍较长,提示对识别的耐药突变采取行动有益。前瞻性多臂 ORCHARD 研究正在评估奥希替尼后生物标志物指导的治疗,有助于更明确地了解这种治疗策略对患者结局的影响。
该数据集也符合目前EGFR突变患者ICI治疗反应率低。接受 ICI 单药治疗的患者也最有可能体能状态不佳(35% ECOG 2+),并且在四线或以上接受奥希替尼后 ICI 治疗(33%),提示这可能是在有吸引力的替代方案有限的情况下进行的后线尝试。这符合当前EGFR患者群体ICI使用实践,可能是后续生存结局不佳的一个原因。
在肿瘤界,一线NGS检测的比例低于最佳威廉亚洲博彩公司 指导的治疗,这强调了在潜在更复杂的获得性治疗耐药情况下进行重复检测的挑战。一线进行 CGP 并根据检测结果开始合适的个体化治疗与生存改善相关。本研究数据表明,获得性耐药时进行基因检测可以识别可干预的耐药突变,并可能为下一线治疗选择提供信息,包括第四代 EGFR 抑制剂、联合策略和新型临床试验设计,具有改善结局的潜力。
几个局限可能会影响对本研究数据的解释。首先,FMI基因组数据库的临床治疗和结局数据有限,这是来自临床检测平台的队列研究的常见局限性,因此对先前EGFR靶向治疗史的了解部分来自样本中观察到的耐药特征。对CGDB样本的分析旨在解决这一局限性。此外,奥希替尼后生存分析是回顾性的,并且样本量小,如果对大型前瞻性患者群体进行评估,所描述的趋势可能不同。然而,观察到的研究结果与基于目前对EGFR突变NSCLC治疗疗效的理解所预测的结果一致,为三级学术环境以外这一治疗阶段提供了难得的见解。此外,在液体活检样本中,由于血液中循环肿瘤 DNA 脱落不足,耐药机制的发现可能被低估,并且液体活检无法推断组织学分化。最后,本分析中纳入的大多数患者预计既往接受过老一代 EGFR 抑制剂治疗,在某些患者中,奥希替尼治疗之前可能已经接受过多线靶向和非靶向治疗,这可能会影响奥希替尼获得性耐药突变的频谱。
潜在的奥希替尼后治疗策略继续扩大,包括耐药靶向抑制剂、下一代EGFR抑制剂、双特异性抗体疗法和抗体-药物偶联物在内的新型疗法继续具有临床活性,开始在前瞻性研究中被评估用于早期治疗阶段。继续了解奥希替尼治疗进展患者的耐药情况和潜在生物标志物驱动的亚组对后续疗法和联合疗法的反应将促进最佳的下一线治疗策略,为EGFR突变肺癌患者整个治疗过程中的个体化治疗策略提供希望。
参考文献:
Rotow JK, Lee JK, Madison RW, Oxnard GR, Jänne PA, Schrock AB. Real-World Genomic Profile of EGFR Second-Site Mutations and Other Osimertinib Resistance Mechanisms and Clinical Landscape of NSCLC Post-Osimertinib. J Thorac Oncol. 2023 Oct 6:S1556-0864(23)02263-3. doi: 10.1016/j.jtho.2023.09.1453. Epub ahead of print. PMID: 37806383.

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#NSCLC# #EGFR# #奥希替尼#
61