2023年度FDA审批71种创新药物上市
2024-01-01 MedSci原创 MedSci原创 发表于威斯康星
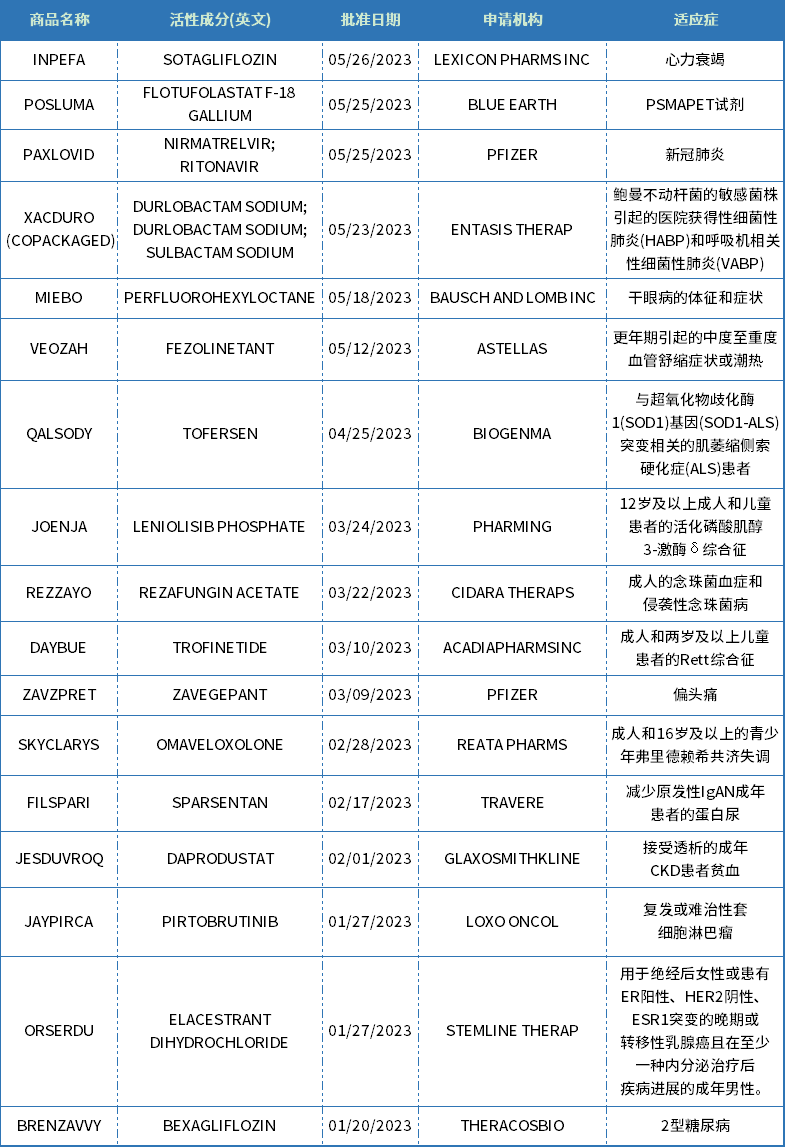
2023年FDA共批准上市55款新药、14种疫苗和基因治疗新药。
2023年FDA共批准上市55款新药、16种疫苗和基因治疗新药。在近年年创新高。
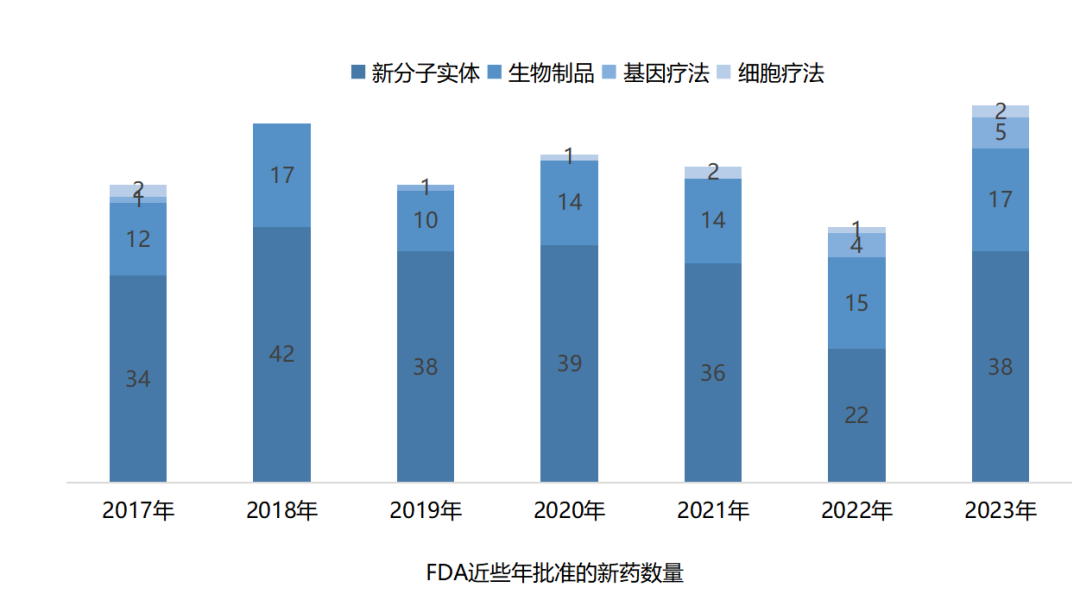
新分子实体中,小分子居多,占比约达55%(30款),其余包括多肽与核酸类;生物制品中,71%为抗体类(8款单抗、4款双抗),其余为酶替代疗法。
生物大分子药物共23款(占42%):单抗药物12款,含5款双特异性单抗,其中2款CD3/CD20双特异性单抗Epcoritamab和Glofitamab、CD3/GPRC5D双特异性抗体Talvey、CD3/BCMA双特异性抗体Elrexfio、IL-17A/IL-17F双特异性抗体Bimzelx;靶向β淀粉样蛋白单抗Lecanemab、2款PD-1抑制剂单抗Retifanlimab和Loqtorzi、FcRn受体抑制剂Rozanolixizumab、呼吸道合胞病毒F蛋白抑制剂Beyfortus、补体C5蛋白抑制剂Veopoz、IL-23p19抑制剂 Omvoh;
小核酸药物4款,2款反义核酸ASO药物Tofersen和Eplontersen、抑制补体C5蛋白的RNA核酸适配体Izervay、沉默肝细胞中乳酸脱氢酶A的siRNA药物Rivfloza;
酶替代疗法3款,α-甘露糖苷酶替代物Velmanase、α-半乳糖苷酶A替代物Pegunigalsidase和α-葡萄糖苷酶替代物Pombiliti;
多肽类药物2款,趋化因子受体4拮抗剂Aphexda和补体C5蛋白抑制剂 Zilbrysq;人生长激素类似物Somatrogon和G-CSF升白药Ryzneuta。
小分子药32款(占58%),含组合疗法3款,抑制肽聚糖生物合成酶+β-内酰胺酶抑制剂的组合抗菌Xacduro、主蛋白酶抑制剂+CYP3A4酶抑制剂的组合抗COVID-19的Paxlovid、抗凝剂+抗菌剂的组合抗肾衰导管相关血流感染的Defencath;1款靶向前列腺癌PET成像的核素Posluma以及1款植物药提取物凝胶剂Filsuve。
williamhill asia 医学整理如下:
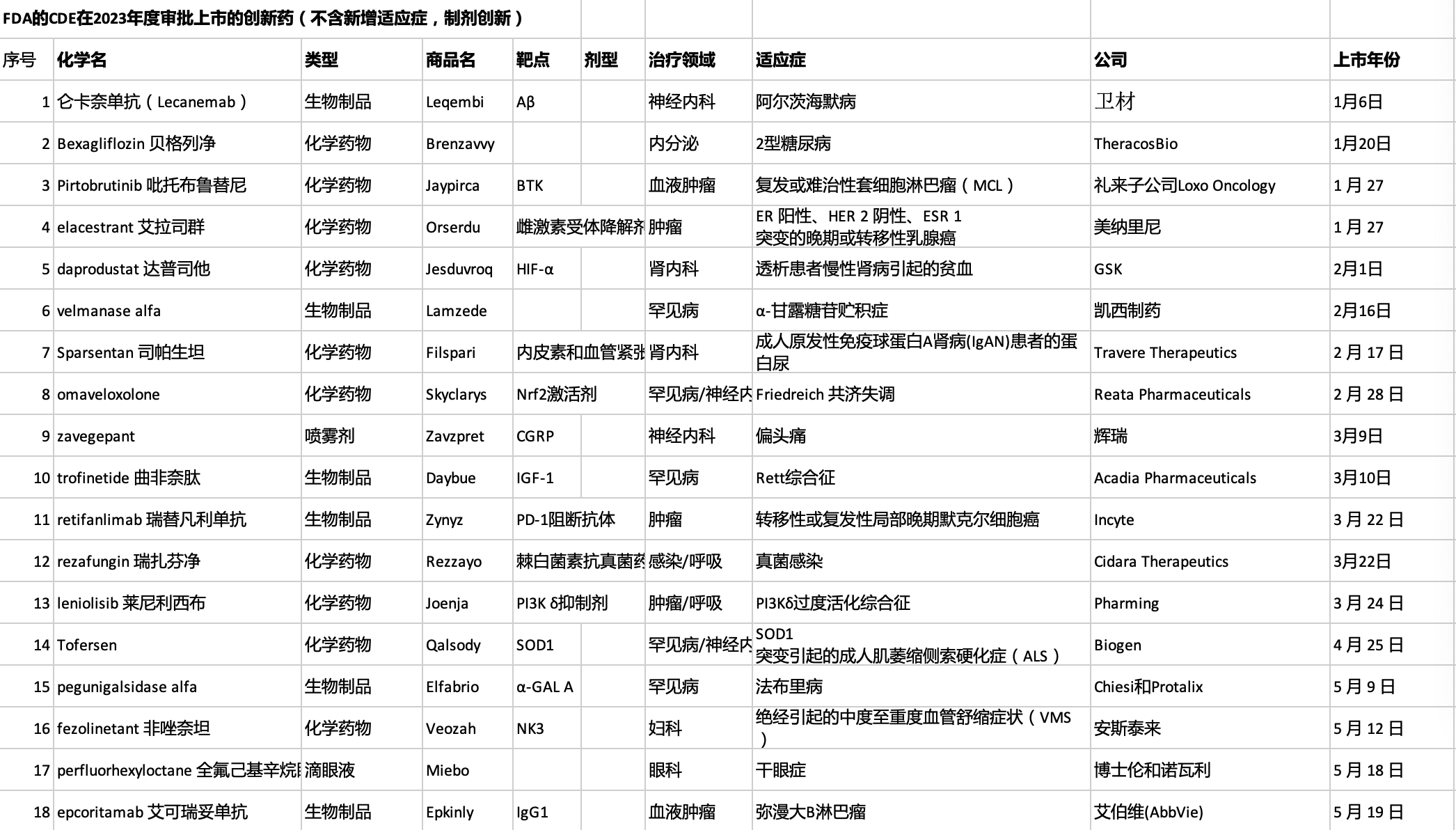

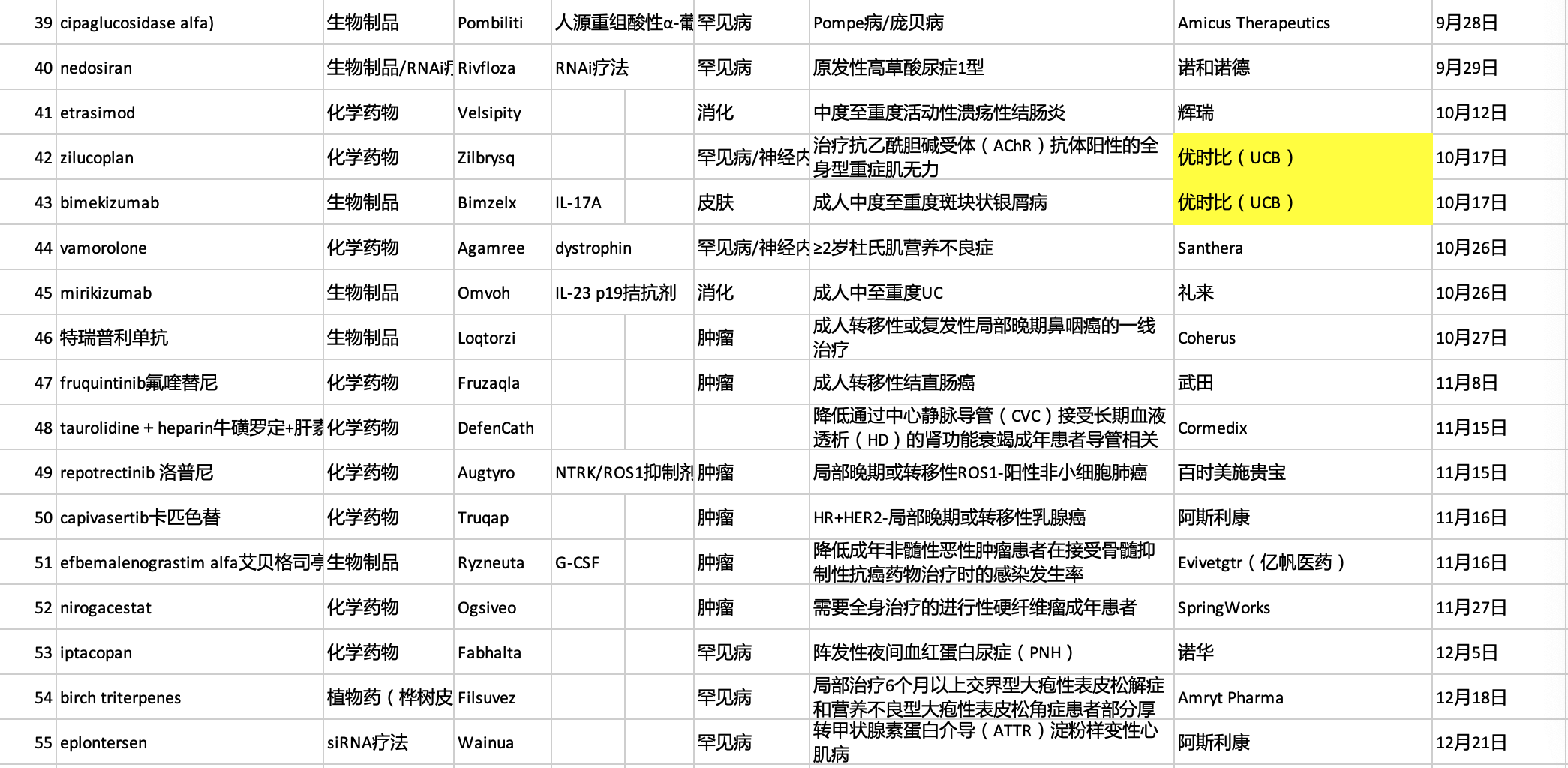
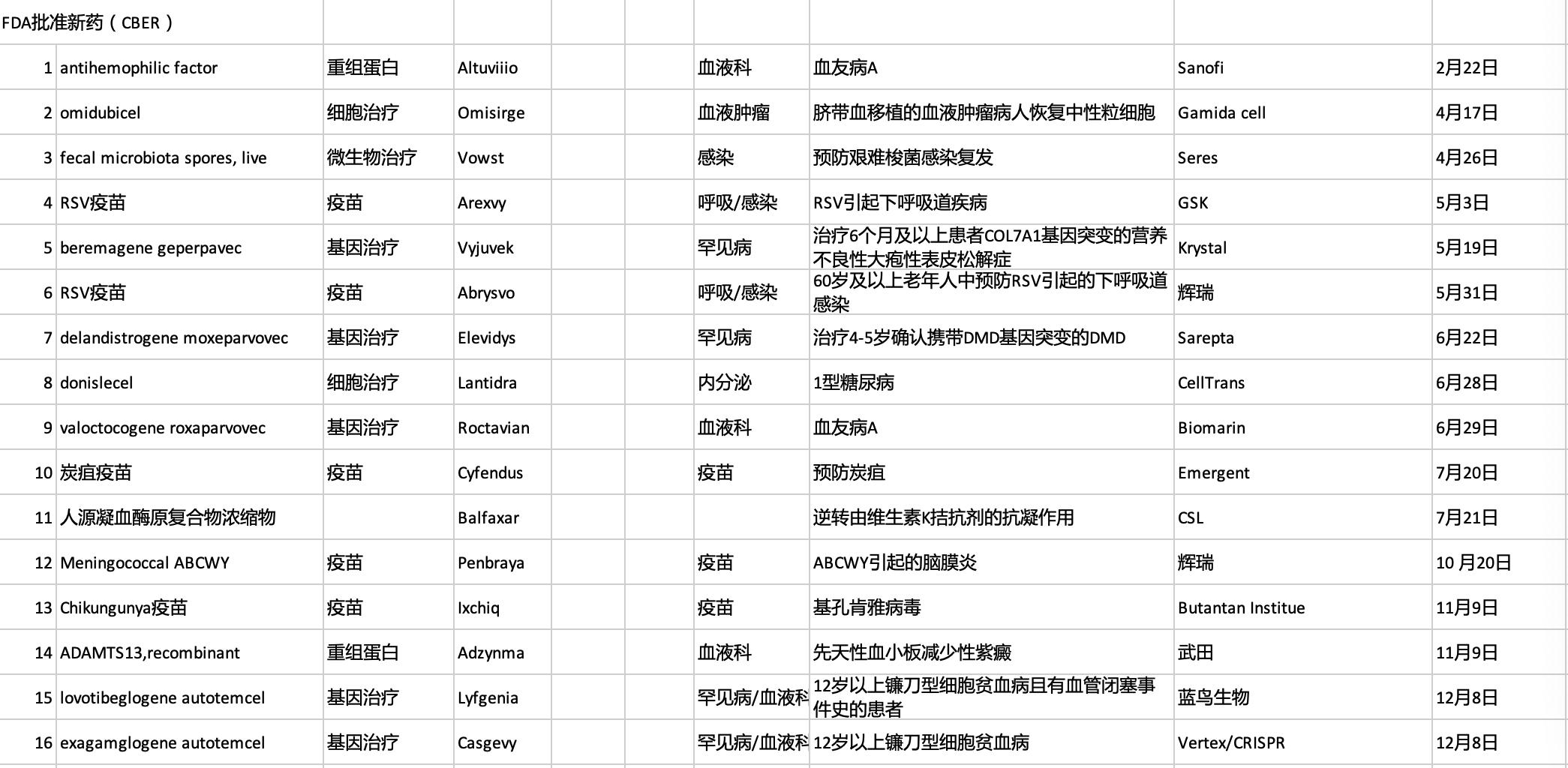
获批上市的新药适应症:
罕见病:α-甘露糖苷贮积症、法布里病、弗里德赖希共济失调、雷特综合征、绝经引起潮热、生长激素缺乏症、进行性骨化纤维发育不良、CD55缺乏性蛋白丢失性肠病、成人骨髓纤维化伴贫血、成年晚发型庞贝病、1型原发性高草酸尿症、大疱性表皮松解症
肿瘤:套细胞淋巴瘤、乳腺癌、默克尔细胞癌、弥漫性大B细胞淋巴瘤、检测前泪腺癌、急性髓系白血病、多发性骨髓瘤、鼻咽癌、转移性结直肠癌、ROS1阳性非小细胞肺癌、HR+/HER2-乳腺癌和侵袭性纤维瘤病
感染疾病:侵袭性念珠菌血症、鲍曼不动杆菌细菌性肺炎、COVID-19、呼吸道合胞体病毒感染和导管相关感染
免疫疾病:PI3Kδ过度活化综合征、严重斑秃、成人全身型重症肌无力和斑块状银屑病
神经性疾病:阿尔茨海默病、成人急性偏头痛、渐冻症、抑郁症和TTR淀粉样变性多发性神经病
肾病:CKD透析引发贫血、IgA肾病蛋白尿和阵发性睡眠性血红蛋白尿、
以片剂和注射剂剂型为主,片剂占比16/55、胶囊剂占比7/55、注射剂占比25/55,鼻喷剂1/55、口服液2/55、滴眼剂2/55和凝胶剂1/55等剂型。
涉及新药认定包括孤儿药(29/55)、First-in-class(9/55)、突破性疗法(24/55)、首轮批准、优先审批及快速通道。此外,19款药物带黑框警告上市。
相关药物介绍如下:
20年来首款FDA完全批准AD新药:Leqembi
适应症:阿尔茨海默症
1月6日,渤健/卫材的抗β淀粉样蛋白(Aβ)单抗Leqembi(lecanemab)获FDA加速批准上市,用于治疗阿尔茨海默症(AD)。7月6日,FDA同意将加速批准转为完全批准。这意味着lecanemab成为了20年来首款获得FDA完全批准的AD新疗法。
Lecanemab能够选择性结合以中和消除可溶性、有毒的Aβ聚集体(原纤维),而这些聚集体被认为有助于AD中的神经退行性过程。III期关键研究显示,lecanemab不仅能降低淀粉样蛋白斑块,患者临床痴呆症状也可显著得到改善。
首款非共价BTK抑制剂:Jaypirca
适应症:套细胞淋巴瘤
1月27日,礼来的Jaypirca(pirtobrutinib, 100mg和50mg片剂)获FDA加速批准上市,用于既往接受过至少二线系统治疗的复发或难治性套细胞淋巴瘤(MCL)成人患者,包括布鲁顿酪氨酸激酶(BTK)抑制剂,这是FDA批准的首个也是唯一一款非共价(可逆)BTK抑制剂。
Jaypirca既能抑制野生型也能抑制C481S突变型BTK,可以在既往使用共价BTK抑制剂(包括伊布替尼、阿卡替尼或泽布替尼)治疗的MCL患者中重建BTK抑制,并延长靶向BTK途径的益处。
首款治疗FA的药物:Skyclarys
适应症:弗立特里希氏共济失调
2月28日,FDA批准Reata Pharmaceuticals的Skyclarys(omaveloxolone)上市,用于治疗16岁及以上青少年和成年人弗里德赖希共济失调症(Friedreich’s Ataxia,FA)。这是美国首个也是唯一获批治疗FA的药物。今年7月底,渤健以每股172.5美元的价格现金收购Reata,交易总额约为73亿美元。
Omaveloxolone是一款每日口服一次的Nrf2激动剂。Nrf2是一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎信号来促进炎症消退。
首款治疗ALS的基因靶向疗法:Qalsody
适应症:肌萎缩侧索硬化
4月25日,渤健/Ionis联合推出的反义寡核苷酸疗法Qalsody(tofersen)获FDA加速批准上市,用于治疗超氧化物歧化酶1(SOD1)突变所致的肌萎缩侧索硬化(ALS)患者。这是首款针对ALS的基因靶向疗法。
Tofersen是一种用于治疗SOD1-ALS的反义寡核苷酸药物,可与编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。
全球首款口服粪便微生物疗法:Vowst
适应症:预防复发性艰难梭菌感染
全球首款RSV疫苗:Arexvy
适应症:预防60岁及以上人群RSV感染导致的下呼吸道疾病
首款A型血友病基因疗法:Roctavian
适应症:A型血友病
全球首款GPRC5D/CD3双抗:Talvey
适应症:多发性骨髓瘤
首款口服单药PNH疗法:Fabhalta
适应症:阵发性睡眠性血红蛋白尿症
首款CRISPR基因编辑:Casgevy
适应症:镰状细胞病
12月8日,Vertex与CRISPR联合开发的CRISPR/Cas9基因编辑疗法Casgevy获FDA批准上市,用于12岁及以上输血依赖性地中海贫血患者或伴有复发性血管闭塞危象的镰状细胞病患者,这些患者没有人类白细胞抗原匹配的造血干细胞供体。这是全球首款获批上市的CRISPR基因编辑药物。
就在同日,FDA还批准了蓝鸟生物的一款基因疗法Lyfgenia上市,同样用于12岁及以上伴有复发性血管闭塞危象的镰状细胞病患者的治疗。这是蓝鸟生物推出的第3款基因疗法,据悉该产品定价为310万美元,此前治疗肾上腺脑白质营养不良的eli-cel和治疗β-地中海贫血的beti-cel定价分别为300万美元和280万美元。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#FDA# #创新药物#
65