CAR-T细胞疗法Yescarta获得FDA批准用于早期治疗淋巴瘤
2022-04-04 Allan MedSci原创
Yescarta 组患者的 ORR 为 83%,其中 CR 率为 65%。
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(NHL)中最常见的亚型,占西方成人NHL患者的30%~40%,占中国NHL患者的37.94%。DLBCL在病理及临床方面呈高度异质性,患者对治疗的反应及预后也相差很大。
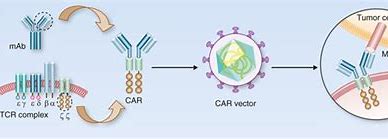
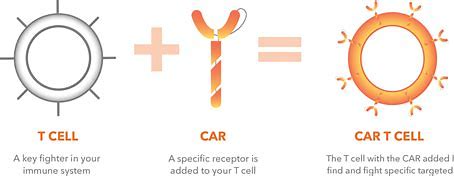
吉利德科学公司近日宣布,FDA 扩大了 Yescarta(axicabtagene ciloleucel)的批准范围,包括对一线化学免疫治疗无效或在一线化学免疫治疗后 12 个月内复发的大 B 细胞淋巴瘤(LBCL)患者。 Yescarta(axicabtagene ciloleucel)是一款靶向 CD19 的 CAR-T 细胞疗法,于 2017 年获得 FDA 批准,用于经过两线或更多线全身治疗后的 LBCL 患者。
吉利德首席执行官 Christi Shaw 指出,扩大适应症将使符合接受 Yescarta 资格的淋巴瘤患者数量从之前的 8,000 人增加到 14,000 人左右。
目前美国有 112 个授权中心可以使用 Yescarta,吉利德一直在扩大 Yescarta 的制造能力。尽管如此,CAR-T 细胞疗法的最大挑战仍然是让社区肿瘤学医生将符合条件的患者转诊到这些专科中心。事实上,在符合条件的患者中,只有 20% 的患者接受了细胞治疗。
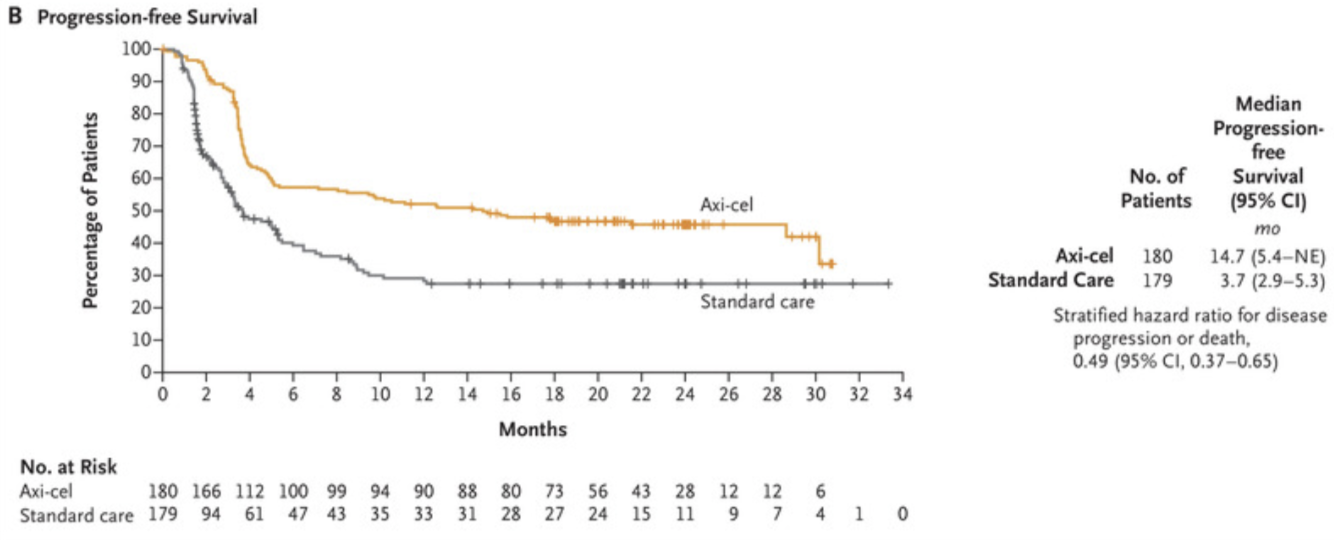
这项批准是基于 III 期 ZUMA-7 研究的结果,吉利德去年表示,该研究达到了其无事件生存期 (EFS) 的主要终点,以及关键次要终点:总体缓解率 (ORR)。后来在美国血液学会 (ASH) 会议上公布的结果显示,经过大约两年的随访,Yescarta 组患者的中位 EFS 为 8.3 个月。此外,Yescarta 组患者的 ORR 为 83%,其中 CR 率为 65%。
最近,美国国家综合癌症网络 (NCCN) 更新了其肿瘤学临床实践威廉亚洲博彩公司 ,将 Yescarta 纳入 12 个月内复发性疾病或原发性难治性疾病的 LBCL 患者的 1 类推荐。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#早期治疗#
50
#CAR-#
45
#FDA批准#
43
学习了,谢谢分享
61
#Car-T细胞疗法#
62
#ART#
53
#cART#
58
#T细胞疗法#
63
#Yescarta#
68
学习了
61