全球首个结晶样视网膜变性基因疗法I/II期临床入组完成
2023-09-21 天泽云泰 天泽云泰 发表于上海
针对结晶样视网膜变性(Bietti crystalline dystrophy, BCD)的治疗,上海天泽云泰生物医药有限公司(以下简称“天泽云泰”)自主研发的核心产品之一VG
针对结晶样视网膜变性(Bietti crystalline dystrophy, BCD)的治疗,上海天泽云泰生物医药有限公司(以下简称“天泽云泰”)自主研发的核心产品之一VGR-R01注射剂此前于2022年11月1日获得了国家药品监督管理局药品审评中心(CDE)的临床试验申请默示许可,是全球首个获批临床的治疗产品。2023年9月21日,VGR-R01的I/II期临床试验已顺利完成全部受试者手术给药,距离该全球首创产品上市又迈出了关键的一步。
该临床试验由首都医科大学附属北京同仁医院魏文斌教授与上海市第一人民医院孙晓东教授担任主要研究者,旨在评估VGR-R01的安全性和有效性,于2023年3月正式启动,历时仅半年即完成所有受试者入组给药。截至目前,VGR-R01的I/II期临床试验取得了令人鼓舞的数据:所有患者的安全性与耐受性良好,未见VGR-R01可能相关不良事件(AE)发生;初步有效性数据显示,爬坡阶段各剂量组的VGR-R01均能迅速逆转或控制疾病进展,使平均病程已超十年的BCD患者仍可提高最佳矫正视力(BCVA),或改善在昏暗环境下的功能性视觉(移动性测试评分),从而提升生活质量(VFQ-25评分)。天泽云泰项目团队拟近期与监管机构讨论该产品的进一步开发和上市计划,努力推动产品更快上市,帮助BCD患者走出无药可医的困境。

天泽云泰CEO赵小平博士表示:“感谢所有参与本研究的BCD患者,视网膜色素变性患者组织苏州爱瞳公益,以及京沪两大研究中心的全部研究者,与公司携手达成BCD治疗的又一个重大里程碑。但愿苍生俱饱暖,不辞辛苦出山林。
天泽云泰将继续高效推进VGR-R01的后续临床研究,期待在生物技术产业革命中,贡献中国自主创新的重要突破,为广大的BCD患者带来曙光。”
————— 关于结晶样视网膜变性 —————
结晶样视网膜变性又称Bietti结晶样视网膜病变,是一种常染色体隐性遗传的进展性视网膜变性疾病。BCD致病基因是位于4q35的CYP4V2,编码一种与脂肪代谢相关的蛋白酶。在世界范围内BCD均有分布,但在中国、日本和韩国人群中更为普遍。大多数BCD患者于20-40岁发病,出现夜盲和视力下降等症状,在50-60岁发展为法定盲人。基于临床特征和基因检测鉴定CYP4V2中的双等位基因致病变异,BCD可被确诊,然而仍缺乏有效的临床治疗手段。
————— 关于VGR-R01 —————
VGR-R01是针对CYP4V2基因突变导致的BCD患者的基因治疗产品。CYP4V2蛋白为P450酶家族成员,在视网膜色素上皮细胞(RPE)中高度表达,具有脂肪酸羟化酶活性,与脂肪代谢相关。VGR-R01的作用原理是一种基因替代疗法。
VGR-R01通过视网膜下腔注射给药后,AAV衣壳蛋白介导RPE细胞的转导,将VGR-R01基因表达盒递送至细胞核。VGR-R01表达盒以游离DNA的形式存在,在RPE细胞表达CYP4V2蛋白,以重建细胞的脂肪酸羟化酶活性。VGR-R01通过纠正患者视网膜内的脂肪酸代谢障碍,以期达到预防或改善RPE细胞、感光细胞及脉络膜的结构和/或功能损伤,并实现纠正视力损伤、保护残存视功能、或延缓视力恶化的临床效果。
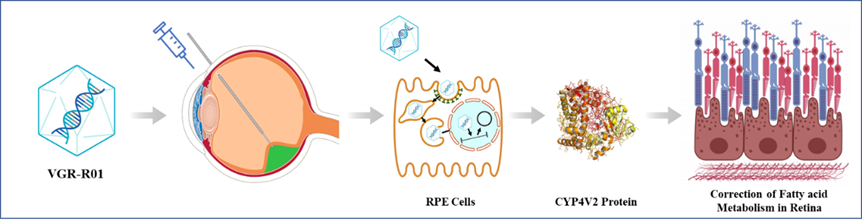
图3 VGR-R01作用机制图示
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言