FOLFOXIRI加西妥昔单抗或贝伐珠单抗作为BRAFV600E突变转移性结直肠癌的一线治疗:随机II期FIRE-4.5(AIO KRK0116)研究
2023-06-29 daikun MedSci原创 发表于上海
该研究旨在评估FOLFOXIRI加西妥昔单抗或贝伐珠单抗作为BRAFV600E突变转移性结直肠癌的一线治疗的疗效和安全性。
BRAFV600E突变与转移性结直肠癌(mCRC)的不良结局有关。该临床试验调查了三联化疗(氟尿嘧啶、亚叶酸、奥沙利铂和伊立替康)联合西妥昔单抗或贝伐珠单抗治疗既往未经治疗的 BRAFV600E 突变型转移性结直肠癌患者的疗效。

患者和方法:在这项对照、随机、开放标签的II期试验中,109名患者被随机分配,其中107名被纳入完整分析集(FAS)。患者以2:1的比例随机分配,在实验组中接受FOLFOXIRI加西妥昔单抗(n=72)或在对照组中接受FOLFOXIRI加贝伐珠单抗(n=35)。主要终点是根据RECIST 1.1.评估根据方案治疗的患者(ATP人群)的客观缓解率(ORR)。次要中终点为无进展生存期(PFS)、总生存期(OS)、毒性。
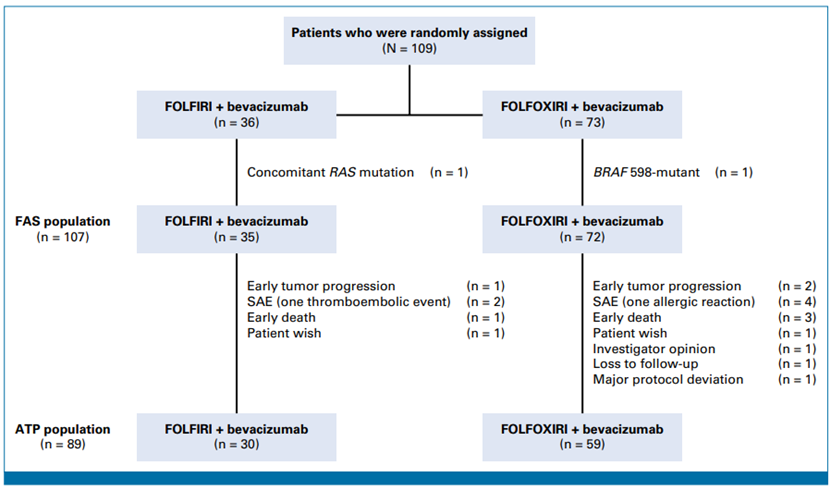
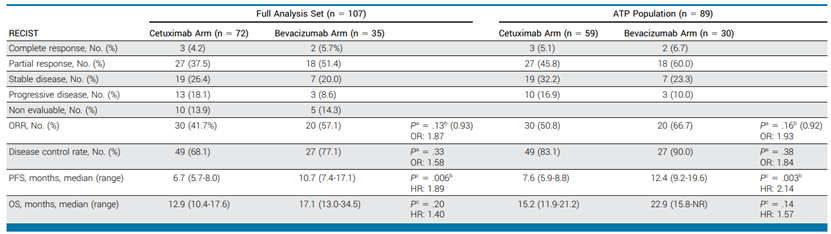
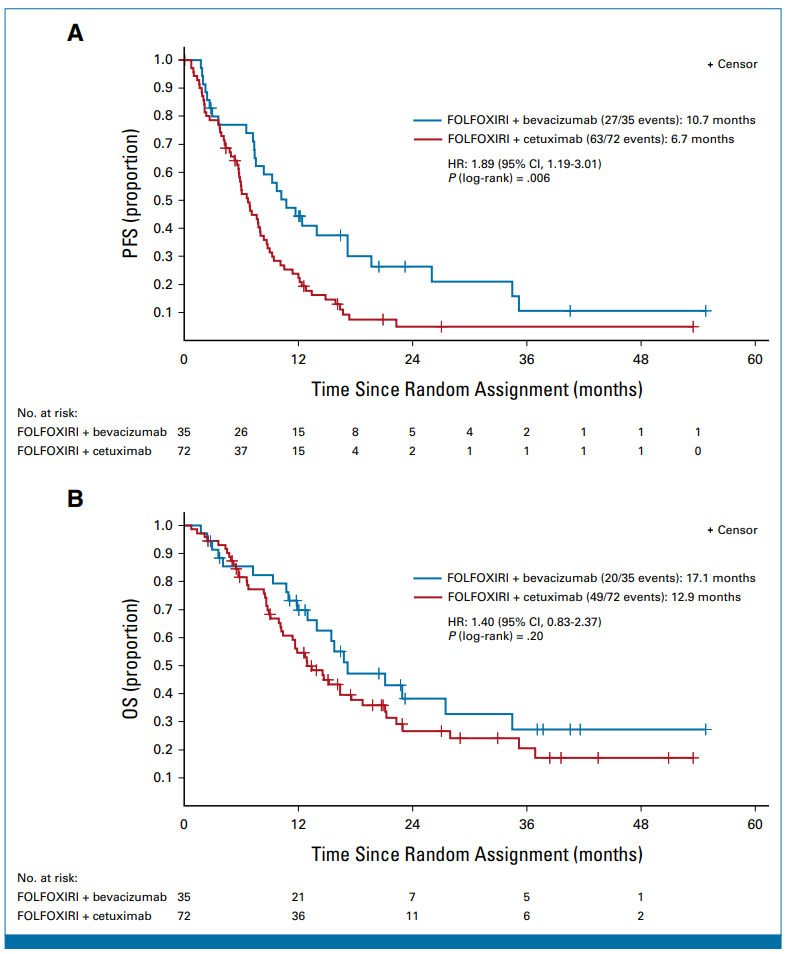
结果:18名患者在第一次肿瘤评估前停止了研究治疗,从而导致ATP人群为89名患者。在这些患者中,基于西妥昔单抗的实验组ORR为51%(30/59),基于贝伐珠单抗的对照组为67%(20/30)(比值比,1.93;80%CI,1.06至3.52;P =0.92 [单边])。在完整分析集中,实验组的中位PFS明显较差(6.7个月vs 10.7个月; 风险比[HR],1.89;P =0.006),中位OS有缩短的趋势(12.9 个月 vs 17.1 个月;HR,1.4;P =0.20)。
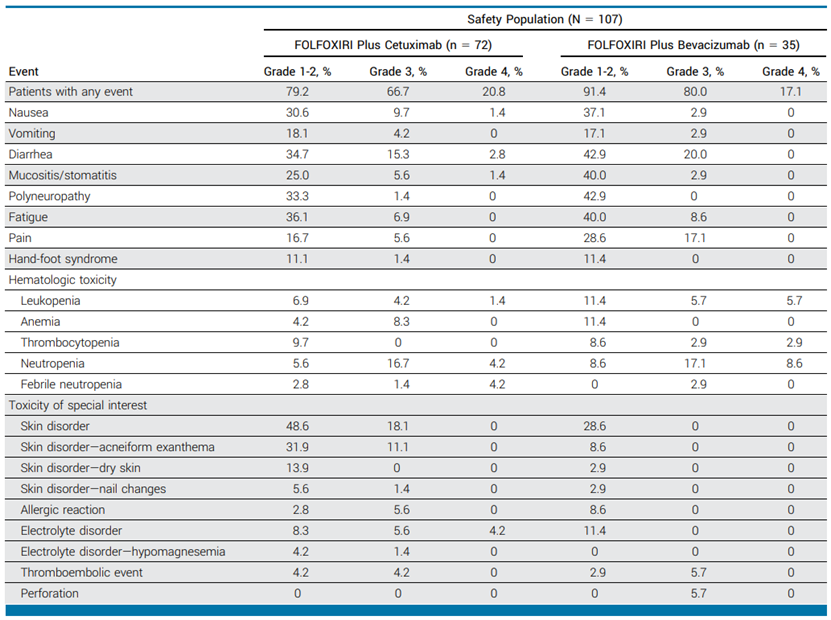
研究中未观察到新的毒性。在西妥昔单抗组中,66.7%的患者观察到任何级别的和18.1%的患者观察到≥3级的皮肤疾病。四名患者因西妥昔单抗组内的不良事件而死亡。西妥昔单抗组和贝伐珠单抗组分别有26.4%和34.3%的患者出现中性粒细胞减少。16例患者(西妥昔单抗组11例,贝伐珠单抗组5例)在治疗期间接受预防性应用粒细胞集落刺激因子(G-CSF)。
结论:就目前所知,FIRE-4.5是第一个研究BRAFV600E突变转移性结直肠癌一线治疗的前瞻性随机研究。在BRAFV600E突变转移性结直肠癌的一线治疗中,与FOLFOXIRI加贝伐珠单抗相比,FOLFOXIRI加西妥昔单抗不会导致更高的ORR。基于贝伐珠单抗的化疗仍然是 BRAFV600E 突变型转移性结直肠癌患者的首选一线治疗。
参考文献
DOI: 10.1200/jco.22.01420
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













