浙江大学高建青/西湖大学林能明ACS Nano:类多能中性粒细胞纳米载体调节免疫微环境
2024-02-13 BioMed科技 BioMed科技 发表于陕西省
浙江大学高建青教授和西湖大学林能明教授等人提出了一种由活化的中性粒细胞膜结合脂质体组成的类多能中性粒细胞纳米载体,用于调节免疫微环境和协同抗肿瘤化疗。
化疗的有限治疗结果和严重的全身毒性仍然是当前临床抗肿瘤治疗方案的主要挑战。可改善药物全身分布情况的肿瘤靶向药物递送系统是克服全身毒性的实用解决方案。然而,肿瘤适应性免疫微环境仍然构成巨大威胁,其可通过促进肿瘤细胞的耐受性来损害化疗的疗效。
在本研究中,浙江大学高建青教授和西湖大学林能明教授等人提出了一种由活化的中性粒细胞膜结合脂质体组成的类多能中性粒细胞纳米载体(Neutrosome(L)),用于调节免疫微环境和协同抗肿瘤化疗。Neutrosome(L)从活化的中性粒细胞处继承了突出的肿瘤靶向能力,结合良好的肿瘤穿透能力,可使药物在肿瘤组织中可观积累(是游离药物的六倍多)。更重要的是,Neutrosome(L)可以通过限制中性粒细胞在肿瘤组织中的浸润来调节免疫微环境,从而增强抗肿瘤化疗效果。因此,负载顺铂的Neutrosome(L)的治疗具有显著的肿瘤抑制作用,降低了全身药物毒性,并延长了荷瘤小鼠的生存期。本研究中提出的类多能中性粒细胞纳米载体不仅可以增强化疗药物的肿瘤积累,还可以调节免疫微环境,为增强抗肿瘤化疗提供了一种简单的策略。相关工作以“A Pluripotential Neutrophil-Mimic Nanovehicle Modulates Immune Microenvironment with Targeted Drug Delivery for Augmented Antitumor Chemotherapy”为题发表在ACS Nano。

【文章要点】
作为最丰富的白细胞和先天免疫稳态不可或缺的成分,中性粒细胞与肿瘤的发生、进展和预后密切相关。肿瘤细胞通过分泌的炎性细胞因子吸引外周循环中的中性粒细胞,而被吸引的中性粒细胞沿着炎症因子的趋化梯度迁移,并通过细胞表面粘附分子之间的相互作用渗出血管屏障,到达肿瘤周围的慢性炎症环境。作为动态肿瘤微环境(TME)中的一个重要细胞亚群,肿瘤前表型在肿瘤相关中性粒细胞(TANs)中占主导地位,并深刻影响癌症的治疗反应。此外,中性粒细胞膜可以通过膜上丰富的细胞因子受体中和炎症因子并占据一些细胞结合位点。根据这些现象,作者认为基于中性粒细胞的药物递送系统不仅可以实现肿瘤靶向药物递送,而且可以影响TAN以增强化疗。为此,作者利用脂多糖(LPS)刺激对中性粒细胞进行活化,以增强其炎症嗜性。因此,Neutrosome(L)的制造过程非常方便,没有复杂的工程化过程。更重要的是,Neutrosome(L)可将中性粒细胞膜的固有靶向强度和低免疫原性与传统脂质体的载药包封潜力相结合。同时,在确保不损害炎症嗜性的前提下,脂质体的掺入也可以减少中性粒细胞质膜的消耗(图1)。
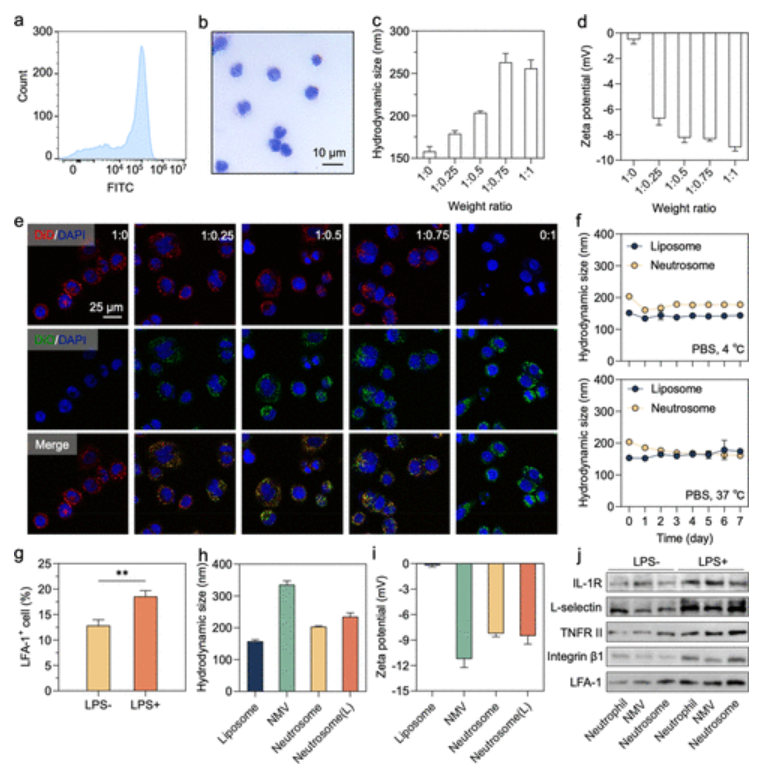
图1 Neutrosome(L)的表征
静脉给药后,Neutrosome(L)可以在肿瘤组织中积聚并穿透肿瘤球体进行肿瘤靶向药物递送(其肿瘤处的累积量是游离药物的六倍多)。尽管细胞膜衍生的药物递送系统的开发由于其从原始细胞遗传的嗜性而引起了人们的高度关注,但载体在治疗结果中的作用却没有引起人们的兴趣。与先前报道的仅将药物递送到肿瘤组织的靶向药物递送系统形成鲜明对比的是,作者在此提出的Neutrosome(L)可以显著限制中性粒细胞在肿瘤组织中的浸润并抑制肿瘤生长(图2)。因此,负载顺铂的Neutrosome(L)治疗具有显著的肿瘤抑制作用,降低了全身药物毒性,并将荷瘤裸鼠的中位生存时间延长至64天,为增强抗肿瘤化疗提供了一种由具有免疫微环境调节作用的类多能中性粒细胞纳米载体介导的简明策略。
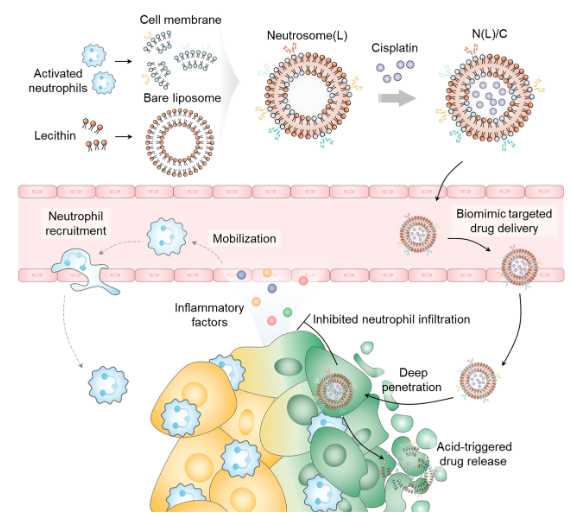
图2 抗肿瘤治疗示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c12694
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#化疗# #中性粒细胞# #免疫微环境#
54