**iPSC衍生的CAR-T细胞疗法:IND已获FDA批准
2020-07-11 Allan MedSci原创
Fate Therapeutics是一家临床阶段的生物制药公司,致力于开发抗癌症和免疫疾病的细胞免疫疗法,今日宣布,美国FDA已批准FT819的研究性新药申请(IND)。
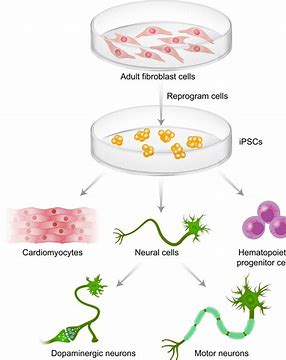
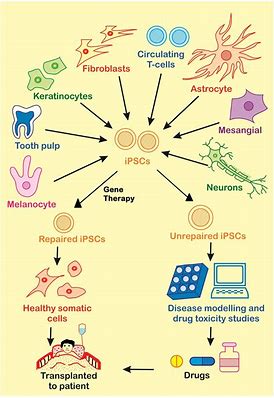
Fate Therapeutics是一家临床阶段的生物制药公司,致力于开发抗癌症和免疫疾病的细胞免疫疗法,今日宣布,美国FDA已批准FT819的研究性新药申请(IND)。FT819是一种针对CD19+恶性肿瘤的源自诱导多能干细胞(iPSC)的CAR-T细胞疗法,旨在提高CAR-T细胞疗法的安全性和有效性。Fate Therapeutics计划启动FT819的I期临床试验,以治疗复发难治B细胞恶性肿瘤,包括慢性淋巴细胞性白血病(CLL)、急性淋巴细胞性白血病(ALL)和非霍奇金淋巴瘤(NHL)。多中心I期临床试验旨在确定FT819的最大耐受剂量,并评估FT819治疗三种B细胞恶性肿瘤(CLL、ALL和NHL)的安全性和临床活性。每个适应症将独立注册并评估三种剂量递增方案。
FT819旨在解决当前CAR-T细胞疗法的若干限制。使用iPSC细胞系作为起始细胞来源,这使CAR-T细胞能够大量生产并可交付给患者使用。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#FDA批准#
49
#CAR-#
56
#Car-T细胞疗法#
66
#iPS#
54
#PSC#
67
#IND#
47
#T细胞疗法#
61
#iPSC#
56