罕见病例|HIV感染合并自身免疫性肝炎-原发性胆汁性胆管炎重叠综合征1例
2024-03-05 临床肝胆病杂志 临床肝胆病杂志 发表于上海
本文报道1例HIV感染合并AIH-PBC重叠综合征患者的诊治,为该类疾病临床诊治提供借鉴。
艾滋病,即获得性免疫缺陷综合征(AIDS),其病原体为人类免疫缺陷病毒(HIV),亦称艾滋病病毒。HIV感染主要侵犯人体的免疫系统,包括CD4+T淋巴细胞、单核巨噬细胞和树突状细胞等,表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能严重缺陷,引起各种机会性感染和肿瘤的发生。自身免疫性肝炎(AIH)-原发性胆汁性胆管炎(PBC)重叠综合征属于自身免疫性肝病重叠综合征的一种类型,其本质是由于自身免疫功能紊乱引起肝细胞及毛细胆管损伤,在自身免疫性肝病重叠综合征类型中较为常见,而AIH-PBC重叠综合征在HIV感染者中同时存在较为罕见。本文报道1例HIV感染合并AIH-PBC重叠综合征患者的诊治,为该类疾病临床诊治提供借鉴。
1病例资料
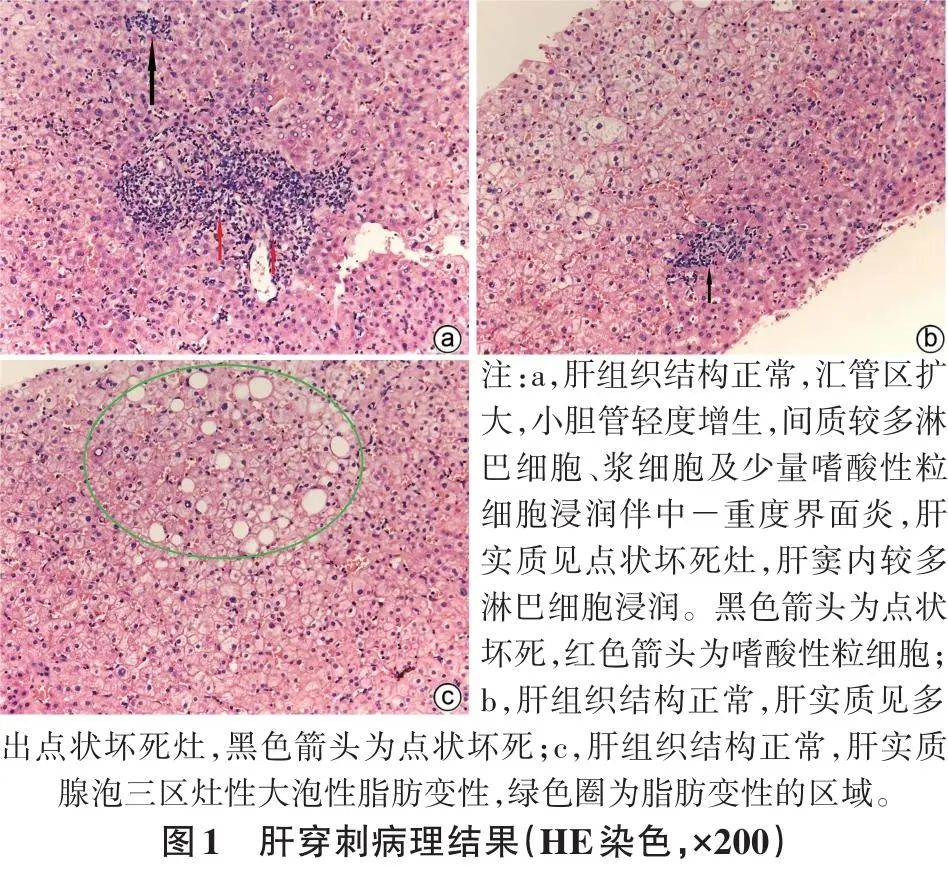
患者女性,60岁,2022年5月12日因“恶心3 d”就诊于广汉市人民医院。患者3 d前无明显诱因出现恶心,无呕吐、皮肤巩膜黄染,无厌油、纳差、乏力,无腹胀、腹痛、腹泻,无畏寒、发热,无头昏、头痛等其他不适,未于外院就诊及治疗。门诊以“肝功能不全,HIV感染”收入感染科住院治疗。患病以来,患者精神、食欲欠佳,睡眠可,大小便基本正常,体质量无明显变化。既往史:无药物服用史、饮酒史。半个月前因发现胆囊结石行术前检查,发现HIV-1抗体阳性,无高效抗逆转录病毒治疗(ART)史。查体:生命体征平稳,其余无特殊。肝功能示:ALT 173.00 U/L,AST 114.00 U/L,ALP 259.00 U/L,GGT 659.00 U/L,胆汁酸30.4 μmol/L,总蛋白89.70 g/L,球蛋白44.30 g/L;免疫球蛋白:IgM 8.50 g/L,IgG 20.70 g/L;AIH检查:抗核抗体阳性胞浆颗粒型(1:1 280),抗线粒体抗体(AMA)阳性,AMA-M2亚型阳性。CD4+T淋巴细胞1 017个/μL,CD8+T淋巴细胞1 331个/μL。肝炎病毒学检查均阴性。超声引导下行肝穿刺活检,病理结果(图1)示:肝小叶结构大致正常;肝细胞浊肿,淤胆不明显,肝窦内见较多单个核细胞浸润,肝实质见碎屑样坏死及桥接坏死,局灶肝细胞核糖原化改变;汇管区小胆管轻度增生,间质较多淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润。符合中度慢性肝炎(G2/S2),倾向AIH。结合实验室检查考虑诊断:AIH-PBC重叠综合征。以替诺福韦300 mg(1次/d)、拉米夫定300 mg(1次/d)、依非韦伦400 mg(1次/d)抗HIV治疗,并予以保肝、促进胆汁排泄;2022年5月18日给予强的松30 mg(1次/d)抗炎+熊去氧胆酸0.25 mg(3次/d)治疗;2022年6月16日复查肝功能各项指标较前明显下降,减量强的松为20 mg,1次/d,加用硫唑嘌呤50 mg,1次/d,继续熊去氧胆酸0.25 mg,3次/d治疗。2022年7月18日减量强的松为15 mg,1次/d,继续硫唑嘌呤50 mg,1次/d及熊去氧胆酸0.25 mg,3次/d治疗。此外,患者仍为初始方案抗HIV病毒治疗。2022年10月18日复查肝功能:ALT 35.00 U/L,AST 32.00 U/L,ALP 114.00 U/L,GGT 146.00 U/L,胆汁酸7.2 μmol/L;免疫球蛋白:IgM 1.4 g/L,IgG 6.2 g/L,均正常。患者目前无恶心、呕吐,无腹胀、腹痛,无厌油、纳差、乏力,无皮肤黄染及瘙痒。
2讨论
HIV感染人体后引起一系列异常的免疫反应,病毒抗原的持续刺激使机体免疫系统处于异常增高的激活状态,除了CD4+T淋巴细胞和CD8+T淋巴细胞表达CD69、CD38、HLV-DR、CD59等激活分子的水平持续升高,还包括B淋巴细胞、单核巨噬细胞、自然杀伤细胞和树突状细胞的功能障碍与异常免疫激活,激活的CD8+T淋巴细胞清除HIV感染的CD4+T淋巴细胞,从而引起CD4+T淋巴细胞计数减少。自身免疫性肝病是指机体的免疫系统以患者肝细胞,或/和胆管上皮细胞作为攻击对象而导致的疾病。尽管自身免疫性肝病确切的发病机制尚不清楚,但因肝脏正常免疫耐受破坏、免疫效应细胞激活,导致具有炎症保护作用的调节性T淋巴细胞、B淋巴细胞数量减少或功能损伤,造成肝细胞或/和胆管上皮细胞持续炎症发展。自身免疫性肝病是因T淋巴细胞的过度激活引起,而HIV感染是由于T淋巴细胞耗竭引起,截然相反的发病机理使得HIV患者中自身免疫性肝病的患病率极低。本例患者为老年女性,发现HIV抗体阳性,血生化示肝损伤,首先考虑为合并病毒性肝炎,或ART/其他药物的副作用、机会性感染以及非酒精性脂肪性肝炎等,后续检查结合患者病史排除了以上原因可能。考虑到患者血清IgG水平升高,自身免疫性抗体阳性,肝活检病理符合AIH的典型特征,根据AIH简化诊断标准评分为8分,可以明确诊断AIH;并且患者ALP、GGT水平升高,AMA-M2亚型阳性,肝活检病理提示小胆管轻度增生,可诊断为PBC。根据AIH-PBC重叠综合征巴黎诊断标准,本病例符合AIH-PBC重叠综合征诊断。HIV是一种通过感染和破坏T淋巴细胞导致免疫系统活性降低的疾病,在HIV感染早期,可表现为多克隆刺激B淋巴细胞过度活化,从而引起IgG和IgA增高,自身抗体、循环免疫复合物存在和周围血B淋巴细胞数量的增加等。以上特点进一步增加了HIV合并自身免疫性肝病诊断的难度。根据本例患者HIV-1抗体阳性及血生化、自身免疫抗体、肝活检病理最终诊断为HIV感染合并AIH-PBC重叠综合征。
AIH-PBC重叠综合征合并HIV在临床极为罕见,因为两者具有相反的病理机制,HIV感染属于免疫缺陷,重叠综合征属于免疫激活。通过文献复习,尚未见HIV合并AIH-PBC重叠综合征病例报道,但有少量HIV合并AIH病例报道,这些患者大部分是在ART免疫状态恢复后发生AIH,其原因是AIDS患者在ART后免疫功能恢复过程中,一般在3个月内,可能会出现免疫重建炎性综合征,其定义为:免疫系统的重建伴随着针对病原体或自身抗原的反应。恢复的免疫功能针对自身抗原可导致新发自身免疫性肝病的出现或药物治疗诱发自身免疫性肝病。
本例患者入院半个月前发现HIV-1抗体阳性,流行病学史不详,入院时有恶心,无其他不适症状,CD4+T淋巴细胞未见明显下降,提示HIV感染处于急性期可能性大,并且暂时未启动ART,不支持免疫重建炎性综合征。在HIV感染急性期免疫系统尚完好,CD8+细胞毒性T淋巴细胞作为一种能特异性杀伤病毒感染细胞、肿瘤细胞或同种异体移植细胞的免疫效应细胞,为清除HIV,异常的免疫激活会导致其应答的增强,而细胞毒性T淋巴细胞应答的增强导致容易攻击自身抗原,并且产生IFN-γ和TNF-α,诱导肝细胞凋亡及细胞周期阻滞。结合本例患者情况,其有可能因抗HIV而异常的免疫激活触发自身免疫性肝病。另一种可能是在感染HIV之前患者已有AIH合并PBC,但既往处于无症状的隐匿起病状态。目前HIV感染合并自身免疫性肝病的机制还不明确,需进一步研究。
对于HIV感染合并自身免疫性肝病的治疗暂无标准。回顾文献,Chaiteerakij等通过对13例HIV感染合并AIH患者的分析,提出感染HIV的AIH患者可以采用与无HIV感染者类似的免疫性抑制剂治疗,治疗后大多数患者的肝生化指标快速改善,随后疾病缓解,但通常需要低剂量免疫抑制药物长期维持治疗,以防止疾病复发。由于HIV感染者的免疫功能明显受损,诊断为AIDS患者CD4+T淋巴细胞数量严重降低时,使用大剂量的免疫抑制药物风险较高,对于此类患者应先使用ART,待CD4+T淋巴细胞升高后再行免疫抑制治疗。本例患者考虑因处于HIV感染急性期,异常的免疫激活诱导了自身免疫性肝病的发生,并且CD4+T淋巴细胞尚正常,故给予免疫抑制剂联合熊去氧胆酸治疗,并及时予以ART。通过随访生化指标,目前治疗应答较好,未见明显并发症,后续将继续随访监测。
综上,本文报道了1例HIV感染合并AIH-PBC重叠综合征的罕见病例,HIV感染可与自身免疫性肝病同时存在,通常在急性感染期或ART后免疫重建时发生,故对于HIV/AIDS患者出现肝损伤,排除病毒性肝炎、药物性肝损伤和非酒精性脂肪性肝病等疾病外,还需进一步排查自身免疫性肝病可能,及时完善IgG、自身抗体等检查以进一步鉴别诊断。对于在HIV感染中诊断明确的自身免疫性肝病患者,可采用免疫抑制治疗,但需密切关注感染等并发症。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.09.021

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#HIV# #自身免疫性肝炎# #原发性胆汁性胆管炎#
49