Cell Stem Cell:蔡秀军/惠利健团队开展转分化肝细胞生物人工肝治疗肝衰竭的临床研究
2023-04-15 王多鱼 “生物世界”公众号 发表于上海
该研究利用GMP条件下生产的转分化肝细胞(hiHep)构建了临床级的hiHep生物人工肝,并首次开展了7例大肝切患者的临床治疗。
肝脏是体内最大的代谢解毒器官。各种肝病引起的肝功能衰竭进展迅速、预后较差,病死率高达80%。其中术后肝衰竭(post-hepatectomy liver failure,PHLF)正是肝癌手术治疗最致命的并发症。肝切除术作为肝癌的一线疗法,其5年生存率接近70%。大量患者由于肿瘤体积过大或存在多个肿瘤需要进行大范围肝切治疗。但大肝切极易诱发肝衰竭,严重危及患者生命,并限制了肝切除手术的应用。
肝移植是治疗肝衰竭最有效的手段,但由于供肝短缺无法广泛应用。近年来基于原代肝细胞构建的生物人工肝(Bioartificial Liver,BAL)已显示出对肝衰竭的治疗作用,包括术后肝衰竭。生物人工肝的核心是体外生物反应器中的肝细胞,其发挥肝脏合成和代谢解毒等功能,并促进患者肝脏再生。但人原代肝细胞来源有限,因此亟需建立不依赖原代细胞的生物人工肝系统。
2023年4月13日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组与浙江大学医学院附属邵逸夫医院蔡秀军团队合作,在 Cell Stem Cell 期刊发表了题为:Reversal of liver failure using a bioartificial liver device implanted with clinical-grade human induced hepatocytes 的研究论文。
该研究利用GMP条件下生产的转分化肝细胞(hiHep)构建了临床级的hiHep生物人工肝,并首次开展了7例大肝切患者的临床治疗,发现患者对hiHep生物人工肝治疗耐受无不良反应,且伴随着肝功能改善、肝脏再生和炎症降低,达到了安全性和可行性的首要临床终点。

惠利健研究组前期通过过表达肝脏转录因子(FOXA3,HNF1A和HNF4A)将人成纤维细胞转分化为可增殖的功能肝细胞(hiHep)(Cell Stem Cell,2014);进而实现hiHep的大规模扩增(109数量级),构建了基于hiHep的新型生物人工肝(hiHep-BAL)(Cell Research,2016)。而该研究进一步实现hiHep-BAL治疗肝衰竭的临床应用,是转分化技术细胞的首次临床转化。
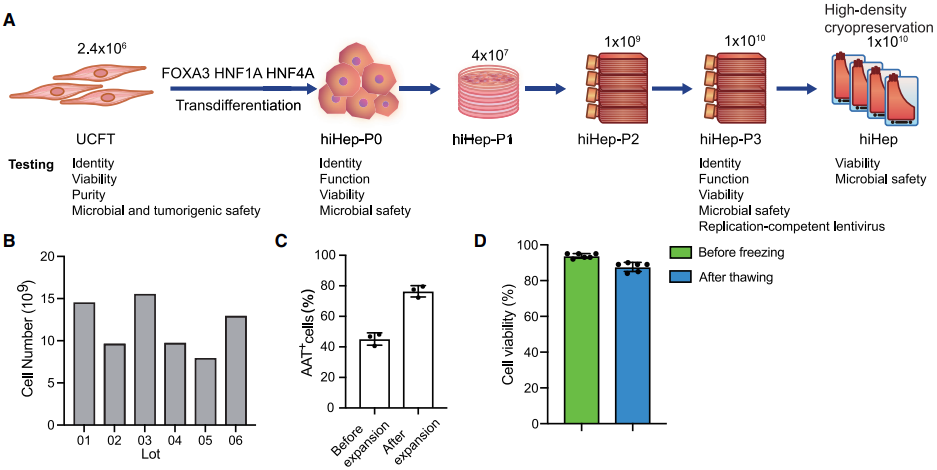
hiHep细胞大规模扩增和冻存路线图
在这项研究中,研究团队首先建立了适合转分化肝细胞的无血清培养体系,结合细胞工厂和大规模冻存技术,稳定生产了1010/人份的GMP级“现货型”hiHep制剂,为临床肝衰竭的紧急治疗提供了可能。

hiHep-BAL逆转PHLF进程图
为进一步验证其治疗效果,研究人员构建了85%肝切诱导的肝衰竭小型猪模型,并证明了hiHep-BAL治疗可以逆转动物术后肝衰,显着提升存活率并有效降低血氨水平。
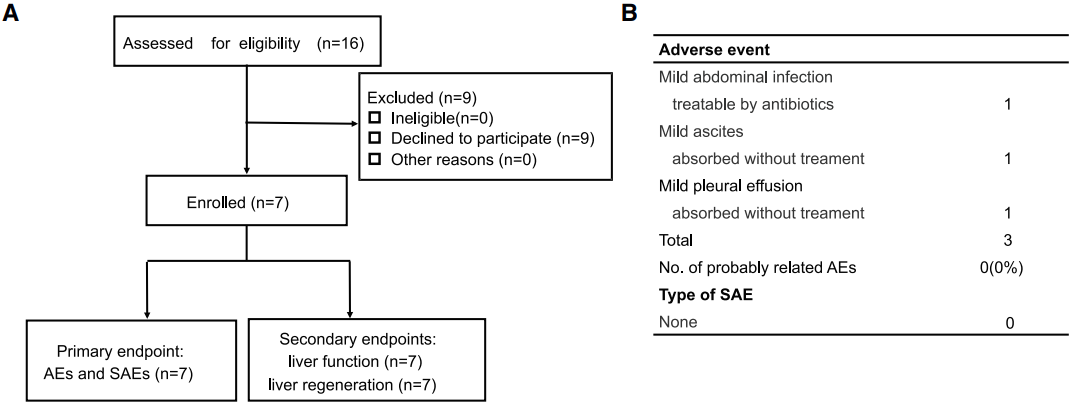
hiHep-BAL临床治疗的安全性图
重要的是,在hiHep-BAL首次人体(first-in-human)临床研究中,7位大肝切患者均未出现治疗相关的不良反应、血液学毒性和肝肾功能损伤,证明了hiHep-BAL临床治疗的安全性和可行性,达到了首要临床终点。
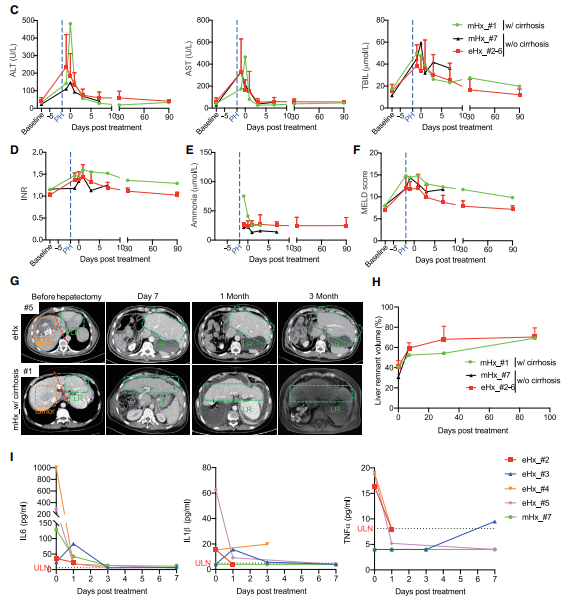
hiHep-BAL临床治疗的指标变化图
值得注意的是,大肝切患者在hiHep-BAL治疗后,伴随着肝损伤指标ALT、AST和TBIL的下降,凝血功能指标INR等的改善,肝性脑病重要诱因血氨水平的降低,炎症指标IL6等下降,以及肝脏再生指标肝体积的增大。特别是1例存在肝衰症状的大肝切患者在治疗后肝功能迅速恢复,揭示了hiHep-BAL具有治疗术后肝衰的潜力,更有望让原本存在肝衰风险而不适合肝切治疗的患者得到手术医治的可能性。
综上所述,该研究建立了临床级hiHep-BAL,先在临床前大动物实验中证明了hiHep-BAL可以治疗术后肝衰竭,进而在大肝切病人中证明其安全性和初步疗效。
这是转分化来源人功能细胞的首次临床应用,也是hiHep-BAL治疗肝衰竭迈向临床的第一步。目前国家药品监督管理局药品审评中心(CDE)已批准hiHep-BAL的新药临床试验(IND)申请。
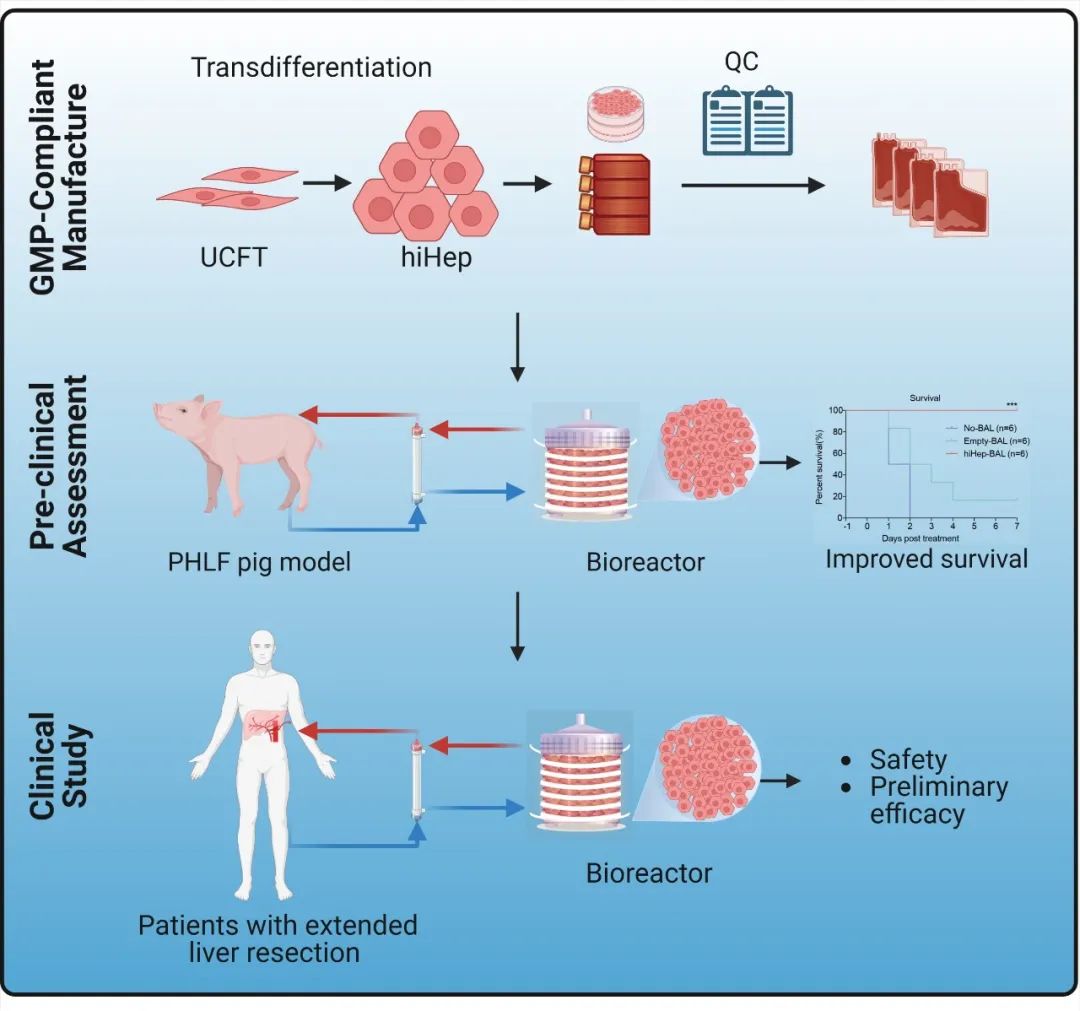
hiHep生物人工肝临床转化概要图
浙江大学医学院王一帆副主任医师、郑强医师和中科院分子细胞科学卓越创新中心/上海科技大学联合培养博士孙振为该论文共同第一作者,浙江大学医学院蔡秀军教授和分子细胞科学卓越创新中心惠利健研究员、张鲁狄副研究员为该论文通讯作者。
原始出处:
Yifan Wang, et al. Reversal of liver failure using a bioartificial liver device implanted with clinical-grade human-induced hepatocytes. Cell Stem Cell, 2023.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言









这个好
74