登上《Nature》封面: 胆固醇,竟然可以防止生物黏附!
2023-06-26 BioMed科技 BioMed科技 发表于上海
该研究结果表明,胆固醇以分子排列的方式组装,能够从熵上限制生物黏附。胆固醇的空间解耦两亲性与其在多层中的有效排列相结合,产生了缓慢适应的、协同的界面取向迁移率,被认为是显著的熵排斥的先决条件。
黏附性的控制是生物体的一个显著特征,这对技术转化方面特别感兴趣。德国德累斯顿莱布尼兹聚合物研究所发现,由胆固醇层的界面取向波动引起的熵排斥限制了蛋白质的吸附和细菌的黏附性。此外,还发现,当含有少量(低于10wt%)的胆固醇时,本质粘合的蜡酯层也会变成类似的抗菌粘合剂。润湿、吸附和粘着实验以及原子模拟表明,排斥特性取决于胆固醇的特定分子结构,该结构编码在不受约束的超分子组装界面处精细平衡的波动重新定向:胆固醇类似物层仅在微小的分子变化中不同显示出明显不同的界面流动性,并且没有抗黏附作用。
此外,定向固定的胆固醇层不能抵抗生物黏附。该见解为生物界面提供了一种全新的物理化学观点,并可能指导未来在黏附性调节方面的材料设计。该研究以题为“Entropic repulsion of cholesterol-containing layers counteracts bioadhesion”的论文发表在《Nature》上。

虽然自然界中的界面现象得到了广泛的研究,但控制生物黏附的物理机制-生物聚合物和细胞(包括细菌)的界面积累-尚未完全了解。之前探索了弹尾目动物无所不在的、具有抗生素黏附性的角质层,发现它由纳米结构组成,具有悬垂的横截面轮廓,防止湿润和细菌定植。
后来,它被认为是另一道防止生物黏附的富含脂肪的角质层--被证明含有脂肪族碳氢化合物,特别是类固醇、脂肪酸和蜡酯。虽然蜡酯可以合理地支持角质层的非润湿特性,但类固醇和脂肪酸的作用仍然难以捉摸。据报道,游离脂肪酸可以杀死或抑制细菌和真菌的生长,类固醇被发现可以减少海绵和海星上的生物黏附;然而,类固醇的这种作用没有机制上的解释。尤其是胆固醇,已经得到了全面的研究,它的存在被认为对调节功能脂类结构域以及蛋白质和脂类之间的相互作用至关重要。然而,胆固醇在细胞膜以外的生物结构的界面上的功能相关性还没有得到充分的研究。

弹尾虫角质层脂质通过旋涂(旋涂脂质多层膜,SCLs)被物理吸附在固体载体上的多层中。自组装单分子膜(SAMs)化学吸附在金上作为所研究的角质层脂质组分在几何约束的分子取向上的对比分析。生物黏附的一个标志是形成蛋白质、核酸、脂质和其他生物分子的分子调节层。通过溶菌酶和白蛋白的吸附实验模拟了这一过程,结果显示胆固醇SCL上的蛋白质吸附量明显低于所有其他研究的SCLs和SAMs。同样,发现革兰氏阳性菌(表皮葡萄球菌)和革兰氏阴性菌(大肠杆菌)对胆固醇SCLs的黏附力非常低。通过分析不同层厚度的胆固醇 SCLs,可以排除多层厚度对抗黏附特性的任何影响。
值得注意的是,硫胆固醇和 N-(2-巯基乙基)-3-羟基-5-胆酸酰胺(硫胆酸)的SAMs——即反向分子排列的化学固定胆固醇单层的替代物比胆固醇SCLs积累了更多的吸附蛋白和黏附细菌。这一观察结果表明,层状胆固醇中分子流动性的限制会阻碍抗黏附特性。通过总有机碳含量分析排除了胆固醇SCLs的部分溶解作为低生物黏附的原因。
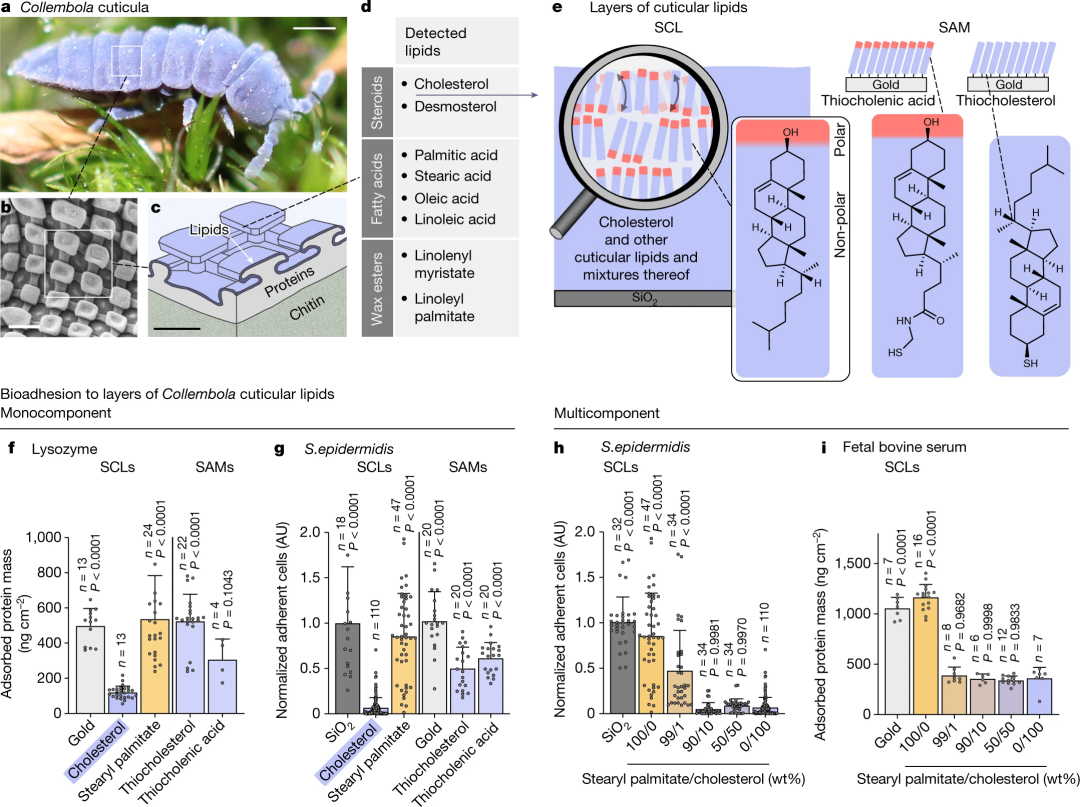
图1 |弹尾目动物角质脂层及其生物黏附特性
【胆固醇层适应周围环境的极性】
生物黏附实验结果表明,界面胆固醇的流动性是单组分和多组分SCLs抗黏附特性的关键。
基于AFM的力谱显示了浸泡在胆固醇中的SCLs的动态界面适应。疏水胶体探针或单个大肠杆菌细胞与胆固醇SCLs之间的相互作用力被量化,并被发现随着接触时间的延长而持续增加。进一步的分析表明,三级动力学控制着SCL界面的基本极性适应过程,以最大化疏水相互作用。用硫代胆固醇和硫代胆酸SAMs进行的对照实验证实,SCLs中的胆固醇流动性是观察到的适应的关键。
在空气中对胆固醇SCLs的动态润湿实验显示,当液滴在沉积后立即收回时,水接触角较高,表明在空气中调节的外层胆固醇的烃链优先朝向界面。如果在退去之前将水滴保持在表面20 s,则15-20 s的三相接触线发生振荡,随后静态接触角降低约10°。当液滴被取出时,观察到三相接触线的钉扎。胆固醇SCLs和AFM探针和单个细菌细胞之间的相互作用力增加的时间依赖性,以及胆固醇SCLs上后退的水接触角的减小,表明胆固醇SCLs的界面极性适应过程相对缓慢(即发生在几秒钟内)。也支持生物黏附力分析的结果,在胆固醇和硬脂酰棕榈酸酯的多组分SCLs中,低含量的胆固醇足以减少后退的水接触角,并增加与疏水AFM探针的相互作用力。
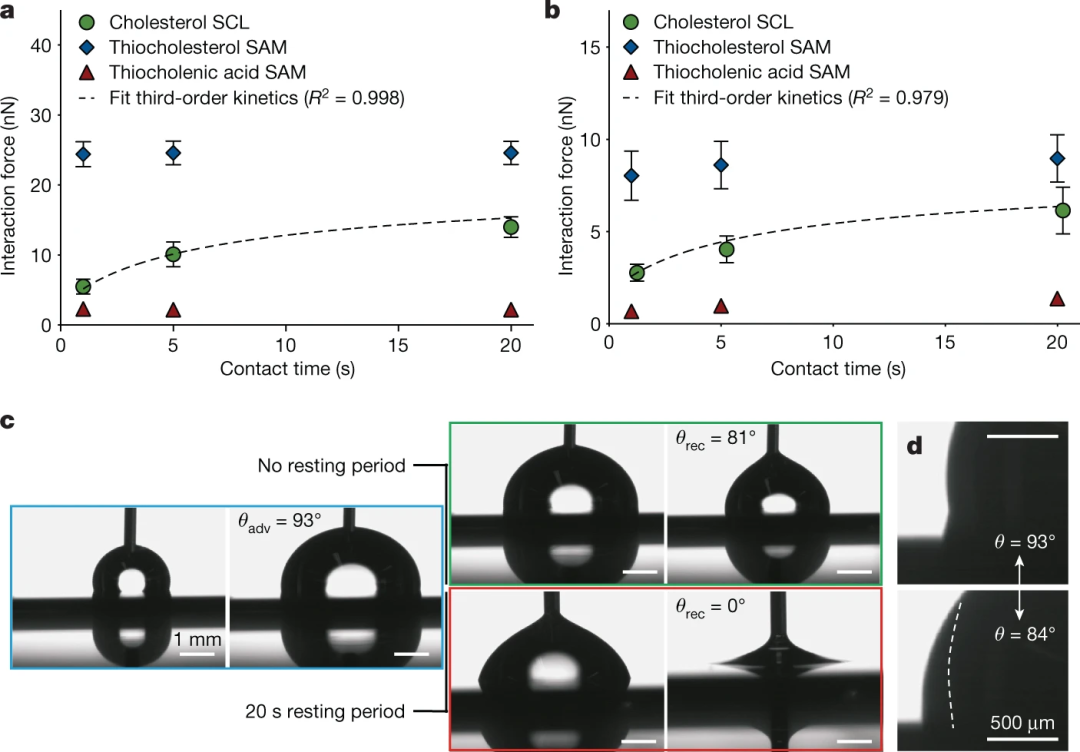
图2 |胆固醇SCLs动态适应环境的极性
【表面波动引起的熵排斥】
上面显示的含胆固醇的SCLs的抗菌黏附特性与胆固醇的界面取向随着环境极性的变化而动态适应相关。假设界面胆固醇分子的熵驱动取向波动在机制上将这些特征联系起来:生物分子的任何吸附或(细菌)细胞的附着都需要 SCLs 界面的取向(极性)适应,这限制了界面胆固醇的取向状态,从而降低了系统的熵。
为了验证这一假设,首先使用三种尺寸和复杂性不断增加的选定蛋白质:溶菌酶、白蛋白和纤维蛋白原,检验了熵效应对蛋白质吸附的特征温度依赖性。事实上,当温度从15℃上升到40℃时,蛋白质在胆固醇SCLs上的吸附被观察到减少,这与用硫代胆固醇和硫代胆酸自组装膜(在吸附的蛋白质下面定向固定的胆固醇SCL的对照)的类似实验中的微小变化形成对比。在热吸附平衡时,吉布斯自由能随温度的变化可以用来定量估算蛋白质在胆固醇超分子筛上吸附的排斥熵势垒(ΔSchol)。ΔSchol的这一值显示出显著的熵排斥力,抵消了与胆固醇SCLs的生物黏附。
通过分子动力学(MD)模拟探索了与水接触的多层胆固醇,并同样显示了分子取向波动的相关性。胆固醇分子在界面层中的取向关联函数表明,在1 nm的距离上有一个快速的衰减,证实了如上所述的少数(两个或三个)胆固醇分子的取向协同性。再加上观察到胆固醇多层界面层的高度垂直波动,MD模拟支持这样的观点,即胆固醇SCLs代表一个高度动态和波动的分子界面。在恒定位置重复的力-距离测量显示,胆固醇SCLs的变化比硫代胆固醇SAMs的变化要大得多,这为胆固醇在SCL界面上的取向波动提供了证据。
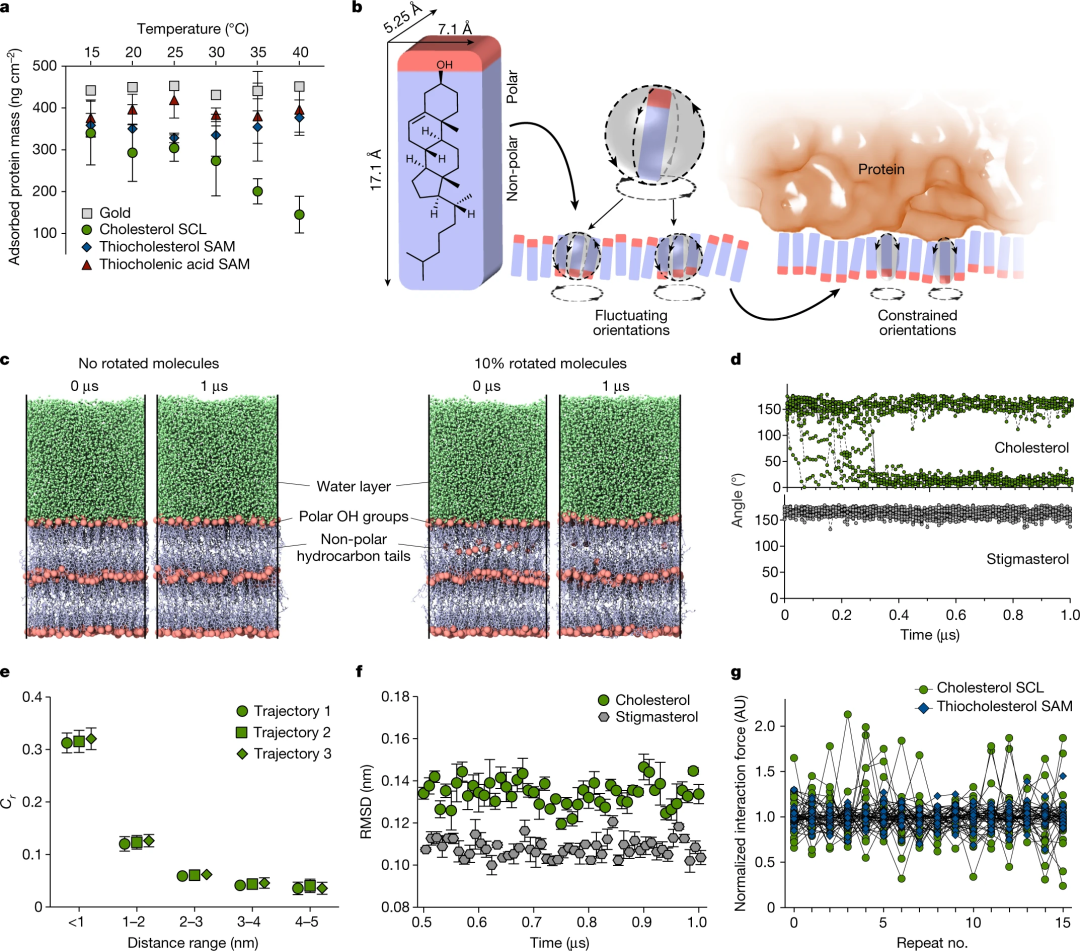
图3 |胆固醇SCLs熵排斥的定量证据及其分子机制的验证
【胆固醇类似物层的生物黏附】
由含胆固醇的SCLs界面的取向波动引起的生物黏附的熵屏障的发现提出了一个问题,即这种效应背后的关键结构特征是什么。因此,比较了由结构相关的胆固醇类似物制备的SCLs在细菌黏附和蛋白质吸附方面的生物黏附特性。结果证实,分子的两亲性对于低生物黏附性是必要的,但不是充分的,并表明即使是胆固醇分子结构的微小偏差也会强烈地降低其抗黏附性。只有脱氢胆固醇的SCLs接近胆固醇类似物的生物黏附指数。
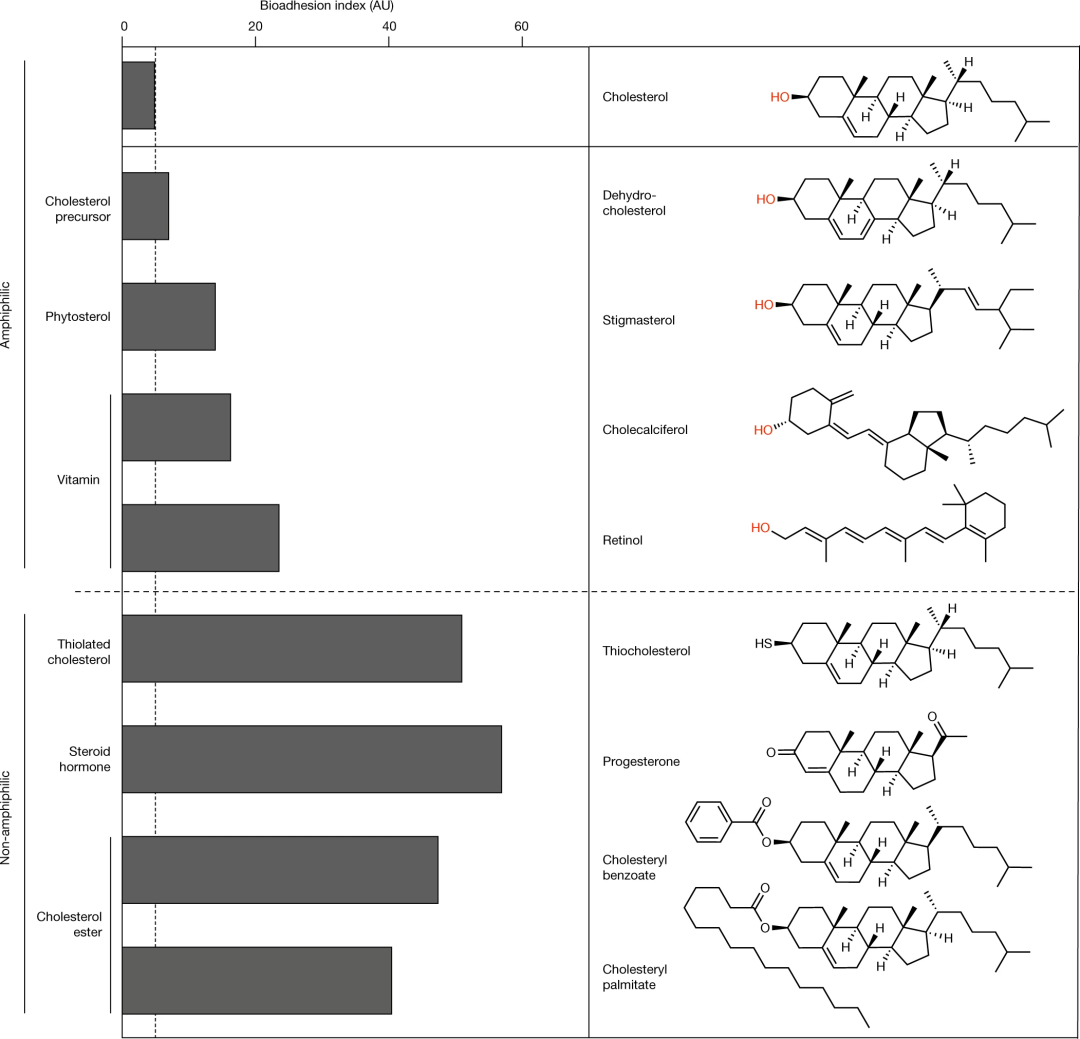
图4 |胆固醇类似物分子的SCLs显示出分级的生物黏附
【小结】
该研究结果表明,胆固醇以分子排列的方式组装,能够从熵上限制生物黏附。胆固醇的空间解耦两亲性与其在多层中的有效排列相结合,产生了缓慢适应的、协同的界面取向迁移率,被认为是显著的熵排斥的先决条件。MD模拟表明,对胆固醇有轻微结构修改的类似物的SCLs行为明显不同,在模拟时间内没有回复分子的自发回转。模拟还表明,豆甾醇SCLs比胆固醇SCLs的界面波动小得多,这表明胆固醇的特定分子间相互作用提供了高的界面流动性,并允许自发的分子波动。这些发现有力地支持了实验推导的能够产生熵排斥组装的两亲性分子的标准。探索抗黏附角质弹尾虫的组成防线,确定了导致有效熵排斥的含胆固醇层的物理化学特征。
鉴于胆固醇在组织边界的广泛存在,该发现可能会为生命物质重要而普遍的界面过程提供新的线索。开发以胆固醇为灵感的合成和可伸缩材料来控制生物黏附是非常有吸引力的,但需要对支配这一新发现的机制的分子要求进行进一步分析。
原文链接:
https://www.nature.com/articles/s41586-023-06033-4
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言