Cancer Treat Rev:弥漫大B细胞淋巴瘤的治疗策略
2022-09-06 聊聊血液 聊聊血液
弥漫大B细胞淋巴瘤 (DLBCL) 是非霍奇金淋巴瘤 (NHL) 中最常见的亚型。抗 CD20 单抗 (moAb) 利妥昔单抗联合化疗显著改善了DLBCL的结局,目前认为DLBCL在标准一线化学免疫治
弥漫大B细胞淋巴瘤 (DLBCL) 是非霍奇金淋巴瘤 (NHL) 中最常见的亚型。抗 CD20 单抗 (moAb) 利妥昔单抗联合化疗显著改善了DLBCL的结局,目前认为DLBCL在标准一线化学免疫治疗方案R-CHOP下可治愈。然而事实上,只有部分患者可从这种治疗中获益,仍有30-40%的患者难治或在初始缓解后复发。
为了在一线治疗中进一步改善DLBCL患者的结局,过去十年中有许多学者进行了努力,并使用复发/难治性 (R/R) 患者的新疗法。基于此,意大利Strada Provinciale教授牵头对截至2022年6月PubMed、NCCN和欧洲肿瘤内科学会威廉亚洲博彩公司 的论文以及主要国际会议论文集(例如ASH、ASCO和国际恶性淋巴瘤会议等)的摘要进行文献检索并撰写综述,重点关注一线和复发/难治性晚期DLBCL中获批和正在研究的新治疗策略,文章发表于近日的《Cancer Treatment Reviews》(IF=13.608)。现翻译全文供大家参考。

一线治疗中较R-CHOP提高疗效
表1汇总了试图改善DLBCL一线疗效的几种策略。

提高治疗强度
改善一线治疗的尝试之一是使用更强化的化疗方案。首个尝试就是R-CHOP14,它与标准R-CHOP21治疗相比,通过缩短为每2周给药一次而非标准的3周间隔试图改善R-CHOP疗效,但并未改善无进展生存期 (PFS) 或总生存期 (OS)。
LNH03-2B研究(表1中的[2])中,380例18-59岁未经治疗的DLBCL且aa-IPI评分等于1分的患者随机接受标准R-CHOP或R-ACVBP(利妥昔单抗、多柔比星、环磷酰胺、长春地辛、博来霉素和泼尼松)强化治疗,每2周重复一次。具体而言,R-ACVBP方案包括4个周期R-ACVBP的诱导期,以及包含不同治疗次序的后续巩固期(2个周期甲氨蝶呤,4个后续周期利妥昔单抗联合依托泊苷和异环磷酰胺,最后2个周期阿糖胞苷,每2周给予一次巩固疗程)。此外两个研究组患者在前4个周期的第1天均接受鞘内甲氨蝶呤治疗。该试验达到主要终点,R-ACVBP组3年估计无事件生存率 (EFS) 为81%,R-CHOP组为67%(风险比 [HR]= 0.56,p= 0.0035);此外R-ACVBP组中也观察到3年估计PFS率 (87% vs 73%;HR= 0.48) 和 OS 率 (92% vs 84%;HR= 0.44) 增加,但血液学副作用发生率同样增加。该方案的积极作用是由于治疗期间疾病进展率较低,达到完全缓解的患者复发较少,但尚不知道R-ACVBP方案的哪个阶段能改善结局。然而,尽管对比R-CHOP的结果为阳性,但R-ACVBP的价值也受到了阻碍,归咎于仅在相对低危的亚组(即aa-IPI 1)中改善疗效及其毒性增加而限制了广泛使用。
大剂量化疗 (HDC) 和自体干细胞移植 (ASCT) 作为一线治疗巩固治疗的作用已被3项研究研究探讨。在Chiappella等的DLCL04研究中(表1中的[3]),399例高危(aa-IPI评分2-3分)年轻患者(18-65岁)采用2 × 2析因设计(factorial design),随机接受两个不同剂量水平的利妥昔单抗剂量密集化疗(R-CHOP或R-MegaCHOP)全疗程治疗,或短疗程利妥昔单抗剂量密集化疗后R-MAD(利妥昔单抗、高剂量阿糖胞苷、米托蒽醌和地塞米松)巩固和大剂量BEAM化疗(卡莫司汀、依托泊苷、阿糖胞苷和美法仑)后ASCT。该研究达到了主要终点,达到了改善的2年无失败生存率(移植组 71% vs 无移植组62%;HR= 0.65)。然而由于复发或进展患者接受了HDC联合ASCT的有效挽救治疗,这两组之间未观察到5年OS差异 (78% vs 77%,HR= 0.98)。
其他两项随机研究也探索了HDC联合ASCT相对于R-CHOP或R-CHOEP作为一线巩固治疗的作用,其结果相似。在第一项研究中,HDC和 ACST强化治疗可改善PFS,但OS未改善,第二项研究则未显示HDC优于R-CHOEP。总体而言,这些结果不支持将HDC + ASCT作为预后不良DLBCL患者的一线策略。如 Le Gouill等所示,基于中期PET评估,该策略在R-CHOP缓解缓慢的特定患者中的作用有限。
Alliance/CALGB 50303研究(表1中的[7])比较了6周期的DA-EPOCH-R(剂量调整的依托泊苷、泼尼松、长春新碱、环磷酰胺、多柔比星和利妥昔单抗)与标准R-CHOP作为DLBCL 一线治疗。与标准R-CHOP相比,更强化的DA-EPOCH-R方案未显示PFS(2年 PFS 率78.9% vs 75.5%)和OS(2年 OS 率86.5% vs 85.7%)改善,且毒性发生率增加。事后分析发现与R-CHOP组相比,IPI评分为3-5分的患者接受DA-EPOCH-R后PFS更优但 OS 无获益。值得注意的是,与历史对照相比标准治疗组的结局更有利,作者认为这可能是由于患者选择偏倚,从而可能掩盖了特定高危亚组的潜在获益。在一项回顾性研究中,Dodero等在114例双表达DLBCL(即MYC和BLC2蛋白过表达)患者中评估相同的DA-EPOCH-R方案与R-CHOP方案。在整个研究人群中,这两种方案的OS和PFS相似,但<65岁的患者中DA-EPOCH-R方案2年PFS为82%,显著优于R-CHOP,表明该方案在该特定患者中可能发挥作用;仅在年轻患者中显示疗效,这一结果可解释为这些患者接受的化疗累积剂量较高。
替代的CD20单抗
大型、随机 III 期GOYA研究(表1中的[9])评估了二代抗CD20单抗奥妥珠单抗在DLBCL的疗效。在研究中,1418例未经治疗的DLBCL随机接受奥妥珠单抗+ CHOP (G-CHOP) 或标准R-CHOP。两组间未观察到生存期差异(G-CHOP组3年 PFS 率为70%,R-CHOP组为67%)。因此,与滤泡性淋巴瘤不同,该数据不支持在这种情况下使用奥妥珠单抗。
R-CHOP+X
另一个不同且有吸引力的策略是在标准R-CHOP中加入新型生物药物 (‘X’),无论是在诱导期还是作为维持期 (图1)。
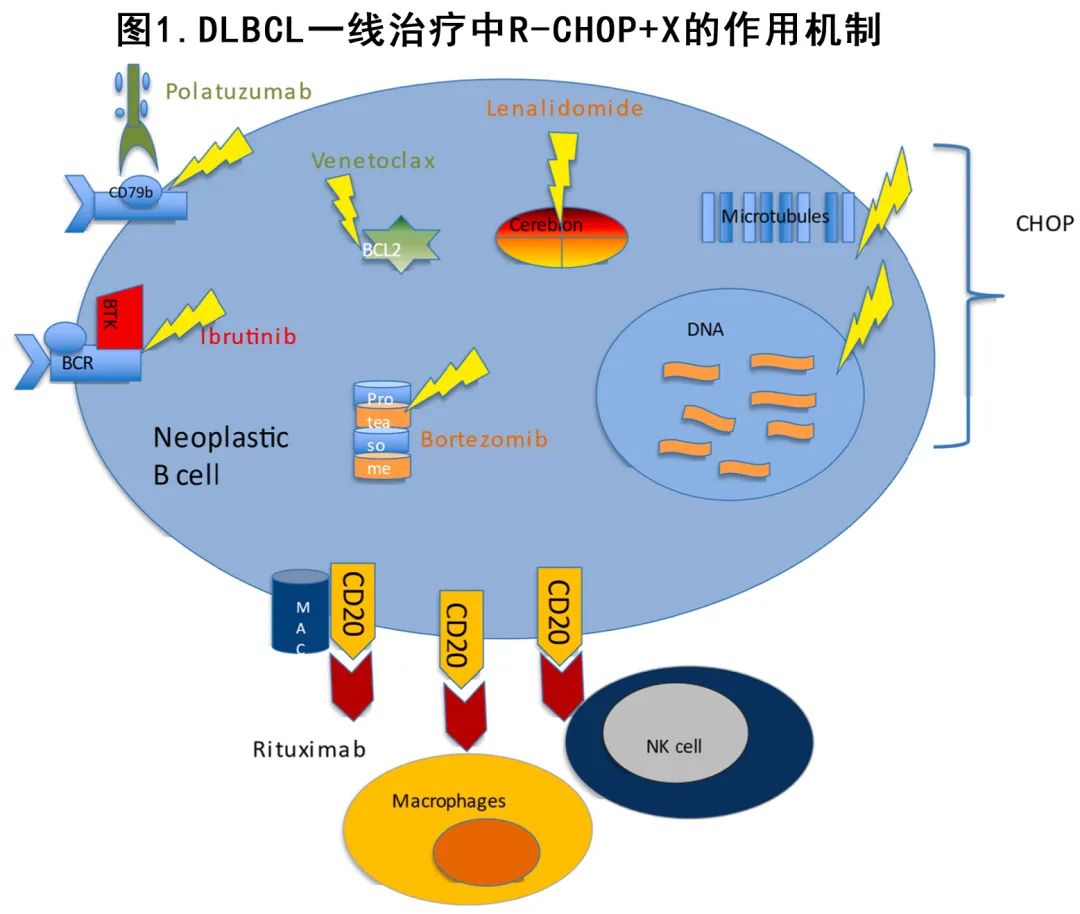
来那度胺在R/R DLBCL中显示出活性,并且在II期单臂研究中显示与 R-CHOP (即R2-CHOP) 联合给药在一线治疗中有获益,尤其是非GCB亚型。因此后续两项随机研究在未治疗的 DLBCL中检验了R2-CHOP并与R-CHOP进行比较。ECOG-ACRIN 癌症研究组的 II 期随机研究E1412(表1中的[10])纳入349例患者,结果表明R2-CHOP组在ABC亚型DLBCL中OS和PFS均获得改善。然而在 ROBUST III研究(表1中的[11])(纳入570例ABC-DLBCL 患者)中,添加来那度胺的给药方案与E1412研究略有不同(ROBUST研究中每21天/周期的第1-15天给药每日一次15 mg,而E1412研究中每个周期的第1-10天给药每日一次25 mg),结果并未改善PFS,但在高危(IPI评分≥3)患者中R2-CHOP有PFS优于安慰+/RCHOP的趋势。
与之相似,在II期PYRAMID研究和III期REMoDL-B III期研究(表1中的[12,13])中,硼替佐米+ R-CHOP (VR-CHOP) 同样未能改善结局;后者研究还根据起源细胞 (COO) 分类对患者进行分层,结局一致。有趣的是,R-CHO和 VR-CHOP治疗组双打击患者30个月PFS率分别为38.9%和58.8%,但该结果来自事后分析,差异无统计学意义。
伊布替尼已在R/R ABC DLBCL中表现出值得关注的活性,可能与表征该COO亚型的B细胞受体和NF-κB模式的慢性活化有关。但比较伊布替尼+ R-CHOP组与安慰剂+ R-CHOP组的随机III期PHOENIX研究结果令人失望,主要终点 (EFS) 和次要终点均无显著改善。一项事先计划的探索性分析(表1中的[14])显示治疗组与年龄间存在显著交互作用:<60岁亚组中,伊布替尼+ R-CHOP组改善转归且安全性可控,而高龄亚组中加入伊布替尼与毒性增加相关,从而导致治疗给药受损和结局恶化。为了改善PHOENIX的结果,正在进行的 III 期研究ESCALADE(NCT04529772) 限制性入组年轻未治疗的non-GCB DLBCL 患者(年龄≤65岁),随机接受R-CHOP 或R-CHOP +阿可替尼治疗。
最近,POLARIX研究(表1中的[15])探索了一种改良方案,其中长春新碱被Polatuzumab vedotin取代(pola-R-CHP);由于神经毒性的风险重叠而从治疗方案中排除了长春新碱。在这项III期安慰剂对照研究中,与标准 R-CHOP 相比,pola-R-CHP降低了既往未经治疗的中/高危DLBCL(IPI评分≥2)患者的进展、复发或死亡风险,2年PFS为76.7% vs 70.2%(HR= 0.73);探索性亚组分析显示,年龄<60岁、GCB DLBCL、大包块或 IPI 低评分患者无明显获益。此外两组之间的完全代谢缓解无差异, 2年 OS 也无显著差异 (88.7% vs 88.6%),但这可能原因在于随访较短和随后的有效治疗,然而未来仍需要随访更充分的研究来阐明 pola-R-CHP 在不同亚组中的不同效果。
II 期 CAVALLI 研究(表1中的[16])评估了选择性 BCL-2 抑制剂维奈克拉加入R-CHOP,尤其是在 BCL-2 过表达的预后不良人群中。虽然这是一项单臂非随机研究,作者仍将结果与 GOYA 研究中匹配的 R-CHOP 对照进行比较。本研究的主要终点 PET 完全缓解 (CR) 率,整体患者为69%,BCL-2患者为64%,双表达患者为66%;与 GOYA 队列相似。有趣的是在总体人群中,与匹配的 GOYA 对照相比,CAVALLI研究中2年PFS(次要终点)增加,这主要是由 BCL-2 过表达患者所驱动 (78% vs 62%;HR= 0.55),表明 维奈克拉诱导的缓解更深且更持久。此外加入维奈克拉导致血液学毒性和感染率升高,但这些并未转化为毒性死亡风险增加,且CAVALLI中 R-CHOP 的剂量强度维持在与 GOYA 相似的水平。所以这项研究为在进一步的 III 期研究中探索这种组合提供了理由。
最后,有许多药物在标准 R-CHOP 诱导后作为维持治疗进行了研究,但结果并不令人满意。在 NHL13 研究中,利妥昔单抗维持治疗未延长EFS、PFS或OS,在 Prelude 研究中使用PKCβ 抑制剂 Enzastaurin 和 PILLAR-2 研究中使用依维莫司也获得了相似的结果。但在 REMARC 研究(表1中的[20])中,来那度胺维持治疗24个月可显著延长老年(60-80岁)患者的PFS(来那度胺维持治疗组中位PFS未达到,安慰剂组为58.9个月 [HR= 0.708)。该结果在所有分析的亚组中一致,但未见OS 改善。这是第一项显示维持治疗可延长 R-CHOP 治疗缓解后 DLBCL 患者 PFS 的随机研究。
挽救化疗和ASCT
目前R-CHOP后 R/R 的 DLBCL 患者的标准治疗策略以铂类药物化疗和HDC-ASCT为代表。ASCT的作用于1995年首次评估,当时 PARMA 研究证实,2个周期的挽救化疗(DHAP–地塞米松、高剂量阿糖胞苷和顺铂)后HDC(BEAC–卡莫司汀、依托泊苷、阿糖胞苷和环磷酰胺)联合ASCT,与6个周期 DHAP 相比可改善EFS和OS。
随后几项研究致力于改善移植结局,主要是修改挽救或预处理方案。在 III 期 CORAL 研究 中,与 R-DHAP 相比R-ICE(利妥昔单抗、异环磷酰胺依托泊苷和卡铂)挽救治疗方案的缓解率相似 (62.8% vs 63.5%),EFS(3年时26% vs 35%)或OS(3年时47% vs 51%)也无显著差异;该试验还包括二次随机,在使用BEAM(卡莫司汀、依托泊苷、阿糖胞苷和美法仑)预处理后ASCT然后随机至利妥昔单抗或安慰剂维持治疗,然而结局无差异。由于该数据,不建议在 ASCT 后进行利妥昔单抗维持治疗。
NCIC-CTG LY研究中也观察到相似的结果,GDP(吉西他滨、地塞米松和顺铂)与 DHAP 相比缓解率相似 (45.2% vs 44%),EFS和 OS 也无差异,但毒性更低。这些研究还强调了该背景下影响缓解率的最相关预后因素。在 CORAL 研究中,诊断后12个月内复发、复发时 aa-IPI 评分 (saaIPI) >1和既往利妥昔单抗治疗与预后较差相关;CORAL 研究的回顾性分析也证实了 COO 状态的预后价值:GCB样 DLBCL 对 R-DHAP 的缓解率似乎优于R-ICE。因此上述方案的结果相似,挽救治疗的选择应考虑合并症、临床医生经验和病理学特征,首选R-DHAP,尤其是GCB 样 DLBCL。
尽管没有预处理方案被证明更优,但通常首选BEAM。利妥昔单抗也可纳入预处理方案,但未显示明显获益。
如前所述,影响移植后结局的最重要因素是对一线治疗和挽救治疗方案的反应。例如 CORAL 研究中,诊断后12个月内复发的患者中仅46%对挽救治疗有反应,而12个月后复发的患者中88%有反应;这种不同的缓解率也反映在EFS的较大差异(3年时分别为23%和64%)。此外,CORAL和 NCIC-CTG LY.12研究中只有一半的患者接受了ASCT,这主要是由于挽救治疗方案失败。与之相似的是,在 PET 时代,多项研究表明移植前未达到 PET 阴性状态的患者复发风险较高。
总而言之,ASCT在远期复发和化疗敏感R/R DLBCL患者的治疗中仍具有主要作用,然而诊断后12个月内复发的患者与移植时未达到 PET 阴性 CR 的患者一样,需要新的策略。
CAR-T疗法
R-CHOP 治疗失败、不适合移植或对HDC-ASCT 复发/难治的 DLBCL 患者标准化疗下预后极为不佳,而CAR-T 是治疗包括 DLBCL 在内的 B 细胞恶性肿瘤的有效方法。抗 CD19 CAR-T疗法包括清淋化疗(通常基于氟达拉滨加环磷酰胺或苯达莫司汀),随后进行单次 CAR-T 输注。目前有三种 CAR-T 产品可用于 DLBCL 治疗:Axicabtagene ciloleucel (Axi-cel)、Tisagenlecleucel (Tisa-cel) 和Lisocabtagene maraleucel (Liso-cel),其特点是疗效相似,但结构差异主要来源于不同的共刺激结构域(Axi-cel为CD28,Tisa-cel 和 Liso-cel 为4-1BB及Liso-cel独特的CD4+/CD8+平衡比值。在3项关键性研究ZUMA-1 (Axi-cel)、JULIET (Tisa-cel) 和 TRANSCEND NHL 001 (Liso-cel) 中,3种产品在既往≥2线治疗后的 DLBCL R/R 方面均表现出较高疗效:不同研究中 ORR 范围为52-83%,CR为40%-58%,中位 PFS 为5.9个月至NR,DOR为11-23个月。但CAR-T的特殊毒性(如CRS和神经毒性)也值得关注,在 ZUMA-1 中93%的患者(11% ≥3级)、JULIET中93%的患者(21% ≥3级)和 TRANSCEND NHL 001 中42%的患者(2% ≥3级)发生CRS,而ZUMA-1 中64%的患者(32% ≥3级)、JULIET中58%的患者(12% ≥3级)和 TRANSCEND NHL 001 中30%的患者(10%≥3级)发生神经毒性。目前认为CAR-T 是 R/R DLBCL 三线治疗的金标准,来自美国和欧洲的真实世界数据也证实了其疗效。
CAR-T在二线治疗
CAR-T 在三线治疗的令人印象深刻的结果促使人们测试它们作为难治性 DLBCL 的二线治疗。已经有三项大型随机 III 期研究在一线治疗无反应或在12个月内复发的难治性 DLBCL 患者中比较三种 CAR-T 产品和挽救性铂类药物化疗后HDC-ASCT(标准治疗,SOC)。ZUMA-7研究(Axi-cel vs. SOC) 和 TRANSFORM 研究(Liso-cel vs. SOC) 分别随机分配了359例和194例患者,证明了两种 CAR-T 产品较SOC的优效性,包括治疗缓解(CR 65% vs. 32%和66% vs.39%)和生存期(中位 EFS 分别为8.2个月vs. 2个月,10.2个月vs. 3.1个月)[41,42]。然而BELINDA 研究未观察到 Tisa-cel 和 SOC 之间的差异CR 28.4 vs.27.5%,中位 EFS 均为3个月)。上述研究的结果差异可部分解释为研究设计的一些差异,包括 ZUMA-7 不允许桥接治疗,其可能选择了疾病侵袭性较低的患者,此外相较于ZUMA-7研究的13天, BELINDA 研究中的 CAR-T 生产时间更长 [美国为23.5天,非美国国家为28天]。此外有趣的是,在3项研究中,入组了>75岁的患者(ZUMA-7中最大年龄为81岁,BELINDA中为79岁,TRANSFORM中2例 >75岁)。ZUMA-7 的积极结果为 DLBCL 确立了新的疗法突破,Axicel成为首个 FDA 批准的用于一线治疗无效或12个月内复发的患者的 CAR-T 产品。
CAR-T治疗失败的机制
超过1/3的 R/R DLBCL 患者可通过 CAR-T 治疗治愈,然而其中相当一部分患者仍会复发且结局较差。已知的CAR-T治疗失败原因与患者和疾病特征、CAR-T产品的特征和肿瘤细胞逃逸机制有关。
输注前因素在 CAR-T 疗效中起关键作用,细胞产品的生成需要足够的绝对淋巴细胞计数和较长的生产时间(某些情况下可达115天)。第一个输注前因素主要表现为既往治疗的数量,CAR-T 治疗逐渐移至二线治疗可以克服这一问题,正如ZUMA7、BELINDA和 TRANSFORM 研究所示,或最终移至一线治疗,正如 ZUMA-12 研究设计所示 Axi-cel 作为高危 DLBCL 患者一线治疗的一部分)。第二个输注前因素在于患有高度增殖性疾病这一限制因素。为了克服这一弱点,未来几年生产 CAR-T 更快的方案正在走向临床。
产品特征的差异也可能影响其抗肿瘤活性,CAR-T 疗法的疗效受细胞产品表型组成的影响。与 T 细胞表型分化程度较高的产品相比,中央记忆 T 细胞富集的 CAR-T 产品具有更高的细胞毒活性。
CAR-T 失败的另一个机制与其功能障碍和杀伤潜力的降低有关。该因素可能与工程 T 细胞的内在功能障碍或暴露于免疫抑制性肿瘤微环境有关;微环境中的检查点抑制剂和抗炎分子会导致 CAR-T 耗竭,而它是临床结局的主要决定因素之一
CAR-T 失败的最后一个原因与异质性肿瘤细胞逃逸机制有关,其中最广为人知的是抗原丢失。CAR-T 对靶抗原的选择压力可导致抗原本身的表达缺失,超过2/3的急性淋巴细胞白血病患者接受抗 CD19 CAR-T 治疗后发生CD19阴性疾病复发;这种现象在淋巴瘤中定义较少,直到 Neelapu 等研究显示,高达30%接受 Axi-cel 治疗的 NHL 复发时为 CD19 阴性。肿瘤细胞“谱系转换”( lineage switch)是另一个耐人寻味的事件,可导致 CAR-T 失败,它表现为肿瘤在不同细胞系中的表型变化,以避免 CAR-T 疗法的选择压力。Zhang 等人2020年在BLOOD的一篇报告中便描述了套细胞淋巴瘤转分化至低分化肉瘤。
CAR-T时代的异基因干细胞移植
异基因造血干细胞移植 (allo-HSCT) 是首个确立过继细胞疗法在治愈血液系统恶性肿瘤中作用的治疗手段。Allo-HSCT 利用供者细胞识别肿瘤抗原和产生有效免疫应答的能力,被认为是 DLCBL 的潜在治愈性手段,尤其是ASCT 后复发或进展的既往重度预治疗的患者。
EBMT) 分析了1997年至2006年在既往 ASCT 后接受 allo-HSCT 的101例 DLBCL 患者,证实了 allo-HSCT 在具有挑战性的预治疗患者队列中的重要作用,3年非复发死亡率 (NRM) 为28.2%,3年 PFS 为41.7%,3年 OS 为53.8%。该分析还显示,ASCT后复发时间超过12个月的患者 PFS 更长;但本研究显示不同预处理方案之间无统计学显著差异。目前在缺乏前瞻性随机试验的情况下,清髓性预处理 (MAC) 或降低强度预处理 (RIC) 仍是可能的替代选择,而MAC似乎与较低的复发率相关,但与较高的 NRM 发生率相关;肿瘤负荷高且对挽救治疗反应不完全的侵袭性疾病很可能应首选 MAC。
即使 allo-HSCT 能为部分难治患者提供持久的疾病控制,但对该方案的一些担忧仍未完全解决。事实上,感染率和移植物抗宿主病 (GVHD) 可影响allo-HSCT 后的 NRM 和生活质量。
近年来,CAR-T细胞疗法彻底改变了 DLBCL 细胞治疗选择的格局,为 ASCT 后复发且既往接受过多线治疗的患者提供了一种突出的替代细胞免疫治疗。CAR-T 细胞还克服了 allo-HSCT 的部分典型问题,例如CAR-T细胞在输注前不需要控制疾病,这与 allo-HSCT不一样。
然而allo-HSCT仍可发挥作用,尤其是在 CAR-T 细胞治疗后失败的患者中。此外如果CAR-T 细胞不适合[例如无法进行单采的患者(即血细胞减少患者)或 CAR-T 细胞不可用的地区],应建议进行 allo-HSCT
未来allo-HSCT也可用作 CAR-T 细胞治疗后的巩固治疗以改善结局,尤其是在预后特别差或未达到 CR 的患者中,因此与细胞治疗团队严格合作,对于早期识别可能从allo-HSCT中获益的患者至关重要。
此外allo-HSCT时应尽量减少 NRM 和毒性,从而实现allo-HSCT转换为更安全的平台而纳入其他细胞疗法(不仅包括 CAR-T 细胞,还包括供者淋巴细胞输注),以达到越来越好的疾病控制。
CAR-T之外的新型挽救治疗
除 CAR-T 外,其他有前景的药物也正在成为 R/R DLBCL 的治疗选择(表2)。

Tafasitamab+来那度胺
Tafasitamab 是一种 Fc 增强的人源化抗CD19单抗,在 B 细胞恶性肿瘤中表现出活性,并与来那度胺具有协同效应,来那度胺能够增强自然杀伤细胞介导的、抗体依赖性的细胞毒(图2)。II 期多中心单臂 L-MIND 研究(表2中的[56])在不适合移植的R/R DLBCL 中评估了tafasitamab + 来那度胺 (tafa + LEN) 联合治疗。该疗程包括tafasitamab + 来那度胺最长12个月,随后 tafasitamab 单药治疗直至疾病进展。该方案非常高效,ORR为61% (CR 43%),中位缓解持续时间为21.7个月且毒性特征合理。基于该结果,2020年tafasitamab联合来那度胺获得FDA和EMA加速批准用于治疗不适合移植的R/R DLBCL。

一项观察性回顾性研究 RE-MIND2,比较了 L-MIND 研究与接受NCCN 和 ESMO 推荐的疗法治疗不适合移植的 R/R DLBCL 匹配患者人群的患者结局。在基于倾向性评分的1:1匹配分析中,相对于polatuzumab vedotin +利妥昔单抗和苯达莫司汀 (Pola-BR) 以及利妥昔单抗+来那度胺 (R2) ,tafa+ LEN显示出更好的 OS 和 ORR,并且结局与抗 CD19 CAR-T 相当,从而评论了其在 R/R DLBCL 背景下的高效,但其缺陷在于回顾性对照。
双特异性抗体
双特异性抗体 (BsAb) 是识别两种特异性抗原或表位的单抗,可使自体 T 细胞重定向对抗肿瘤细胞(图3)。最近已有多个不同抗 CD20 BsAbs 在R/R DLBCL 进行了研究,结果显示即使在多难治性患者中也具有良好的活性,并且安全性可控,表现为CRS和神经毒性事件的发生率较低,多为1-2级。
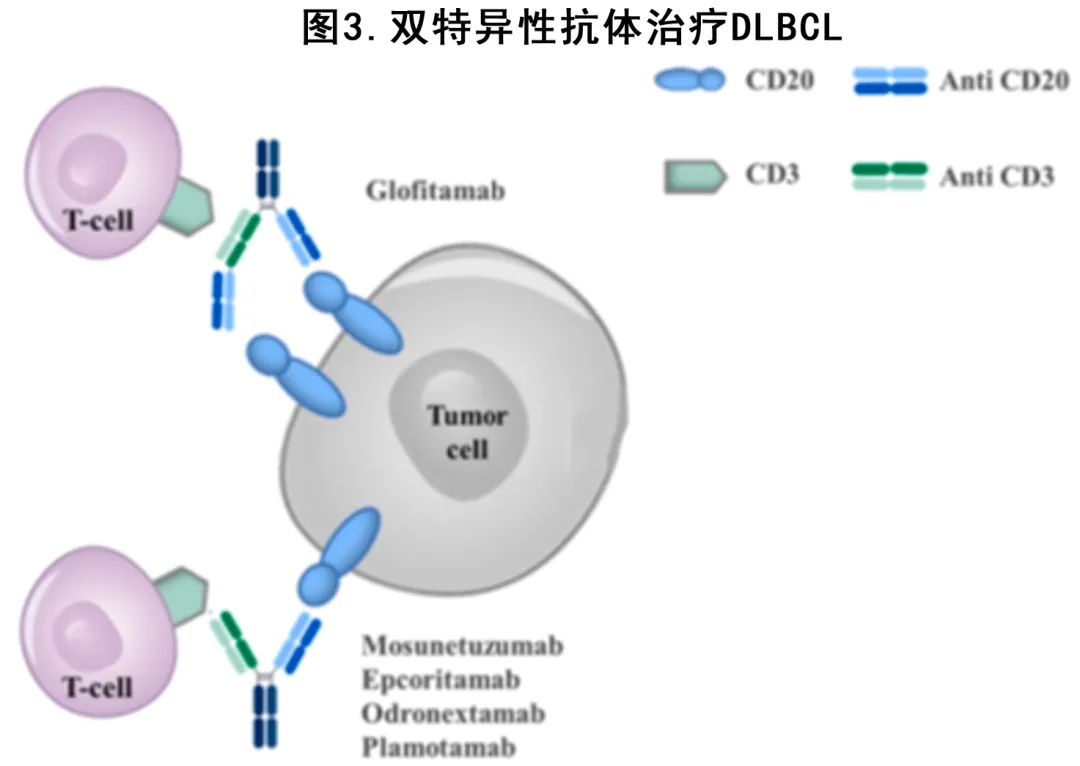
Mosunetuzumab 是一种全长全人源化IgG1 BsAb,可靶向 T 细胞和 CD20 阳性 B-NHL 细胞上的CD3。治疗R/R 惰性和侵袭性 BNHL 队列的剂量递增 I/Ib 期研究的最终结果显示,在所有药物剂量下,侵袭性 BNHL 亚组的 ORR 为34.9% (19.4% CR),所有缓解者的缓解持续时间 (DOR) 为16.8个月,其中CR患者为20.4个月。结果有前景且毒性可耐受,无剂量限制性毒性,CRS为27.3%且仅有1%为3级,4.1%的3级神经毒性事件;研究的扩展部分仍在进行中。
Glofitamab 是另一种 CD3 x CD20 BsAbs,其特征为2:1结构,由靶向 CD20 抗原的两个片段和单个 CD3 结合片段组成。其在奥妥珠单抗(1000 mg) 单次给药之前给药,目的是减少成熟循环 B 细胞并尽可能减少全身细胞因子释放综合征。在包含不同强化预治疗 B-NHL 亚型的 I 期试验中,在 R/R DLBCL 中观察到相当好的疗效:中位观察期27.4个月,全球的ORR 为41.1% (CR 28.8%),≥10 mg剂量组的ORR为55%(CR 42.1%),中位 DOR 为5.5个月,达到 CR 的患者中位DOR未达到。Glofitamab 治疗155例 R/R DLBCL 的关键 II 期扩展结果显示其持久缓解,ORR为51.6% (CR 39.4%),中位 DOR 为12.6个月(患者接受了大量预治疗,155例患者中有52例既往 CAR-T 治疗失败)。
Epcoritamab(GEN3013) 是第一种皮下CD3 x CD20 BsAb,其结合 CD20 抗原的表位不同于最常见的抗 CD20 单克隆抗体。其安全性可控,59%的 CRS 事件为1-2级,且对 R/R B-NHL 具有显著活性,包括全剂量 (12-60 mg) 下多发难治DLBCL(中位既往治疗次数为3)的 ORR为68% (45% CR)和最终推荐剂量(48 mg)下的ORR 88% (38% CR)。关键研究 (EPCORE NHL 1)的II 期 DLBCL 扩展队列的最新数据证实了 Epcoritamab 在 R/R DLBCL 中的活性:157例入组患者(61/157例 R/R于CAR-T)中ORR达63% (39% CR),中位 DOR 为12个月。
R/R NHL正中在研究的其他 CD3 x CD20 BsAbs 包括 odronextamab 和Plamotamab,其早期研究数据令人鼓舞。Plamotamab 的研究仍为初步研究,但odronextamab在一项 I 期剂量递增研究中显示对 R/R B-NHL 的持久缓解,尤其是当以>80 mg 的剂量给药时,既往未接受过 CAR-T 治疗的 DLBCL 亚组的 ORR 为60% (CR 60%),而对CAR-T R/R的患者的 ORR 为33.3% (CR 23.8%),中位 DOR 分别为10.3个月和2.8个月。odronextamab I 期研究的数据促使开展了 R/R B-NHL 的全球 II 期试验,目前正在进行中。
抗体药物偶联物
R/R DLBCL 中有两种ADC在发挥主要作用。
Polatuzumab vedotin:Polatuzumab vedotin单药治疗B-NHLs 具有一定疗效其耐受性良好,神经毒性是主要的治疗后出现的不良事件。在Sehn 等进行的 II 期随机研究中,polatuzumab vedotin联合利妥昔单抗和苯达莫司汀 (pola-BR) 较标准 BR疗效更好,包括缓解 (CR 40% vs. 17.5%) 和长期生存率(中位随访22.3个月;中位PFS 9.2 vs. 3.7个月,HR= 0.36;中位OS 12.4 vs. 4.7个月,HR= 0.42)。这些结果导致 FDA 和 EMA 批准 pola-BR 方案用于治疗不适合移植的R/R DLBCL。在最近发表的更新分析中,增加了106例接受 pola-BR 治疗的 R/R DLBCL 患者的扩展队列,方案证实了其疗效,达到38.7%的 CR 和持续生存率,但PFS 率降低:中位 PFS 为6.6个月,中位 OS 为12.5个月。pola-BR 治疗 R/R DLBCL 的真实数据缓解率相似,ORR范围为48%-60%,但 PFS 更短(3-5.6个月)。在 pola-BR 积极结果的驱动下,几项试验正在研究 polatuzumab 联合其他化学免疫治疗方案(如利妥昔单抗 + 异环磷酰胺、卡铂和依托泊苷 (polaR-ICE))作为适合移植患者 ASCT 前挽救治疗的疗效,以及比较polatuzumab + 利妥昔单抗,比较吉西他滨 + 奥沙利铂 (pola-R-GemOx) 对比 R-GemOx治疗不适合移植的 R/R DLBCL 的 III 期研究POLARGO。
Loncastuximab tesirine:
Loncastuximab tesirine 由人源化抗 CD19单抗与吡咯苯二氮卓二聚体细胞毒性烷化剂 tesirine(SG3199) 组成,在 I 期研究中表现出安全的毒性特征,基于多中心 II 期 LOTIS-2 试验的结果,其于2021年中获得 FDA 加速批准用于治疗R/R DLBCL。在 LOTIS-2研究中,145例重度预治疗 DLBCL 患者(中位既往治疗线数为3)接受了 loncastuximab tesirine 静脉给药,每21天一次,最长持续1年或直至疾病进展或出现不可接受的毒性。ORR为48.3% (CR 24.1%),9个月 DOR 为64%,中位 PFS 和 OS 分别为4.9个月和9.9个月。一项尚未招募的 I 期多臂研究将评估loncastuximab tesirine 联合几种化疗或生物制剂(包括吉西他滨、来那度胺、polatuzumab vedotin或 PI3K 抑制剂umbralisib)治疗 R/R B-NHL 的活性。为了提高其疗效,R/R DLBCL 和套细胞淋巴瘤的2期单臂研究(LOTIS-3)也将 loncastuximab tesirine 与伊布替尼联合使用;最近报告的前35例患者初步结果证实了ORR 改善57.1% (CR 34.3%),但需要更多随访时间更长的数据来证实联合治疗是否优于单药治疗。
早期采用免疫治疗
创新疗法(如tafa + LEN、BsAbs和CAR-T)治疗 R/R DLBCL 的积极结果,促使人们尝试将其引入一线治疗。
在first-MIND Ib 期研究中,新诊断的 DLBCL 患者随机接受tafa + R-CHOP或tafa + LEN + RCHOP治疗。两种联合方案的毒性均可接受,与标准 R-CHOP 方案的预期毒性相似。这促使启动一项 III 期多中心随机双盲研究 (frontMIND),以比较 R-CHOP 与三联方案tafa + LEN + R-CHOP治疗未经治疗的高危 DLBCL 的安全性和疗效,该研究正在进行中。
在 CD3xCD20 BsAbs 领域,许多药物正在一线研究中加入标准 R-CHOP。在一项包含 R/R B-NHLs 和新诊断高危 DLBCL 的研究中,未经治疗的 DLBCL 亚群中有27例可评估患者,mosunetuzumab联合 CHOP 的CRS可控(≤2级)且无神经毒性,ORR为96% (CR 85%)。目前正在 I/II 期研究中探索mosunetuzumab作为R-CHOP一线后疗效不理想(SD或PR)的 DLBCL 患者的巩固治疗,或莫司妥珠单抗+/-Polatuzumab vedotin作为不适合化学免疫治疗的高龄/unfit患者的一线治疗的疗效。在对后项研究的初步分析中,mosunetuzumab单药治疗(B组)的结果良好,ORR为58%,CR为42%。目前正在 Ib 期研究 (NCT03467373) 中评估Glofitamab 联合 R-CHOP 治疗,包括 R/R B-NHL 和新诊断的DLBCL。DLBCL 队列安全性导入期部分的非常初步的数据显示了联合治疗的安全性,仅发生1例1级 CRS 事件,未发生神经毒性事件,在缓解可评估的患者中观察到4/4例 CR。在一项 I/II 期研究中,Epcoritamab联合各种标准治疗用于未经治疗和 R/R B-NHL 的安全性和疗效正在进行中,包括用于Epcoritamab+ R-CHOP联合治疗初治高危DLBCL 和Epcoritamab + Gemox联合治疗用于不适合移植或 CAR-T 失败的 R/R DLBCL。少量(33例)未经治疗的高危 DLBCL 患者的初步数据显示,Epcoritamab + R-CHOP联合治疗具有合理的毒性和令人鼓舞的抗淋巴瘤活性,52%的 CRS 均≤2级(除1例3级外),所有可评估患者(31例)均达到早期缓解 (ORR 100%,CMR 77%);在27例 R/R DLBCL 患者中,初步显示Epcortimab + Gemox安全(CRS 70%,除1例3级外均为1-2级)且疗效良好 (ORR 92%,CMR 60%)。
基于抗 CD19 CAR-T在二线或≥三线R/R DLBCL 中的良好疗效,该细胞疗法已被纳入高危DLBCL的早期治疗阶段。在 II 期 ZUMA-12研究中,高危DLBCL(定义为IPI≥3或双打击/三打击)且在2个疗程的抗 CD20-蒽环类药物治疗方案后中期PET呈阳性的患者给予 Axicabtagene ciloleucel治疗。研究的初步数据显示缓解快速且持久,ORR 89% (78% CR)、12个月PFS、EFS、DOR和 OS 分别为81%、73%、75%和91%,中位随访15.9个月中位PFS、EFS和DOR未达到。上述结果促使在高危DLBCL一线治疗中使用 CAR-T的进一步探索,这是基于一个假设,那就是既往治疗较少以及免疫系统更强的患者获益会增加。
精准医疗和量身定制
目前认为 DLBCL 是一种表型和遗传异质性疾病。起初根据 COO 定义DLBCL为ABC、GCB和无法分类三种不同亚型,随后在2016年世界卫生组织淋巴肿瘤分类修订版中得到认可。最近基于全外显子测序和结构基因组异常的两项独立研究定义了两种“分子学分类”,将 DLBCL 分为以可靶向基因改变为特征的几种亚型,从而为精准医疗的新时代铺平道路。在 Wilson等人最近的一项研究中,对 PHOENIX研究的非GCB DLBCL 患者进行扩展基因组分析,旨在确定对伊布替尼+ R-CHOP联合治疗有不同敏感性的分子学亚组。作者根据 Schmitz等的分类对患者进行分组,确定了MDC、BN2和 N1 分子学亚型的患者。定义为携带MYD88、CD79b或 NOTCH1 突变的 MDC 或 N1 的年轻受试者(年龄≤60岁)对伊布替尼更敏感,与标准组相比加用伊布替尼后结局显著改善,两种亚型的3年 EFS 分别为100%、42.9%和50%。在2021恶性淋巴瘤国际会议上公布了 Guidance-01 II 期研究的初步结果,在这项雄心勃勃的研究中,使用简化的靶向测序工具将128例新诊断的 DLBCL 分为6个亚组,包括 Schmitz等先前曾描述的4个亚型(MCD样、BN2样、N1样、EZB样)、TP53突变和其他。患者随后按1:1随机接受标准 R-CHOP 或R-CHOP + X治疗,根据分子亚组调节加入的药物:伊布替尼加入MCD 样和 BN2 样、去甲基化药物地西他滨加入TP53 突变、tucidinostat(组蛋白去乙酰化酶抑制剂)加入 EZB 样、来那度胺加入 N1 样和其他。在分析时可评估的107例患者中,R-CHOP +X组的缓解率较高(CR:对比标准队列分别为87%和66%),最终还带来了PFS的改善(1年 PFS 分别为96%和79%,HR= 0.22)。尽管样本量较小,但这项“概念验证性”研究可能提示量身定制的、基于机制的治疗策略具有潜在获益,并鼓励在该方向上进行进一步研究。
结论
自 R-CHOP 引入以来,已有许多学者努力改善 DLBCL 的结局,尤其是过去十年中变化很大,R/R患者中新的治疗改善了预期寿命。CAR-T的出现为化学免疫治疗无效的患者打开了新时代的大门,如今已经是R/R DLBCL的标准3线治疗,来自新研究的数据也允许它们作为难治性或早期复发患者的二线治疗。对于不适合移植的 R/R患者,联合 pola-BR 是一种新的选择,可改善既往无有效替代治疗患者的结局。最近新型药物在治疗无反应患者方面显示出令人印象深刻的结果,其中包括 FDA 和 EMA 已批准用于 R/R患者的tafa + LEN联合方案和 CD3 x CD20 BsAbs(它即使在重度预治疗患者中也显示出疗效)。
然而从另一方面说,尽管许多研究旨在改善一线治疗结局,但20年后标准治疗仍以 R-CHOP 为代表。虽然R-CHOP + X有许多不同的组合,但解释这一策略失败的原因并不容易。基于过于简单的亚组(GCB或ABC)靶向单个基因改变可能不够疗效,而导致淋巴瘤细胞通过其他途径逃逸。事实上DLBCL更复杂且具有异质性,正如最新的分子分类和在标准 R 化疗中添加多种新药的新型组合所示,也许基于某特定突变的策略可能成功机会更大。然而最近有些事情开始发生变化,在 POLARIX 研究中,R-CHOP联合X(即pola-R-CHP)首次显示优于R-CHOP,在 R-CHOP 基础上加用维奈克拉的 II 期 CAVALLI 试验似乎可改善 BCL-2 过表达的预后不良亚组的结局。此外正在进行的研究正在检测早期使用免疫疗法(First-MIND研究,tafa + LEN)联合R-CHOP一线治疗R/R 患者的疗效,也包括数项加入CD3 x CD20 BsAbs 的研究,如mosunetuzumab、epcoritamab和 glofitamab。
未来DLBCL一线治疗的真正突破可能表现为基于临床和分子特征而采用量身定制的个体化策略。Wilson 等对 PHOENIX 研究的分子分析揭示了这一发现,更深入的是 Guidance-01 研究的初步结果提示了向这一方向的转变。应鼓励进一步探索采用基于分子学的治疗策略,而将先进的测序技术转化为能够捕获不同遗传学亚组相关标签的简化平台,可能是增加这一策略可行性的下一步。
鉴于目前新的生物制剂和创新组合的动态格局,作者将2022年治疗 DLBCL 的可能策略总结于图4,但是正如一首著名歌曲所说“这是一个变革的时代”( “the times they are a-changing”),这一策略可能需要在不久的将来随着正在进行的研究发表结果而进行更新。

参考文献
Stefano Poletto,et al. Treatment strategies for patients with diffuse large B-cell lymphoma. Cancer Treat Rev . 2022 Jul 31;110:102443. doi: 10.1016/j.ctrv.2022.102443.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言











#细胞淋巴瘤#
105
#TREAT#
109
#B细胞#
61
#弥漫大B细胞淋巴瘤#有含金量
110