临床研究|12周索磷布韦联合可洛派韦治疗慢性丙型肝炎的效果和安全性分析
2023-08-11 临床肝胆病杂志 临床肝胆病杂志 发表于上海
盐酸可洛派韦是我国自主研发的DAA,为NS5A抑制剂,盐酸可洛派韦联合索磷布韦12周方案在Ⅲ期临床试验中显示出较好的疗效和安全性,但治疗CHC真实世界研究尚较少,本文对一组病例进行回顾分析,报告如下。
慢性丙型肝炎(CHC)是引起肝硬化、肝细胞癌(HCC)的重要原因,相关的肝病导致全球每年约39.9万例患者死亡[1-2]。直接抗病毒药物(DAA)主要作用于非结构蛋白NS3/4A蛋白酶、NS5A和NS5B聚合酶[3]。2013年以来,多种DAA进入临床,在CHC治疗领域全面取代干扰素联合利巴韦林(PR),成为治愈CHC最重要的药物[4-5]。NS5B RNA依赖的RNA聚合酶在HCV复制过程中发挥了重要作用,是DAA作用的重要靶点,多种DAA联合治疗方案包含有NS5B抑制剂。
中国CHC患者约980万[2, 6]。目前我国应用的DAA多数为进口药物,有研究[7-9]对比发现,中国和美国患者SVR并没有明显差异。盐酸可洛派韦是我国自主研发的DAA,为NS5A抑制剂,盐酸可洛派韦联合索磷布韦12周方案在Ⅲ期临床试验中显示出较好的疗效和安全性,但治疗CHC真实世界研究尚较少,本文对一组病例进行回顾分析,报告如下。
1资料与方法
1.1 研究对象
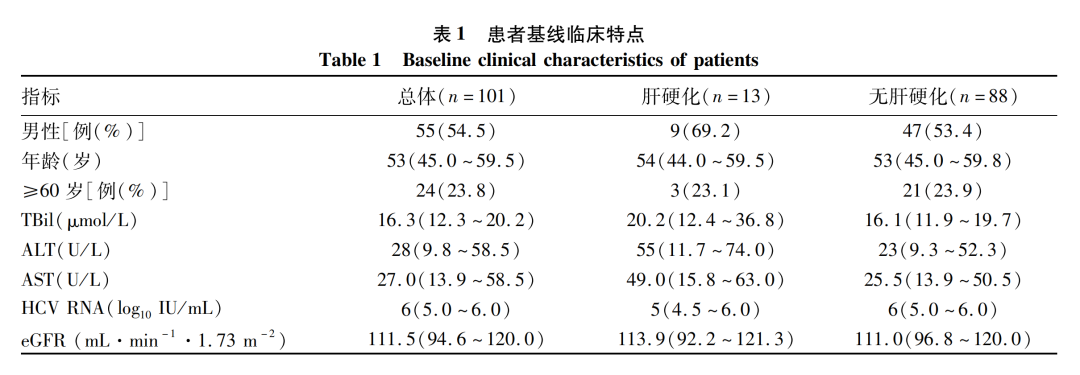
回顾性分析2021年7月1日—2021年12月31日空军军医大学第一附属医院、空军军医大学第二附属医院、西安交通大学第二附属医院、陕西省宝鸡市中心医院4家医院的101例CHC接受索磷布韦(400 mg)联合盐酸可洛派韦(60 mg)治疗12周的患者。纳入标准:(1)抗HCV阳性,HCV RNA阳性,无论是否合并肝硬化、HCC,无论既往是否接受过PR治疗或DAA治疗;(2)年龄≥18岁;(3)病史及检验资料齐全。排除标准:(1)合并HIV感染者;(2)实体器官移植者;(3)开始治疗前3个月内接受免疫抑制剂治疗,预期寿命低于12个月的终末期疾病患者。
1.2 研究方法
所有患者接受索磷布韦(400 mg),口服,1次/d,联合盐酸可洛派韦(60 mg),口服,1次/d,疗程12周,包括肝硬化患者或基因3型患者皆采用此方案,均未加用利巴韦林。患者基线检查项目包括血常规、肝生化指标、肾功能、甲胎蛋白、HCV抗体、HCV RNA定量、腹部B超。患者开始治疗前1个月内的检查结果作为基线资料;基线、治疗结束、治疗后12周行血常规、AFP、HCV RNA定量、腹部B超,肝纤维化扫描。
肝硬化诊断需达到以下标准至少1条:(1)肝活检纤维化分期4期;(2)肝脏硬度值>12.5 kPa;(3)临床、内镜、影像和实验室检查提示肝硬化伴或不伴有门静脉高压症[10]。
检测方法:HCV RNA定量试剂盒购自罗式诊断产品(上海)有限公司或湖南圣湘生物科技有限公司,检测下限为HCV RNA 15 IU/mL或100 IU/mL,依患者当时所在医院的检测条件,低于检测下限视为阴性。HCV基因分型采用HCV RNA基因分型PCR,试剂盒购自湖南圣湘生物科技有限公司或中山大学达安基因分司。
疗效指标:主要疗效指标包括12周持续病毒学应答(SVR12)(定义为治疗结束12周HCV RNA低于检测下限)。安全性方面主要观察治疗过程中估算的肾小球滤过率(eGFR)。次要疗效指标包括治疗前、治疗12周的血清总胆结素、ALT、AST。
2结果
2.1 一般资料
共101例患者纳入研究,患者平均年龄51.4(20~84)岁,男性占54.4%,女性占45.6%,13例(12.8%)患者基线存在肝硬化,无失代偿期肝硬化患者。3例为经治患者,其中1例为索磷布韦维帕他韦治疗后,1例为其他仿制DAA治疗后,1例为干扰素治疗后复发。合并用药的患者占22.8%(23/101):4例患者使用阿托伐他汀钙片,3例患者使用双环醇片,3例患者使用甘草酸二铵肠溶胶囊,2例使用扶正化瘀胶囊,2例使用肝爽颗粒,2例使用二甲双胍,2例使用胰岛素,1例使用阿斯匹林,1例患者使用谷胱甘肽片,1例患者使用安络化纤丸,1例使用消炎利胆片,1例使用硝苯地平缓释片。伴发疾病:糖尿病3例,高血压2例,酒精性肝病2例,冠心病1例,肝癌1例,肾恶性肿瘤1例,脂肪瘤1例。HCV RNA载量最小值1.97×102 IU/mL,最大值1.97×108 IU/mL,平均值log10值为6。
2.2 患者的基因型分布
患者基因型分布见图1,1型8%,2型60%,3型19%,无4型、5型,6型6%,未检测基因型7%。基因3型患者共19例(3a型12例,3b型7例),其中男性15例,女性4例,平均年龄49.3岁,5例合并肝硬化,HCV RNA载量log10平均值为6。
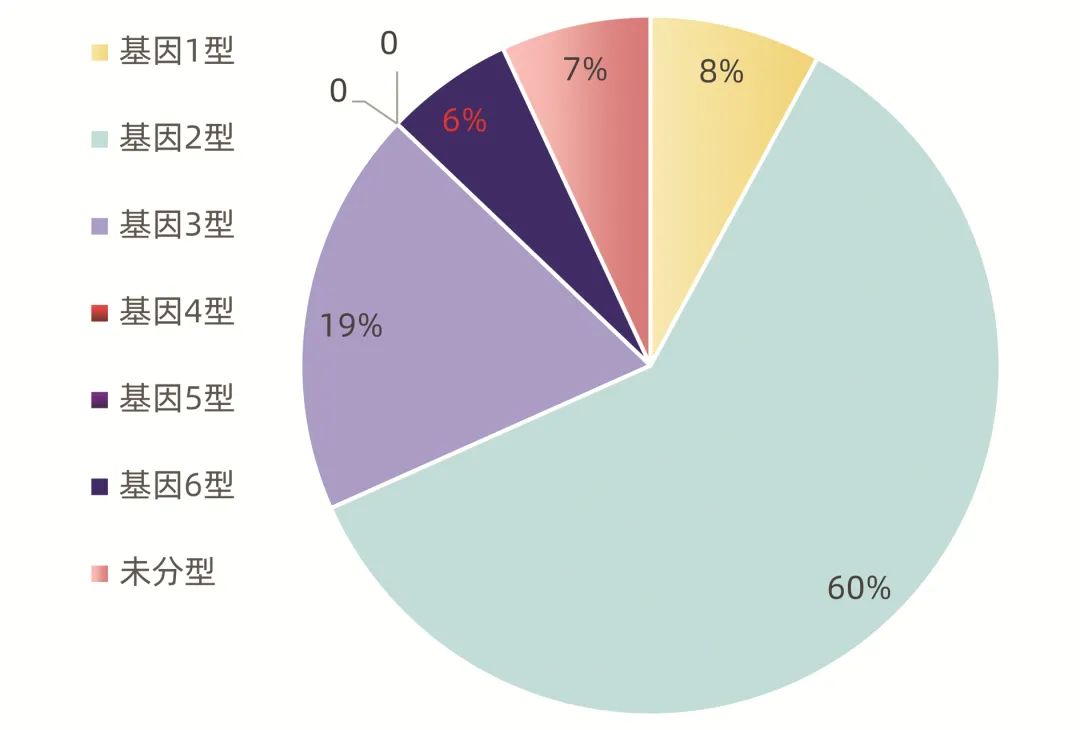
图1 患者基因型分布
2.3 病毒学应答情况
101例患者治疗12周时HCV RNA均阴转,SVR12率为100%,其中13例肝硬化、19例基因3型、3例复治患者均获得SVR12。
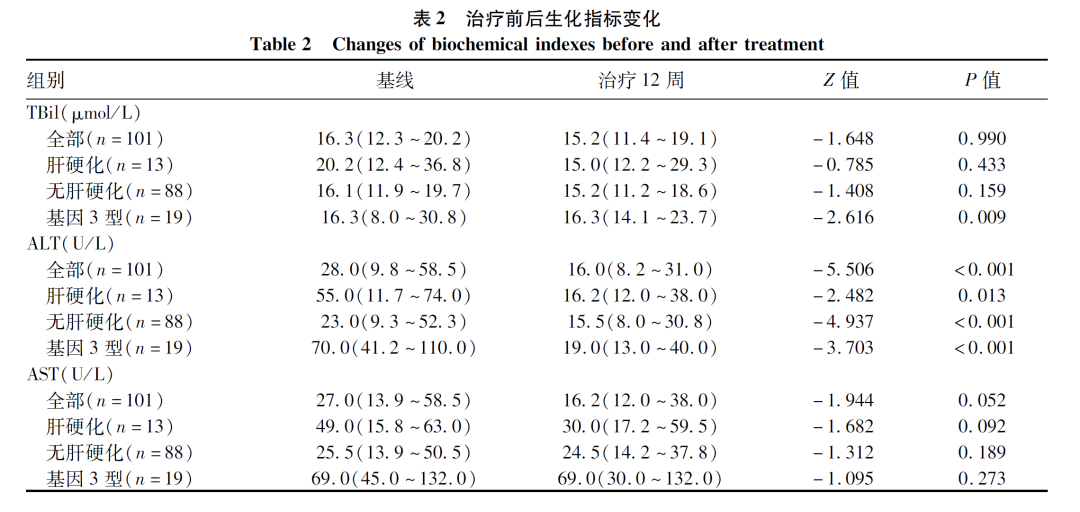
2.4 抗病毒治疗对患者生化指标的影响
治疗后基因3型患者TBil较治疗前有明显降低(P<0.05)。治疗后全部患者、肝硬化患者、无肝硬化患者、基因3型ALT均明显降低(P值均<0.05)。但AST在治疗前后变化没有显著变化。治疗前后患者生化指标变化情况见图2、表2。
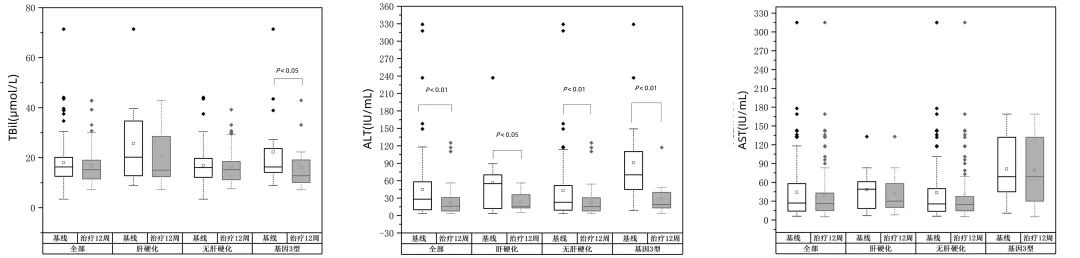
图2 治疗前后生化指标变化
2.5 抗病毒治疗安全性
治疗12周eGFR未见明显变化(表3,图3)。本组患者未见发生死亡,在12周治疗中有17例(16.8%)出现至少一种不良事件,任何不良事件发生率为16.8%,乏力(12.9%)最为常见(表4)。
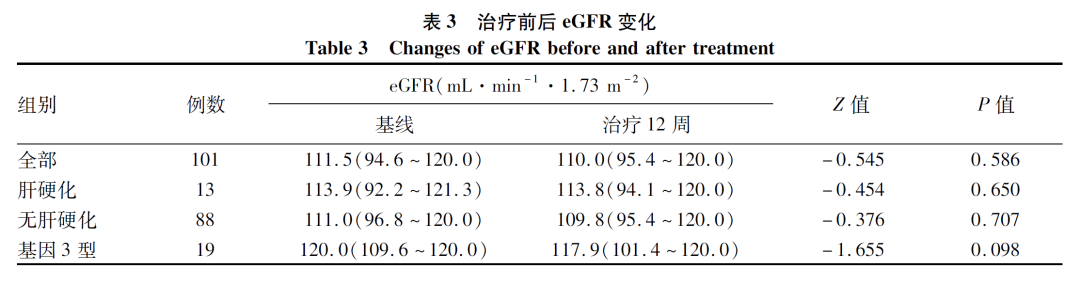
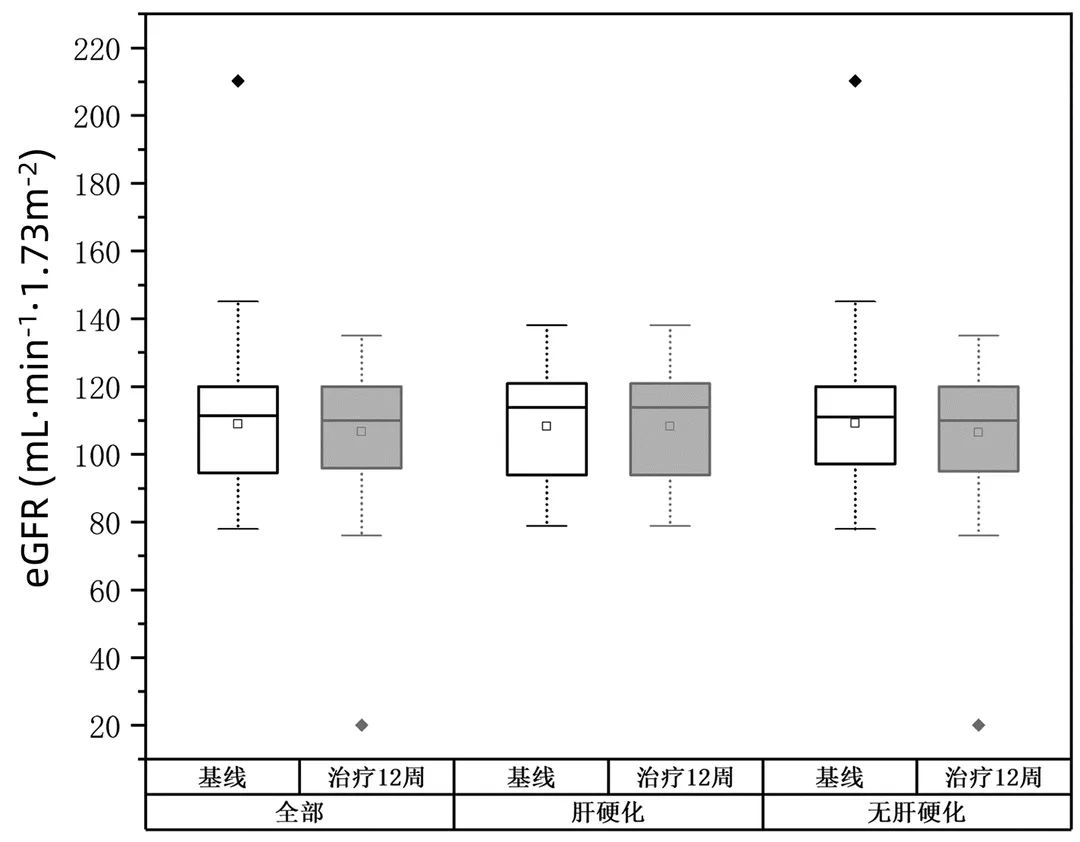
图3 治疗前后eGFR变化情况

3 讨论
本研究结果显示索磷布韦联合盐酸可洛派韦12周方案治疗CHC效果好,SVR12率不受基线因素,包括性别、年龄、既往治疗经历、基因型、病毒载量、肝功能的影响,在治疗12周肝生化指标明显改善,特别是ALT显著下降。
HCV有多个基因型和亚型,1b、2a、3a、3b和6a是我国的主要基因型,其中1b型在全国都有分布,占56%以上,其他基因型分别呈现出一定的地域差异[11]。本组病例中,基因1b型患者仅有8%,基因2a型达60%,与全国基因型分布总体比例不一致,其主要原因1b型患者选择基因特异型药物更容易得到医保支付,多数选择了基因特异性药物如艾尔巴韦格拉瑞韦、来迪派韦索磷布韦等。因此,基因2型患者成为本组病例的主要患者群。
HCV复发后的再治疗仍然是一个重要挑战,DAA初始治疗失败后重新治疗治愈率约为85%[12]。本组3例复治患者均取得了较好疗效,治疗后12周未见复发。基因3型特别是3b亚型,常可导致肝病的快速发展,在我国西南地区高流行,达26.7%~43.6%,在西北地区也较为常见[13-15]。基因3b型者对NS5A抑制剂有天然抗性,以索磷布韦为骨架的DAA方案在基因3型患者的SVR12低于其他基因型[16]。盐酸可洛派韦胶囊说明书中提到其Ⅱ期临床研究纳入110例受试者,其中7例3型受试者全部获得SVR12,提示盐酸可洛派韦可能在3型患者中有一定的优势。在Ⅲ期临床试验中盐酸可洛派韦联合索磷布韦联合治疗入组371例受试者,其中50例基因3型患者中有45例患者获SVR12,SVR12率达90%。本组研究纳入19例基因3型患者都取得了较好的疗效,与其临床试验结果一致,但病例数仍然较少,尚需大样本观察。
DAA治疗可以减少HCV相关早期肝癌根治术后的复发[17]。一组经过DAA治疗的28例HCV相关HCC患者,其术后3年无病生存率为69%,而未经DAA治疗的对照组3年无病生存率为35%,说明通过DAA治疗获得SVR可以减少HCV相关HCC的复发[18]。另外一项研究,对比经DAA药物治疗、干扰素治疗及未进行抗病毒治疗的HCV相关HCC,发现在根治后的HCV相关HCC患者中,DAA诱导的SVR患者的1年复发率高于接受干扰素抗病毒治疗的患者,但与未治疗的患者相比,DAA似乎没有增加HCC的复发率,通过多变量分析,与未治疗组相比,DAA是HCC复发的一个改善因素[19]。但也有研究[17]认为,在DAA治疗获得SVR的肝硬化患者中,肝组织中干扰素诱导基因表达也随之下降,从肝脏免疫微环境角度而言,并不利于阻止肝癌复发。本组纳入1例肝癌患者,表现出良好的安全性,未观察到与肝癌复发相关指标。有研究[20]表明,在DAA治疗获得SVR的患者中,肝纤维化进展的一些因素仍持续存在。因此获得SVR后仍需定期复查,观察病情变化。
DAA药物的总体安全性良好,即使在老年人群中亦表现出良好的安全性[21]。本研究中纳入24例老年患者,最大年龄84岁,均未出现严重不良事件,与上述结果一致。索磷布韦主要经过肾脏代谢,但是在一些轻中型慢性肾脏病患者也可以使用[22]。本研究中常用的降压药、降酶药、抗肝纤维化药物、糖尿病用药未发现明显影响。
本研究存在一些局限性:一是为本组病例为回顾性分析,主要观察的肝生化指标和病毒学指标以及eGFR、AFP、血常规、Alb等指标未进行比较,在指标设置方面不全面。二是肝硬化患者仅有13例,在统计结果中可能存在较大偏倚。三是观察时间较短,未对治疗前后肝纤维化的指标进行对比分析,未进一步观察SVR24,特别是复治患者,可能需要更长时间的观察。
综上所述,通过本组病例回顾分析初步显示盐酸可洛派韦联合索磷布韦治疗CHC患者耐受性良好,疗效佳,可以作为CHC治疗的推荐药物。有关盐酸可洛派韦联合索磷布韦在肝硬化患者、基因3型患者、经治患者、以及肾功能不全患者中的疗效和安全性,还需要大样本、多中心、前瞻性研究进一步观察。
全文下载:
张伟, 翟嵩, 杜虹, 等. 12周索磷布韦联合可洛派韦治疗慢性丙型肝炎的效果和安全性分析[J]. 临床肝胆病杂志, 2023, 39(3): 539-545.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言