FDA批准PDE3/4抑制剂ensifentrine用于成人COPD的维持治疗,这是首个吸入式疗法
2024-06-28 MedSci原创 MedSci原创 发表于威斯康星
慢性阻塞性肺病是一种进行性疾病,可引起肺部气流阻塞,导致呼吸困难。它影响全球大约3.84亿人,是全球第三大死亡原因。改善肺功能,减少急性加重和管理日常症状是此疾病管理中的重要治疗目标。即使是单次急性加
慢性阻塞性肺病是一种进行性疾病,可引起肺部气流阻塞,导致呼吸困难。它影响全球大约3.84亿人,是全球第三大死亡原因。改善肺功能,减少急性加重和管理日常症状是此疾病管理中的重要治疗目标。即使是单次急性加重也可能带来肺功能下降率的显著增加、生活质量的显著恶化,并可显著降低预期寿命,增加死亡风险。
今日,Verona Pharma公司宣布,美国FDA批准其“first-in-class”磷酸二酯酶3/4(PDE3/4)抑制剂Ohtuvayre(ensifentrine)作为维持疗法治疗慢性阻塞性肺病(COPD)成人患者。这是具有支气管扩张和非类固醇抗炎作用的首个吸入式COPD疗法。此外,ensifentrine也是20多年来具有新作用机制、用于COPD维持治疗的首个吸入式疗法。该疗法也在今年初被行业媒体Evaluate列为2024的10款重磅疗法之一。此前报道:雾化Ensifentrine治疗慢性阻塞性肺疾病(COPD):即将开展III期临床试验
Verona在两项3期临床试验和ENHANCE-2中评估了雾化ensifentrine作为维持疗法,治疗COPD的效果。Ensifentrine在两项试验中均达到主要终点,患者肺功能获得统计显著和具有临床意义的改善。对ENHANCE-1和ENHANCE-2试验的合并数据分析显示,ensifentrine大幅度降低COPD恶化的风险。研究结果于2023年发表在Am J Respir Crit Care Med上。
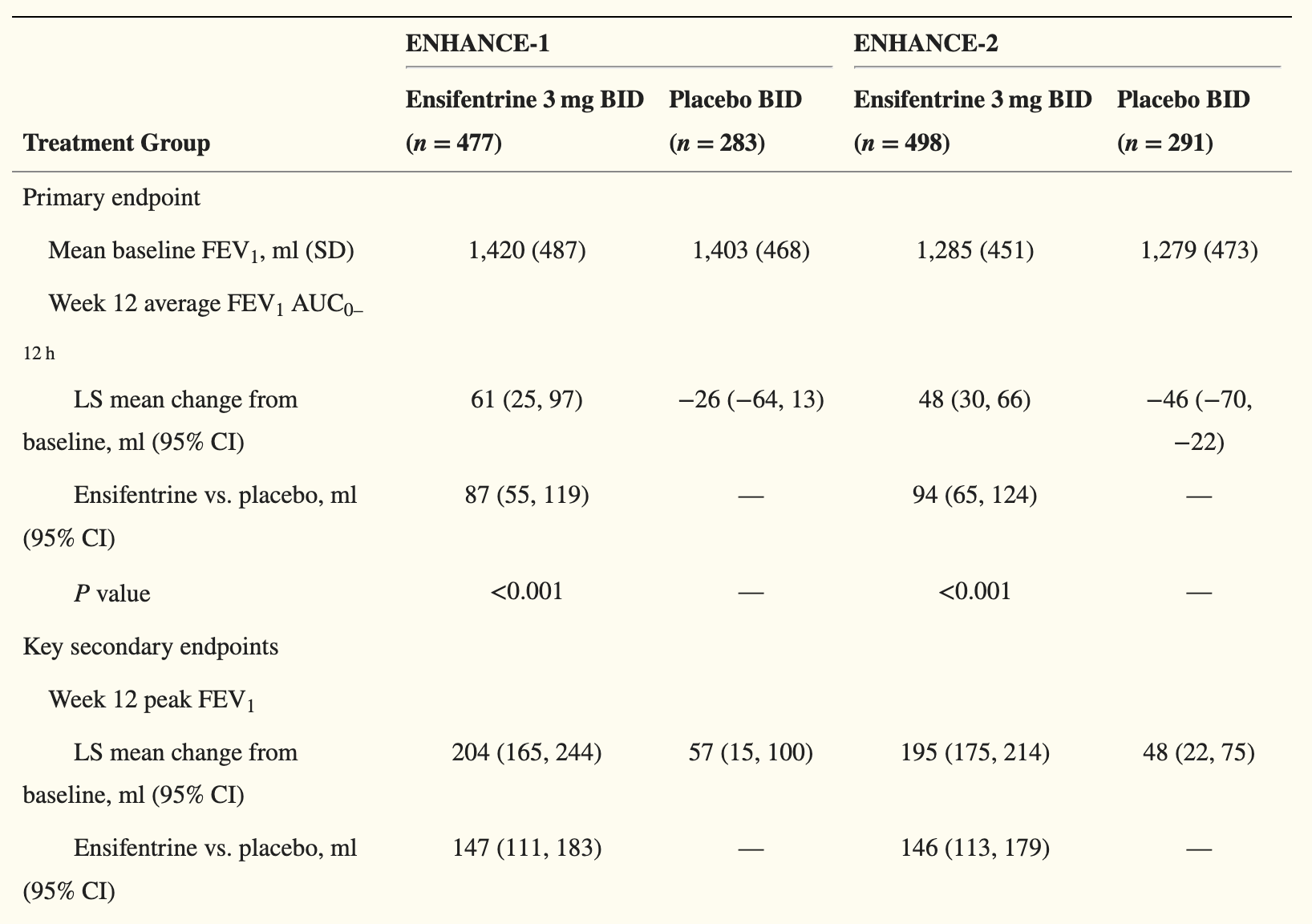
ENHANCE-1试验共有763位COPD患者入组,试验主要终点为在使用药物后12周,在0-12小时内的平均1秒内用力呼气量曲线下面积(FEV1 AUC 0-12 hr)与基线相较的变化。此前公布的结果显示,在经过安慰剂组数值校正后,ensifentrine组数值为87毫升(p<0.0001)。这项在药物治疗组中具统计学与临床意义的改善可以在所有的病患亚群中观察到,无论患者的性别、年龄、吸烟状态、COPD严重程度、药物背景治疗、是否使用吸入皮质类固醇(ICS)等因素为何。此外,与安慰剂组相较,ensifentrine组患者在24周的试验当中,将COPD疾病恶化率降低36%(p=0.0505),并降低中重度恶化风险(通过对第一次恶化发生的时间来测量)达38%(p=0.0378)。
ENHANCE-2试验结果类似。
在48周的试验中,ensifentrine亦展现良好的耐受性,仅有少数患者出现不良反应。
Ensifentrine是一款“first-in-class”的PDE3/4抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张和抗炎效果。2021年6月,Verona公司授予优锐医药在大中华区临床开发和商业化ensifentrine的。
关于 Ohtuvayre (恩替芬碱)
Ohtuvayre 是首个用于 COPD 维持治疗的吸入疗法,它将支气管扩张剂和非甾体抗炎活性结合在一个分子中。Verona 已在其 3 期临床项目 ENHANCE(“恩替芬碱作为新型吸入雾化 COPD 疗法”)中评估了雾化 Ohtuvayre 用于 COPD 维持治疗的效果。Ohtuvayre 在 ENHANCE-1 和 ENHANCE-2 中均达到了主要终点,肺功能得到了统计学上和临床上有意义的改善。目前正在开发一种固定剂量的恩替芬碱和格隆溴铵组合,即 LAMA,用于 COPD 的维持治疗。恩替芬碱在非囊性纤维化支气管扩张、囊性纤维化、哮喘和其他呼吸系统疾病方面具有潜在的应用前景。
原始出处:
https://www.veronapharma.com/news/verona-pharma-announces-us-fda-approval-of-ohtuvayre-ensifentrine/
Ensifentrine, a Novel Phosphodiesterase 3 and 4 Inhibitor for the Treatment of Chronic Obstructive Pulmonary Disease: Randomized, Double-Blind, Placebo-controlled, Multicenter Phase III Trials (the ENHANCE Trials).Am J Respir Crit Care Med. 2023 Aug 15;208(4):406-416. doi: 10.1164/rccm.202306-0944OC
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#FDA# #COPD# #ensifentrine#
25