王子华/胡志远/叶钦勇《ACS Nano》:仿生纳米囊泡双基因递送系统用于阿尔兹海默症的协同基因治疗
2024-05-03 BioMed科技 BioMed科技 发表于威斯康星
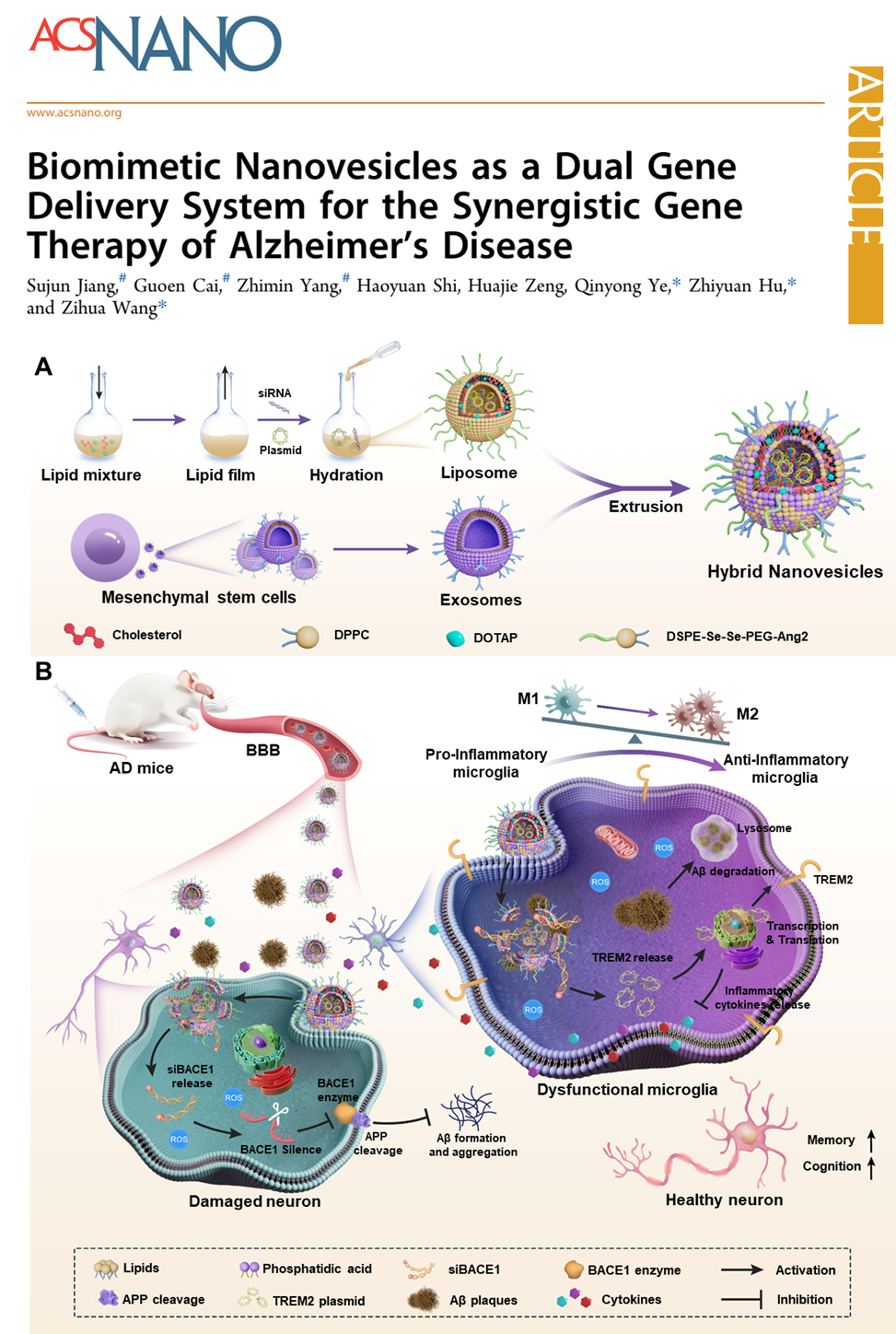
该工作提出了一种简单有效的基因治疗策略,通过干细胞外泌体和脂质体杂化的方法制备一种ROS响应型仿生纳米囊泡(命名为TSEL)来调节小胶质细胞功能和干预Aβ合成代谢。
阿尔兹海默病(AD)是严重威胁人类健康的神经退行性疾病之一,目前还没有有效的治疗方法。AD的病理事件之一是小胶质细胞功能失调与β-淀粉样蛋白(Aβ)的关联,这加速了疾病的发展。然而,AD的发病机制错综复杂,单一药物可能难以达到满意的治疗效果。
在此,该工作提出了一种简单有效的基因治疗策略,通过干细胞外泌体和脂质体杂化的方法制备一种ROS响应型仿生纳米囊泡(命名为TSEL)来调节小胶质细胞功能和干预Aβ合成代谢。该仿生纳米囊泡共递送β-分泌酶1(BACE1)siRNA(siBACE1)和TREM2质粒(pTREM2)两种基因治疗药物。在外泌体的归巢能力和Ang2多肽的协助下,TSEL能有效穿透血脑屏障(BBB),促进药物在AD病变部位积累。TREM2表达上调促使小胶质细胞从促炎M1表型重编程为抗炎M2表型,同时恢复其吞噬Aβ的能力和神经修复功能。此外,siRNA通过敲除BACE1基因,从源头上减少了Aβ斑块的产生,进一步协同增强AD的治疗效果。
这项研究的重要意义在于,通过仿生纳米囊泡作为载体,成功实现了两种核酸的协同递送,达到了治疗AD的双重效应。具体来说,TREM2表达的上调能够重编程小胶质细胞,从促炎性M1表型转变为抗炎性M2表型,并恢复其吞噬Aβ和神经修复功能。同时,siRNA通过敲除BACE1基因,降低Aβ斑块的产生,进一步增强了对AD的治疗效果。此外,该研究还证明了TSEL在APP/PS1小鼠模型中的良好生物活性,通过调节激活的微胶质细胞表型,减少Aβ的积累,防止神经炎症的再次触发,从而改善了认知功能损伤。这一突破性研究为AD的治疗提供了新的思路和方法。
该工作以“Biomimetic Nanovesicles as a Dual Gene Delivery System for the Synergistic Gene Therapy of Alzheimer’s Disease”为题发表在ACS NANO上(文章链接https://doi.org/10.1021/acsnano.3c13150)。文章第一作者为福建医科大学基础医学院硕士研究生蒋素君和杨志敏及福建医科大学附属协和医院蔡国恩博士,通讯作者为福建医科大学王子华副研究员和国家纳米科学中心胡志远研究员及福建医科大学附属协和医院叶钦勇教授。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c13150
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














谢谢分享
26
#阿尔兹海默症# #仿生纳米囊泡#
33