Nat Med:抗IDO和PD-L1疫苗增强了抗PD-1的作用,令人期待
2023-05-02 MedSci原创 MedSci原创 发表于上海
2022年4月8日,丹麦生物技术司IO Biotech在AACR会议上汇报了IDO/PD-L1多肽疫苗联合Opdivo一线治疗转移性黑色素瘤的二期临床数据。
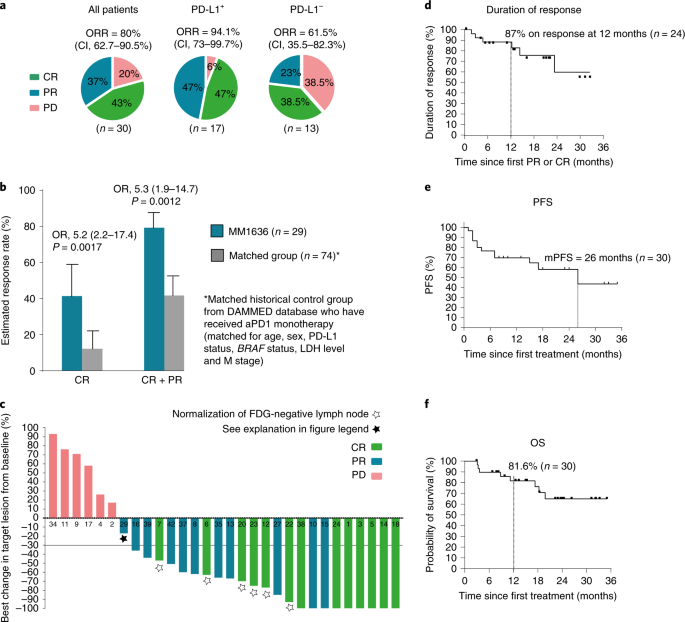
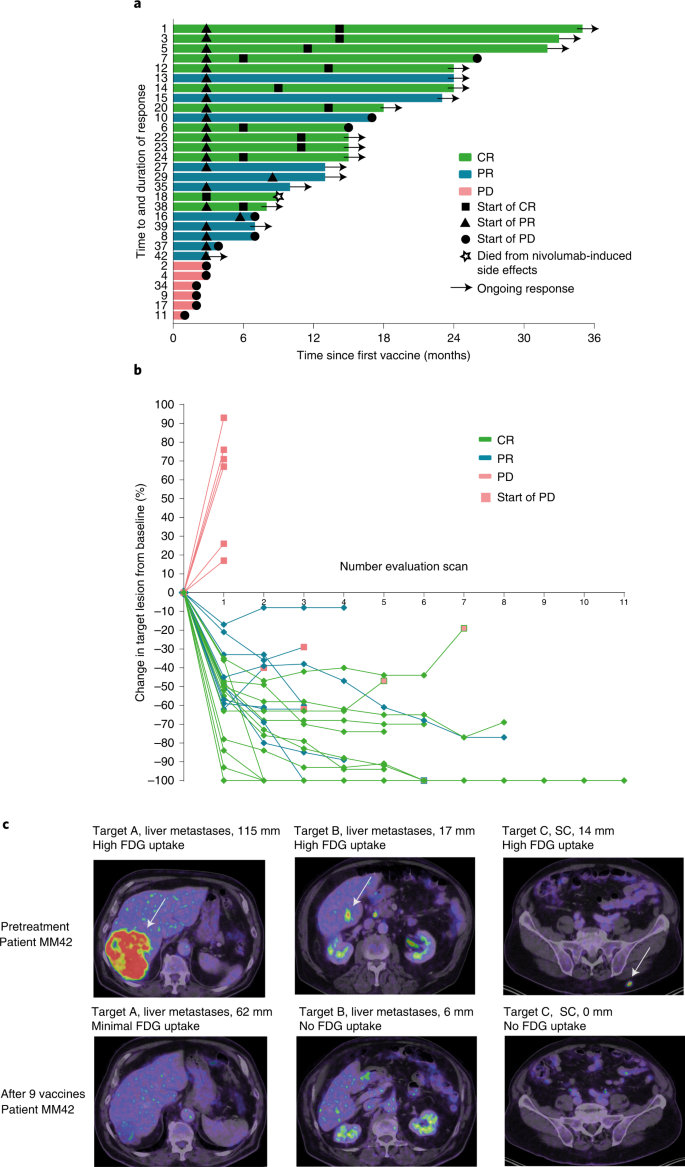
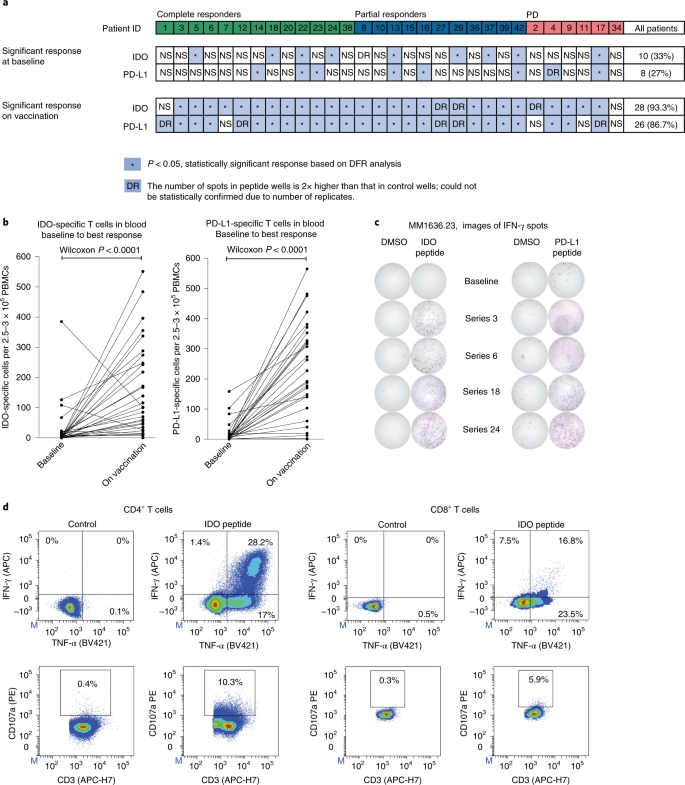
2022年4月8日,丹麦生物技术司IO Biotech在AACR会议上汇报了IDO/PD-L1多肽疫苗联合Opdivo一线治疗转移性黑色素瘤的二期临床数据。 IDO/PD-L1多肽疫苗的作用机制如下,诱导产生针对IDO和PD-L1靶蛋白的特异性T细胞,从而直接杀伤表达IDO和PD-L1的肿瘤细胞,同时也可以调节肿瘤微环境向前炎症状态转变,增强抗肿瘤活性。 转移性黑色素瘤仍存在严重的未满足临床需求,PD-1抗体治疗后5年生存率为43-51%。PD-1+CTLA-4联用可以将5年生存率提高到52%,但是毒性更强。 针对PD-1/PD-L1轴的药物,如nivolumab,已经彻底改变了治疗转移性黑色素瘤患者的方式。然而,许多患者仍然无法对疗法产生反应或者对疗法产生抗药性。为了调节肿瘤微环境(TME),增强抗PD-1疗法的反应,Kjeldsen和Lorentzen等人测试了一种免疫调节疫苗IO102/IO103,以诱导针对IDO和PD-L1的细胞毒性T细胞。这一策略旨在瞄准癌细胞和相关的抑制性免疫细胞,从而调节TME,以支持抗PD-1的反应。在一项I/II期临床试验MM1636中,这一策略得到了验证,主要终点是安全性和可行性,次要终点是临床疗效和免疫原性。Nature Medicine最近报道了该试验第一组患者的结果。 在MM1636试验中,对30名尚未接受抗PD-1治疗的转移性黑色素瘤患者进行了IDO/PD-L1长肽疫苗(IO102/IO103)联合佐剂Montanide的治疗。前6剂每隔一周给药一次,之后每隔四周给药。患者接受了3至15剂不等的治疗,平均为10.5剂。在疫苗接种期间,nivolumab每隔一周同时给药,疫苗接种后每隔四周给药。截止数据统计时间,仍有几名患者在继续治疗。 总的来说,研究的主要终点得到了满足,因为治疗是安全且耐受性良好的,毒性副作用与nivolumab单药治疗相似。1-2级不良事件(AEs)很常见。四名患者出现了3-4级不良事件,一名患者因nivolumab相关的毒性死亡。归因于疫苗的不良事件较少,仅限于疫苗注射部位的反应。两名患者因肉芽肿、压痛和与注射有关的疼痛决定停止治疗,这些情况最有可能是由于佐剂Montanide引起的。 在接受治疗的30名患者中,总体反应率(ORR)为80%,完全反应(CRs)为43%,部分反应(PRs)为37%。其余20%的患者病情恶化。在治疗初期观察到反应,30名患者中有22名在治疗12周的第一次评估时显示出反应迹象。部分反应的中位时间为75天,完全反应的中位时间为327天。PD-L1阳性患者的ORR为94.1%,PD-L1阴性患者的ORR为61.5%。经外部审查确定,ORR为76.6%,CR为53.3%,PR为23.3%,SD为3.3%。 为了评估IO102/IO103疫苗的贡献,研究人员确定了一个与29名患者匹配的历史对照组,这些患者接受了nivolumab单药治疗。与对照组相比,接受疫苗加nivolumab治疗的患者总体反应率更高(79.9%对比41.7%),完全反应的比例也更高(41.4%对比12%)。匹配对照组的反应率数据与接受nivolumab单药治疗的患者的大规模研究数据一致。 患者的随访时间长达35个月,中位随访时间为22.9个月。截至数据统计时间,尚未达到反应持续时间的中位数,87%的反应患者在12个月时无病进展。所有接受治疗的患者的中位PFS为26个月,反应患者的中位PFS尚未达到。12个月时的OS为81.6%,所有患者的中位OS尚未达到。在匹配的历史对照组中,中位PFS为8.3个月,中位OS为23.2个月。3年OS可能为73%。 亚组分析显示,PD-L1+病人中ORR为94.1%,mPFS为30.9月,而PD-L1阴性病人中ORR为61.5%,mPFS为7.2月。 为了评估疫苗诱导的免疫反应,研究人员比较了治疗前后采集的PBMC样本。在治疗前,10名患者(33%)对IDO产生了T细胞反应,8名(27%)对PD-L1产生了反应,4名(13.3%)对两者都产生了反应。在疫苗接种期间,28名患者(93%)检测到IDO特异性反应,26名患者(86%)检测到PD-L1特异性反应。无论临床反应如何,患者均诱发了免疫反应,这表明其他因素也影响了临床反应。在几名经历了持久临床反应的患者中,免疫反应在最后一次疫苗接种后的3个月和6个月仍能维持,这提示产生了免疫记忆。 从PBMC样本中分离出的IDO-和PD-L1特异性T细胞经体外扩增,发现包括CD4+和CD8+T细胞,并显示出促炎特性,包括CD107a的表达和IFNγ和TNFα的分泌。疫苗特异性T细胞能够识别癌细胞系上的靶分子(只要它们也表达HLA-II)和肽脉冲的髓样细胞系。此外,针对用肿瘤细胞调节的介质诱导表达PD-L1和IDO的CD14+髓样细胞的反应得到了增强。疫苗特异性反应还可以在PBMC样本和皮肤中检测到。 接下来,研究人员使用患者的血液和活检样本来确定富集的IDO/PD-L1特异性T细胞克隆,并在疫苗接种后追踪克隆扩增。这表明,在不同时间点,IDO-和PD-L1特异性T细胞克隆在外周增加。尽管疫苗特异性克隆的富集与临床反应无关,但应答者确实表现出T细胞比例的增加以及TCR克隆性和TCR组库丰富度的降低,而非应答者则表现出相反的情况。此外,高度扩增的克隆在治疗前经常出现,并在稍后与肿瘤的治疗效果相关,这与外周扩增的克隆定位到肿瘤部位是一致的。在肿瘤活检样本中,应答患者在治疗后观察到T细胞的涌入。 在评估TME中其他治疗诱导的炎症时,Kjeldsen和Lorentzen等人发现在治疗后的活检中,与适应性免疫相关的基因(如T细胞激活、效应功能和细胞毒性)表达上调。他们还在肿瘤内发现了与检查点抑制剂相关基因(编码TIM3、IDO、PD-L1、PD-L2、PD-1和CTLA-4)的表达增加,并在应答者的肿瘤细胞中观察到PD-L1、IDO、MHC-I和MHC-II的上调。此外,在应答者活检的IHC分析中,活检中CD8+T细胞与PD-L1表达细胞之间的距离较非应答者缩短。 综上所述,这些早期临床数据表明,将IO102/IO103疫苗与nivolumab联合可以诱导针对PD-L1和IDO的T细胞反应,调节TME,并增强对抗PD-1的临床反应。尽管这是一个小型、单中心、非随机试验,但早期结果显示mPFS是nivolumab单独治疗的两倍以上,PD-L1阴性患者的ORR明显较高。更大规模的随机试验将揭示更多信息。 3期临床试验正在进行中,采用的是IO103-IO102联合帕博利珠单抗。 这是一项 3 期、多中心、开放标签、随机、2 组试验,研究 IO102-IO103 加帕博利珠单抗与单独帕博利珠单抗的疗效和安全性(EudraCT:2021-004594-32;ClinicalTrials.gov 编号:NCT05155254) . 纳入标准包括:患有未经治疗、不可切除(III 期)或转移性(IV 期)黑色素瘤的成年患者; > 6 个月以来最后一次剂量的(新)辅助治疗与靶向或免疫治疗(在那些以前接受过治疗的人中); RECIST v1.1 ≥ 1 个可测量病灶。 主要终点是通过盲法独立中央审查的 PFS。 次要终点包括 ORR、持久反应率、完全反应率、反应持续时间、反应时间、疾病控制率、总生存期和安全性/耐受性。 目标招募是在 20 个国家/地区的 > 100 个地点招募 300 名患者。 患者按 1:1 的比例随机接受派姆单抗 200 mg 静脉内 (IV) 每 3 周一次,最长 2 年或派姆单抗 200 mg IV 每 3 周一次,最长 2 年,双抗原 IO103-IO102 85-85 µg 和 Montanide 佐剂皮下注射 在第 1 周期和第 2 周期的第 1 天和第 8 天以及此后每个周期的第 1 天。 该研究的招募正在进行中。 肿瘤疫苗正处于爆发前夜,多种形式、多种靶点的肿瘤疫苗正在进行广泛的临床探索。未来几年,将会有更多的临床突破,在安全性、疗效提升方面,肿瘤疫苗都应该会发挥巨大的作用 原始出处: Kjeldsen, J.W., Lorentzen, C.L., Martinenaite, E. et al. A phase 1/2 trial of an immune-modulatory vaccine against IDO/PD-L1 in combination with nivolumab in metastatic melanoma. Nat Med 27, 2212–2223 (2021). https://doi.org/10.1038/s41591-021-01544-x Randomized phase 3 trial of IO102-IO103 plus pembrolizumab versus pembrolizumab alone in patients with previously untreated, unresectable, or metastatic melanoma.Journal of Clinical Oncology 40, no. 16_suppl (June 01, 2022) TPS9589-TPS9589.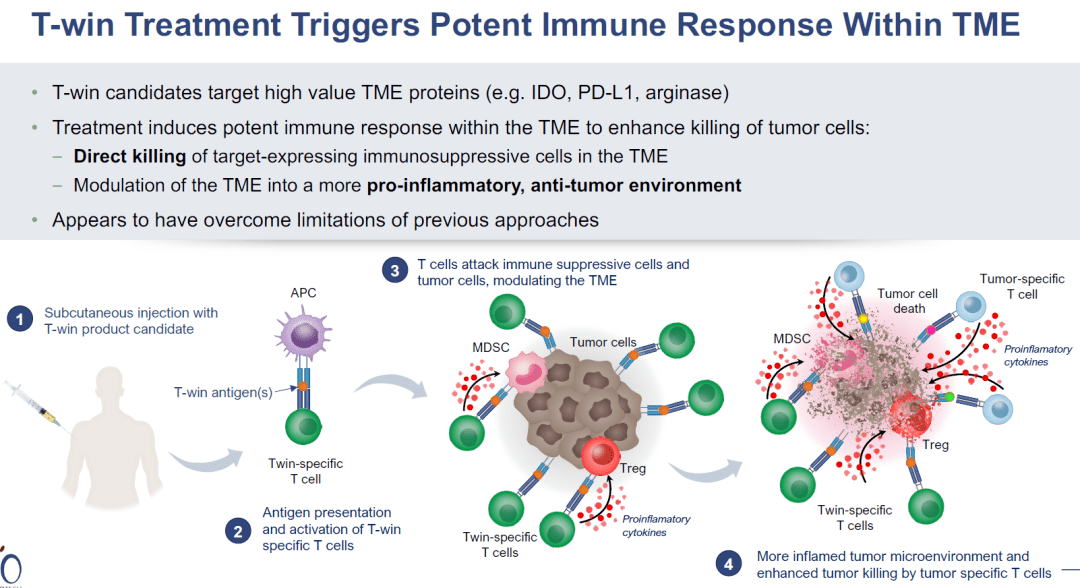




本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言