Hepatology:eG副主编高斌教授综述:酒精性肝癌最新进展与未来研究方向
2024-05-14 eGastroenterology eGastroenterology 发表于上海
文章系统总结并讨论了A-HCC的发病机制、异质性、临床前研究方法、表观遗传和遗传特征,并提出了对A-HCC相关研究新的见解,以及对相关领域未来发展的展望。
导 读
大量饮酒会引发一系列肝病,包括脂肪肝、脂肪性肝炎、肝硬化和肝细胞癌(hepatocellular carcinoma, HCC)。全球范围内,尽管饮酒是HCC发展、发病率和死亡率的已知危险因素,但与病毒性肝炎引起的HCC相比,酒精相关的HCC(alcohol-associated hepatocellular carcinoma, A-HCC)尚未充分表征。大多数A-HCC继发于酒精相关的肝硬化,但从乙醇及其代谢物直接致A-HCC的致癌过程仍不清楚。在临床预后、遗传或表观遗传学特征、分子机制和异质性方面,A-HCC与其他病因引起的HCC之间的差异尚未得到充分研究。此外,由于缺乏A-HCC的临床前模型,基础研究与临床实践之间存在巨大差距。
近日,美国国立卫生研究院(NIH)肝脏疾病实验室主任高斌教授团队, 在美国肝病研究学会会刊Hepatology发表综述,系统总结并讨论了A-HCC的发病机制、异质性、临床前研究方法、表观遗传和遗传特征,并提出了对A-HCC相关研究新的见解,以及对相关领域未来发展的展望。
酒精相关的肝硬化及其对A-HCC发展的影响
肝硬化是肝纤维化的晚期阶段,是包括饮酒在内的所有病因导致的HCC发展的主要风险因素。据估计全球范围内,25%的肝硬化死亡与酒精相关,而在美国,50.3%的肝硬化与酒精有关。临床上,纤维化分级是预测酒精相关肝病(alcohol-associated liver disease, ALD)患者结局的关键参数。值得注意的是,与ALD相关的失代偿性肝硬化比例为23%,接近HBV(28%)或HCV(25%)感染相关的肝硬化,但高于代谢相关脂肪性肝病(metabolic dysfunction-associated steatotic liver disease, MASLD)(9%)。与其他病因患者相比,ALD患者在初步诊断时更容易出现更严重的肝硬化,这可能是由于延迟诊断以及缺乏针对酒精相关肝硬化的适当筛查方法和风险分层所导致的。大规模的荟萃分析显示,与长期禁酒者相比,任何饮酒水平都会增加患肝硬化的风险,从每天1杯酒的相对风险(relative risk, RR)为1.4(95% CI:1.00–1.97)到每天饮用7杯或更多酒的RR为10.70(95% CI:2.95–38.78)。与酒精相关的肝硬化患者相比,患A-HCC的风险每年范围为1.3%至3%,5年和10年的累积风险分别为3%和9%。与一般人群相比,酒精使用障碍(alcohol use disorder, AUD)患者患HCC的相对风险为2.4,而肝硬化的存在将AUD患者患HCC的相对风险提高至22.4。以上数据表明,大量饮酒加速了从肝硬化到HCC的转变,并且肝硬化可能是A-HCC发展的必要中间步骤。
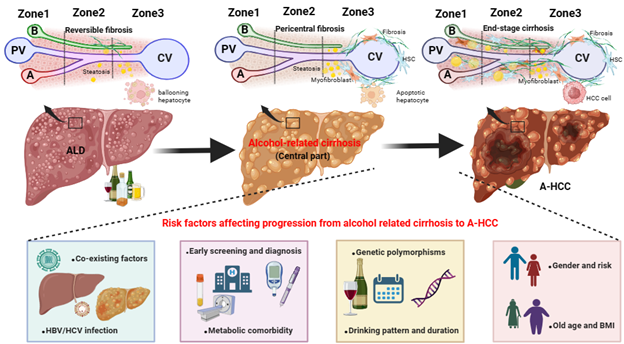
图1:从轻度ALD到酒精相关肝硬化和A-HCC的纤维化模式:酒精相关肝硬化的早期阶段以中央静脉周围的纤维化为特征,伴有肝细胞凋亡增强、纤维细胞和HSCs持续激活以及脂肪变性逐渐加重。对于A-HCC,末期肝硬化是不可逆转的,这为HCC细胞生长提供了有利的环境。下部分:可能参与调节从酒精相关肝硬化向A-HCC转变的风险因素。ALD, alcohol-associated liver disease,酒精相关肝病;A-HCC,alcohol-associated hepatocellular carcinoma,酒精相关肝细胞癌;HSCs,hepatic stellate cells,肝星状细胞;HCC,hepatocellular carcinoma,肝细胞癌。
来源:原文图1
基因的单核苷酸多态性可能影响A-HCC发展
通常,肝脏中的酒精解毒主要通过两步酶反应完成。酒精脱氢酶(alcohol dehydrogenase, ADH)负责将乙醇转化为有毒的、高活性的乙醛。随后,醛脱氢酶(acetaldehyde dehydrogenase, ALDH),主要是ALDH2,将乙醛转化为乙酸,以便进一步排除。酒精代谢酶的遗传多态性可以通过影响酒精代谢速率和有毒代谢物,特别是乙醛的积累,显著影响A-HCC的风险和进展。ADH1和ALDH2的多态性可能影响酒精相关肝硬化和肝癌的进展风险。除了特定的ADH和ALDH多态性外,最近的证据表明,一些特定基因的单核苷酸多态性(single nucleotide polymorphisms, SNPs)与酒精相关肝硬化的风险、致癌途径的激活和A-HCC的预后有关。通过全基因组关联研究(genome-wide association study, GWAS)鉴定的几个SNP已被证实是酒精相关肝硬化和A-HCC的独立风险因素。例如,PNPLA3的rs738409 C>G,以及 TM6SF2中的rs58542926(C>T)被证实与发展酒精相关肝硬化和肝癌的风险密切相关。
A-HCC的临床前模型
大多数A-HCC在肝硬化后发展,但啮齿动物不易发展出酒精相关性肝硬化,因此,目前没有理想的动物模型能够充分复制大多数人类A-HCC。几乎所有现有的A-HCC模型都将致癌或化学毒物,主要是N-亚硝基二乙胺(N-nitrosodiethylamine, DEN)和四氯化碳(CCl4),使用在长期饮酒的小鼠模型中。这些模型具有以下共同特点:首先,DEN在乙醇处理之前给予。仅给予乙醇不能导致肝癌的发生,因为其作为致癌物的效应较弱。乙醇饲喂导致了更严重的肝损伤和纤维化,并加速了这些模型中的肿瘤增殖。然而,它们与人类A-HCC的临床相关性和相似性尚不清楚。在组织学特征、病理过程和基因表型方面,这些临床前模型与A-HCC临床样本之间没有进行比较。因此,迫切需要开发适当的A-HCC临床前模型,这将有助于将基础研究转化为临床实践。
A-HCC的复杂性与潜在发病机制
由于缺乏明确的定义和其他病因的共存,在大多数情况下,A-HCC常被归类为“非病毒性HCC”,这使得在临床上更难区分A-HCC和MASLD-HCC。酒精与其他因素,特别是代谢风险因素的共存,反映了A-HCC作为一个综合结果的复杂性。尽管过度饮酒被认为是HCC发展的最重要的风险因素之一,但酒精和非酒精代谢风险因素对肝纤维化的严重程度和HCC的高死亡率起着协同作用。总的来说,识别A-HCC的独特病理特点和发病机制仍具有挑战性。
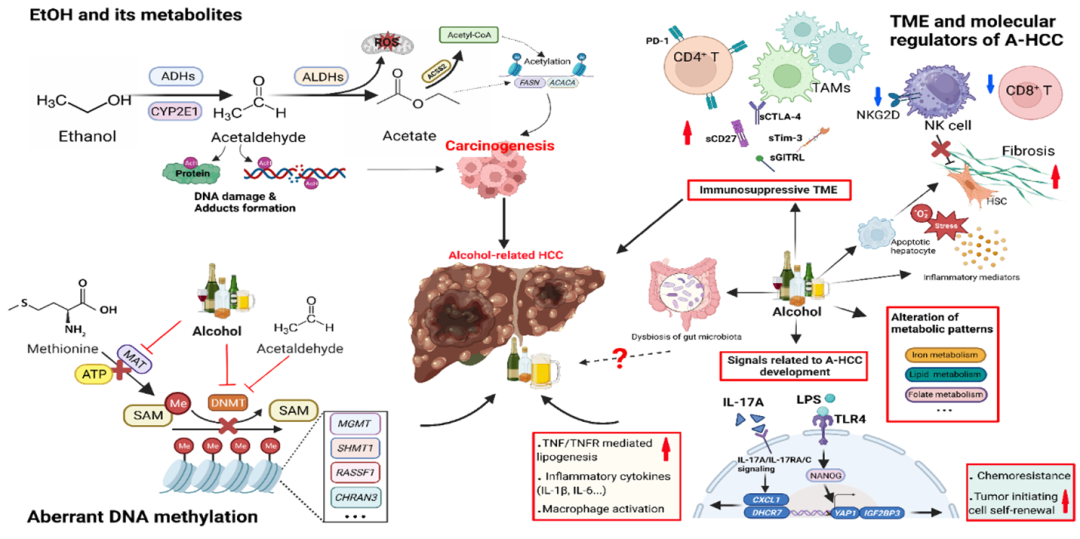
图2:A-HCC潜在发病机制:乙醇及其代谢物、表观遗传修饰、不同类型的代谢改变、免疫抑制性肿瘤微环境和致癌信号通路共同促进了A-HCC的发展。A-HCC,alcohol-associated hepatocellular carcinoma,酒精相关肝细胞癌。
来源:原文图2
总结
开发更好的临床前模型,研究饮食因素、肠道因素,肿瘤微环境和乙醇代谢产物对A-HCC的发展和进展的影响十分重要,这可能有助于确定A-HCC的有效预防和治疗策略。
引证本文
Fu, Yaojie1; Maccioni, Luca1; Wang, Xin Wei2,3; Greten, Tim F.3,4; Gao, Bin1. Alcohol-associated liver cancer. Hepatology ():10.1097/HEP.0000000000000890, April 12, 2024. | DOI: 10.1097/HEP.0000000000000890
http://dx.doi.org/10.1097/HEP.0000000000000890
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#肝细胞癌# #HCC# #A-HCC#
45