EJC:肝转移显著降低dMMR转移性结直肠癌患者一线免疫治疗的疗效!
2023-12-10 苏州绘真医学 苏州绘真医学 发表于上海
在患者队列和汇总分析中,本研究数据证实,在接受一线ICI单药治疗的d-MMR mCRC患者中,肝转移是独立的不良预后因素。

仅一半的错配修复缺陷(d-MMR)转移性结直肠癌(mCRC)对免疫检查点抑制剂(ICIs)有持久应答。鉴于临床前数据表明肝转移将激活的CD8+ T细胞从体循环中隔离,因此研究者根据转移部位研究了临床结果。在法国多个中心接受治疗的d-MMR mCRC患者回顾性队列中(n=66),研究者试图验证来自美国队列的数据,并进行了汇总分析(n=104)。所有患者均接受一线ICI单药治疗。研究者通过校正协变量后的多变量分层Cox回归分析了转移部位与肿瘤缓解(RECIST 1.1版)以及无进展生存期(PFS)的关系。
在验证队列的66例患者中,有38例(58%)达到了客观缓解。最佳肿瘤反应包括完全缓解(CR)13例(20%),部分缓解(PR)25例(38%),疾病稳定(SD)16例(25%),疾病进展(PD)11例(17%)。1年和5年PFS率分别为73%和67%,18例(27%)患者在免疫治疗期间发生疾病进展。肝转移患者的最佳肿瘤反应减弱(P=0.03)。协变量校正后,肝转移与显著较差的PFS相关(HRadj 2.82;95%CI,1.08-7.39;Padj=0.03),而其他部位转移与其无关。在汇总分析中,肝转移仍然与较差的PFS显著独立相关(HRadj 3.18;95%CI,1.52-6.67;Padj=0.002),且肿瘤最佳反应减弱(P=0.01)。肝转移被证实是d-MMR mCRC患者接受ICI治疗后反应和生存较差的独立相关因素,而其他部位转移不是。这些数据强调了这些患者需要新的治疗策略。
研究背景
错配修复缺陷(d-MMR)或微卫星高度不稳定(MSI-H)的转移性结直肠癌(mCRC)是高度突变的肿瘤,表达大量的新抗原,这些新抗原经常触发强大的瘤内T细胞反应。与单独化疗相比,帕博利珠单抗一线阻断PD-1显著延长了患者生存期,这为d-MMR mCRC确立了新的标准治疗(KEYNOTE-177)。然而,这些肿瘤中只有一半对靶向PD-1/PD-L1轴的免疫检查点抑制剂((ICIs)表现出持久应答。使这一疗法对更多患者有效是一项尚未满足的需求,需要阐明与耐药相关的因素及其机制。这包括显示原发耐药的无应答者或在ICI治疗期间出现获得性耐药的患者。免疫治疗的疗效可能取决于原发肿瘤或转移器官部位的微环境。小鼠模型的临床前数据表明,肝转移将激活的CD8+ T细胞从体循环中隔离,从而降低了免疫治疗的疗效。在有限数量的d-MMR mCRC患者中,研究者之前发现,与非肝转移相比,肝转移与PD-1阻断后较差的生存相关。在接受ICI联合治疗的MMR正常(p-MMR) mCRC患者以及某些其他类型的肿瘤中也观察到这一观察结果。研究者在d-MMR mCRC患者中研究了转移部位与一线ICI治疗后的缓解和生存期之间的关联。研究者还试图在d-MMR mCRC患者中验证肝转移与ICI治疗不良临床结果的潜在关联。
研究方法
研究者分析了2016年10月至2022年12月在法国多个中心接受一线ICI治疗的d-MMR mCRC患者(n=66)的数据。这些患者被作为验证队列,数据与之前在梅奥诊所/梅奥卫生系统接受一线ICI治疗的38例d-MMR mCRC患者的结果合并。除1例患者接受了PD-L1阻断治疗外,所有患者均接受了PD-1阻断治疗(验证队列)。转移部位在ICI治疗开始时确定,包括有无肝、肺、腹膜和远处淋巴结转移。验证队列采用Kaplan-Meier法和Cox回归分析PFS,合并数据采用分层Cox回归分析。排除生物标志物数据缺失的病例后,研究者在根据KRAS/NRAS和BRAF V600E状态校正的合并队列中重复了多变量分析。
研究结果
验证队列:
验证队列包括在法国多个中心接受一线ICI单药治疗的66例d-MMR mCRC患者(60例结肠,6例直肠)。开始ICI时患者的中位年龄为64岁(IQR:51,79)。44例(72%)患者的原发结肠癌位于右侧。中位随访时间为24.3个月(95%CI: 19.3-28.2),接受ICI治疗的中位周期数为10(IQR: 5,18)。腹膜(56%)是最常见的转移部位,其次为非区域淋巴结[31(47%)]、肝脏[17(26%)]和肺[9(14%)]。17例(26%)发生肝转移,其中8例仅发生肝转移。BRAF V600E在29例(55%)肿瘤中被发现,KRAS/NRAS突变在12例(23%)肿瘤中被检测到,它们的发生率在不同转移部位的肿瘤中没有差异(均p>0.05)。
在验证队列的66例患者中,60个月后未达到中位无进展生存期(PFS)。1、3和5年PFS率分别为73%、67%和67%(图1)。在被归类为进展的患者中,11例(61%)显示原发性耐药,7例(39%)在免疫治疗期间发生进展,表明获得性耐药。38例(58%)患者达到客观缓解(CR、PR)。最佳肿瘤反应如下:完全缓解(CR)13例(20%),部分缓解(PR)25例(38%),疾病稳定(SD)16例(25%),疾病进展(PD)11例(17%),1例无法评估(表1)。单变量分析显示,与非肝转移相比,肝转移与ICI治疗患者较差的PFS显著相关[HR 2.54 (95%CI, 1.04-6.25); p=0.04;图2]。肺转移、腹膜转移、远处淋巴结转移与患者PFS无关(p值均>0.05;图2)。肝转移患者的中位PFS为12.0个月(95%CI: 3.0-NR),未发生肝转移患者的中位PFS未达到(>60个月;95%CI: NR-NR)(图3A)。对ICI单药治疗的最佳肿瘤应答与肝转移显著相关,而与其他转移部位无关。具体而言,在ICI完全缓解的患者中,4例(30%)出现肝转移,9例(70%)未出现肝转移。在疾病进展的患者中,6例(55%)发生肝转移,5例(45%)未发生肝转移(p=0.03;图3B)。校正年龄、性别、体能状态、原发肿瘤部位和转移部位数量后,肝转移仍与较差的PFS显著相关[HRadj 2.82 (95%CI, 1.08-7.39);Padj=0.03;表2]。
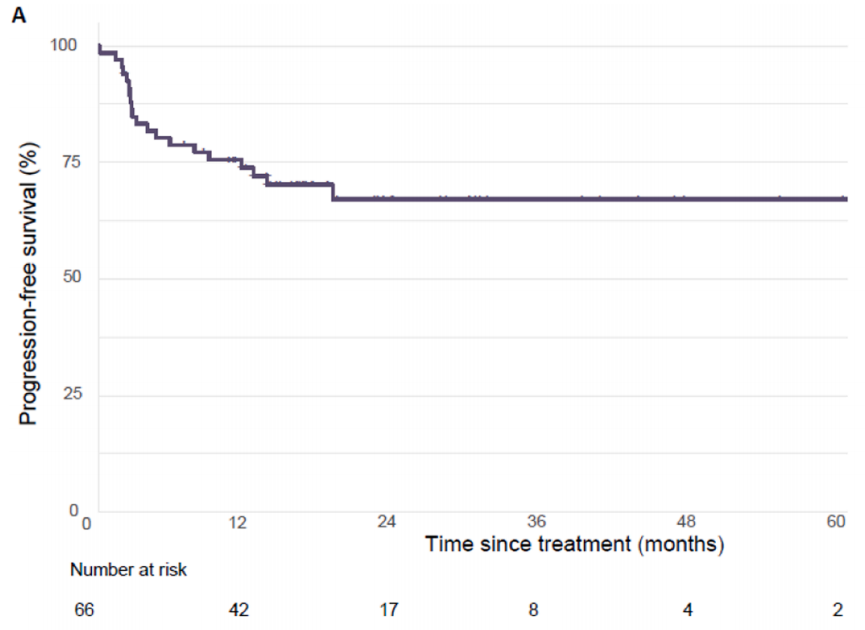

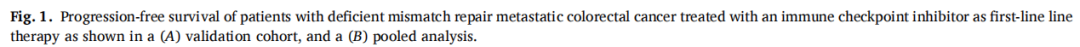
图1
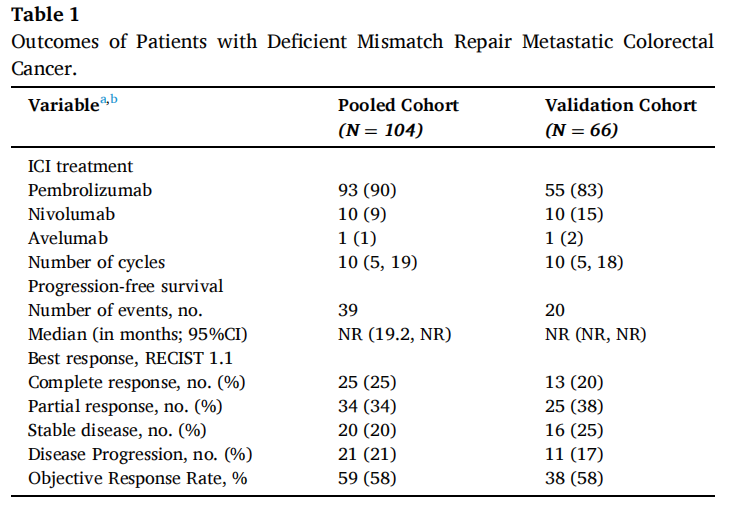
表1
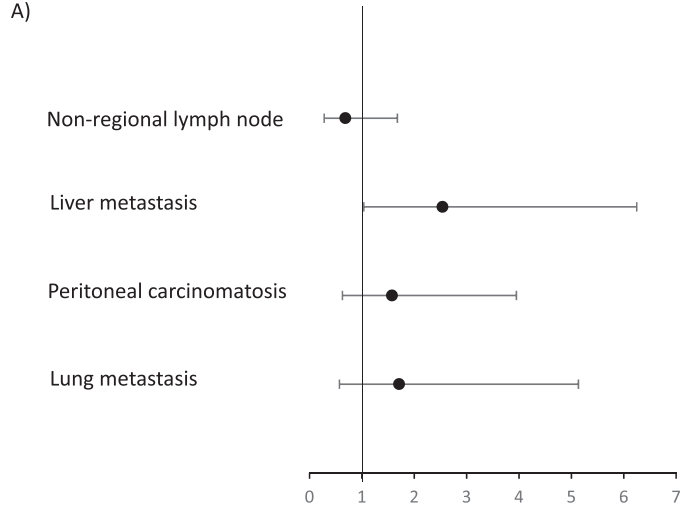
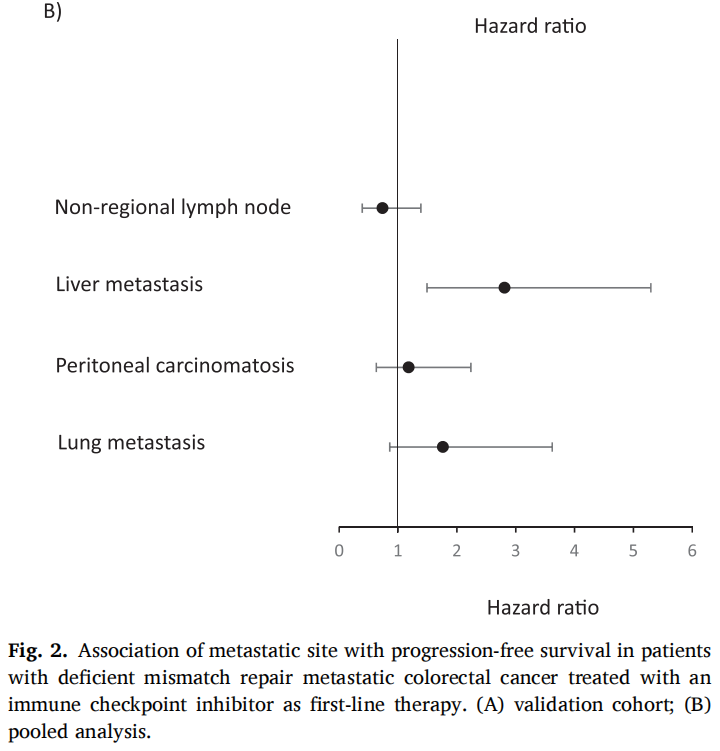
图2
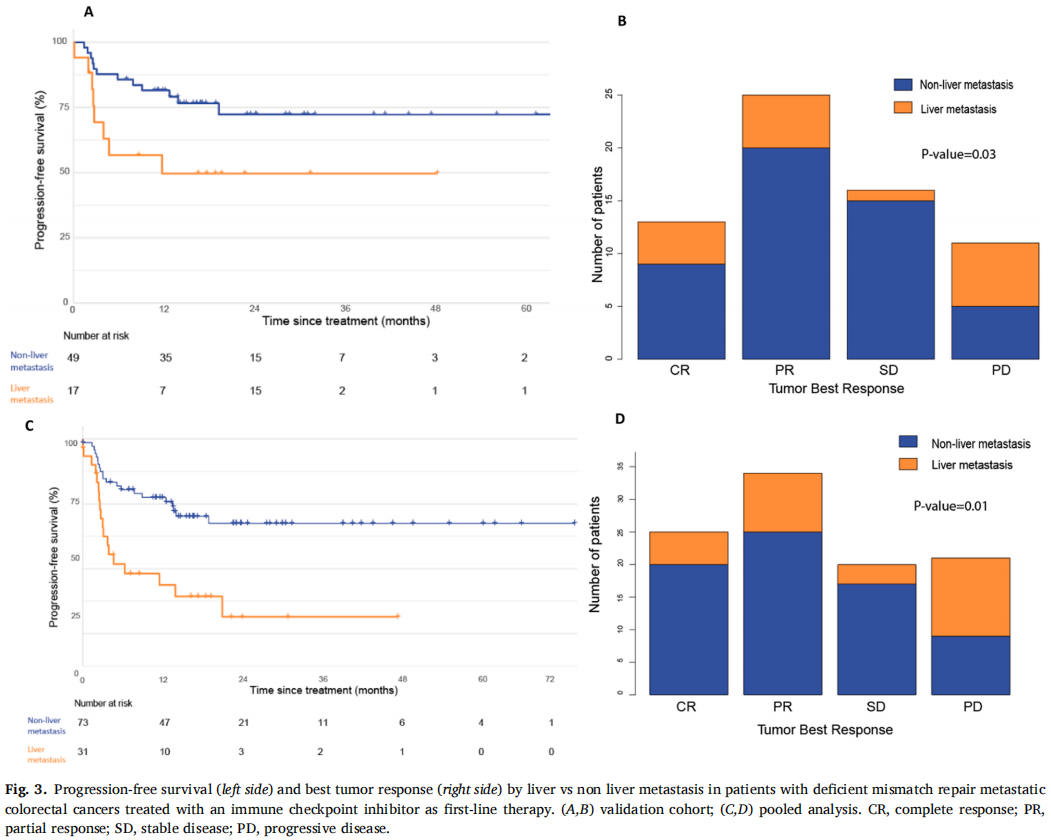
图3
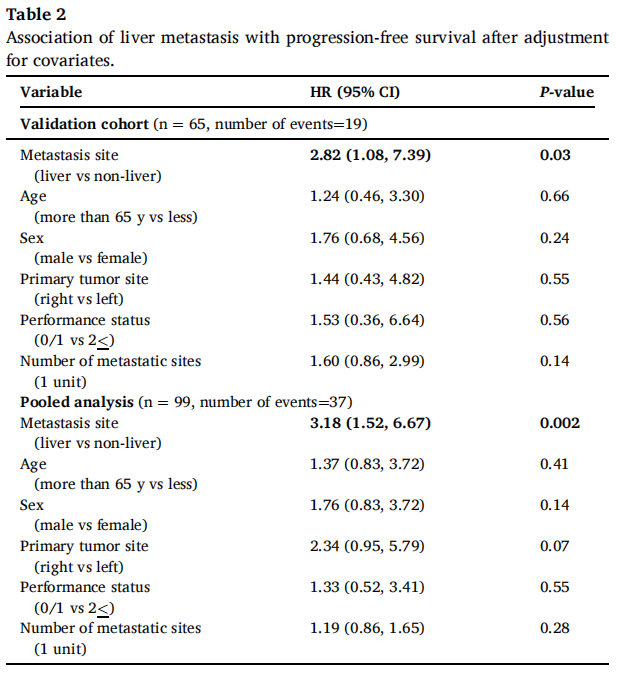
表2
合并分析:
对梅奥队列和验证队列的临床病理特征进行的比较显示,患者年龄、肿瘤分级、转移部位数量和KRAS/NRAS状态有统计学显著差异。因此,考虑到这些差异,采用分层Cox回归分析进行汇总分析。在合并分析中(N=104;结肠94例,直肠10例),中位随访时间20.8个月(95%CI: 17.8-25.2),中位ICI治疗周期数为10(IQR: 5,19)。74例(72%)患者的原发结肠肿瘤位于右侧。在56例(64%)患者中检出BRAF V600E,在14例(16%)患者中检出KRAS/NRAS基因突变。最常见转移部位为腹膜(54%),其次为非区域淋巴结[55例(53%)]、肝脏[31例(30%)]和肺[19例(18%)]。BRAF V600E和KRAS/NRAS突变率在不同转移部位之间没有差异(均p>0.05)。
在汇总分析中,一线ICI单药治疗后的1、3和5年PFS率分别为68%、58%和58%(图1)。59例(58%)患者观察到客观缓解(CR、PR),最佳肿瘤缓解如下:25例(25%)CR、34例(34%)PR、20例(20%)SD、21例(21%)PD(表1)。31例(30%)患者发生肝转移,其中9例仅发生肝转移。单因素分析显示,肝转移与较差的PFS显著相关(图2),而其他部位转移与较差的PFS无关(图2)。分层Cox回归分析显示,与无肝转移相比,肝转移与较差的PFS显著相关(HR 2.60, 95%CI:1.37,4.92,P:0.003;图3C)。肝转移患者的中位PFS为6个月(95%CI:3.0-NR),而未肝转移患者的中位PFS未达到(>72个月,95%CI:NR-NR)。在多变量分析中,针对年龄、性别、体力状态、原发肿瘤部位和转移部位数量进行校正后,肝转移仍与较差的PFS显著相关(HRadj 3.18;95%CI,1.52-6.67;Padj=0.002)。排除生物标志物数据缺失的病例后,研究根据KRAS/NRAS和BRAFV600E状态调整了多变量模型,观察到肝转移仍与较差的PFS显著相关(n=81;事件=30;HRadj 3.24;95%CI,1.35-7.76;Padj=0.008)。
在ICI治疗获得CR的患者中,5例(20%)发生肝转移,20例(80%)未发生肝转移。在疾病进展的患者中,12例(57%)有肝转移,9例(43%)无肝转移(图3D)。
在10例对ICI治疗最初有反应但后来进展的患者中,只有1例出现肝转移,而在21例对ICI治疗无反应(PD是他们的最佳反应评估)的患者中,12例(57%)出现肝转移(p=0.02)。在肝转移患者(n=31)中,单纯肝转移患者(n=9)的PFS与转移灶包括肝脏的患者无显著差异(HR 0.4;95%CI,0.1-1.58;P=0.196)。
讨 论
研究发现,在d-MMR mCRC患者中,肝转移与一线ICI单药治疗后显著较差的PFS相关,而其他转移部位与其无关。合并队列中肝转移患者的中位PFS为6个月(95%CI;2-21个月),非肝转移患者的中位PFS为34个月(95%CI:14-未达到),差异显著。这种相关性与转移部位的数量无关,在唯一转移部位为肝脏的患者和转移灶包括肝脏的患者中均观察到这种相关性。一致的结果发现,对于最佳肿瘤反应,肝转移患者比无肝转移患者明显减弱。有趣的是,与随后发生PD的患者相比,对ICI初始治疗耐药(最佳反应为疾病进展)的患者更有可能发生肝转移。外部队列和汇总分析中的这些发现验证了研究者之前在单一卫生系统队列的有限患者中报告的结果。本研究中ICI治疗的d-MMR肝转移患者的中位PFS[6个月(95%CI: 3.0-NR)]与在类似的患者人群(KEYNOTE-177)中单独化疗的中位PFS[8.2个月(95%CI: 6.1-10.2)]相似,当然需要知道跨试验比较的局限性。本研究数据是d-MMR实体瘤中唯一的此类数据,即如果有肝转移,ICI治疗的临床获益较少,另外化疗耐药的p-MMR mCRC患者和其他类型的肿瘤也显示。与免疫治疗相比,在接受化疗的d-MMR/MSI mCRC患者中,肝转移的存在并不影响PFS或OS。同样,对14项3期临床试验(ARCAD数据库)中接受细胞毒性化疗的mCRC患者进行的多变量分析表明,仅肝脏转移与所有其他部位转移的总生存期无差异。
在感染性疾病和器官移植的情况下,肝脏已被发现具有局部免疫抑制和全身耐受性。在转移性黑色素瘤患者中,肝转移患者原发肿瘤浸润边缘的CD8+ T细胞密度显著低于非肝转移患者。在临床前模型中,肝转移瘤中CD11b+抑制性巨噬细胞对肿瘤内T细胞的清除与免疫治疗效果降低相关。在包括CRC在内的实体瘤患者中,在有肝转移而无肺转移的患者中,发现瘤内T细胞克隆明显较少,且多样性较低。在肝转移的小鼠模型中,肝脏从体循环中“虹吸”活化的CD8+ T细胞,并将其困在肝脏中,随后细胞发生凋亡,导致对免疫治疗耐药。在另一项临床前小鼠模型中,肝脏肿瘤导致对肝外肿瘤的全身免疫受到抗原特异性抑制。在小鼠模型中,肝转移可诱导调节性T细胞(Tregs),高表达CTLA-4、PD-1和ICOS,这些对诱导髓源性抑制(MDSC)细胞的免疫抑制至关重要。通过抗CTLA-4治疗去除肿瘤驻留的Tregs或功能失活的Tregs挽救了PD-1阻断的治疗潜力。这些数据提示了可能改善肝转移患者ICI治疗结局的潜在治疗策略。在d-MMR mCRC中,尽管未报告根据转移部位确定的结果,但PD-1和CTLA-4联合抑制剂与74%的24个月PFS相关(32个月后未达到中位PFS)。此外,将抗PD-1和靶向Tregs药物相结合的挽救性免疫疗法值得评估。在使用d-MMR的MC38结肠癌细胞的临床前模型中,肝脏定向放疗可以清除具有免疫抑制作用的巨噬细胞,增加肝脏T细胞存活,减少肝脏对T细胞的虹吸,提示肝脏定向放疗联合免疫治疗可以恢复抗肿瘤免疫。
本研究的优势包括外部验证队列和汇总分析,这为检验本研究假设提供了更大的统计功效。其他优势包括统一的ICI治疗(所有患者在一线治疗中均接受一种ICI治疗)、使用标准化RECIST 1.1标准评估缓解情况以及生物标志物数据。考虑到队列间的差异,研究使用分层Cox回归进行汇总分析。本研究观察到的BRAF V600E发生率表明散发性d-MMR肿瘤中BRAF V600E的富集,这与本队列的中位年龄高于其他随机试验一致,但也反映了临床实践。值得注意的是,BRAF V600E并未因肿瘤转移部位的不同而有差异。其他局限性包括本研究为回顾性研究。根据转移部位确定肿瘤的最佳应答,但尚无疾病进展部位的数据。虽然本研究纳入了104例d-MMR患者,但需要前瞻性数据才能得出明确结论。由于本研究缺乏未接受ICI治疗的对照组,因此研究无法在有和无肝转移的患者之间比较ICI的疗效。
在患者队列和汇总分析中,本研究数据证实,在接受一线ICI单药治疗的d-MMR mCRC患者中,肝转移是独立的不良预后因素。肝转移与ICI耐药和较差的PFS有关,是一个预后不良的亚组。此外,本研究数据强调了有肝转移的d-MMR患者迫切需要新的治疗策略,这些患者应在有条件的情况下参加临床试验。
参考文献:
Saberzadeh-Ardestani, Bahar et al. “Metastatic site and clinical outcome of patients with deficient mismatch repair metastatic colorectal cancer treated with an immune checkpoint inhibitor in the first-line setting.” European journal of cancer (Oxford,England:1990),vol.196113433.10 Nov. 2023, doi:10.1016/j.ejca.2023.113433

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言











#肝转移# #转移性结直肠癌#
55