Microbiome:中山大学李宁宁等团队合作发现肠道代谢物吲哚丙酸恢复社交和认知缺陷的潜在机理
2024-04-21 iNature iNature 发表于陕西省
本研究通过探讨肠道差异代谢产物在孤独症小鼠行为缺陷及神经病理生理改变中的改善作用,为ASD的治疗提供新思路。
孤独症谱系障碍(autism spectrum disorder, ASD)又称孤独症、自闭症,是一种高度遗传性和异质性的神经发育性障碍,其核心症状为社交缺陷和重复刻板行为【1】。据世界卫生组织统计,全球ASD患病率约为1%,患者人数高达7000万,并呈不断上升的趋势【2】。最新发布的《中国自闭症教育康复行业发展状况报告》也指出:目前中国ASD患病率约为1%,患者人数超过1300万,其中0到14岁的儿童患病者达200余万。更为严重的是,迄今ASD的发病机制尚不清楚,病症终生不可逆转,并且缺乏有效的分子诊断和靶向治疗手段。因此,ASD严重影响患者身心健康,给家庭和社会带来沉重的负担。研究表明,遗传因素是ASD的最主要病因之一。染色体16p11.2片段微缺失(16p11.2+/-)是目前已知的,与ASD发生较为明确的基因拷贝数变异,且临床上16p11.2+/-人群表现出严重的ASD样行为,如智力发育障碍和社交缺陷等【3】。值得注意的是,16p11.2+/-小鼠模型能有效模拟ASD患者的行为缺陷,并存在多种形式的突触功能障碍和脑皮层发育异常【4】。
2024年3月28日,中山大学附属第七医院李宁宁课题组联合英国伦敦大学学院李会良教授和美国罗格斯大学张雪松教授在Microbiome 杂志上在线发表题为“The gut metabolite indole-3-propionic acid activates ERK1 to restore social function and hippocampal inhibitory synaptic transmission in a 16p11.2 microdeletion mouse model”的研究文章。该研究发现16p11.2+/-小鼠表现显著的社交以及认知记忆功能的异常(图1),同时伴有海马神经元过度活跃及抑制性递质传递失衡,此外,16p11.2+/-小鼠肠道菌群及代谢物出现紊乱。本研究通过探讨肠道差异代谢产物在孤独症小鼠行为缺陷及神经病理生理改变中的改善作用,为ASD的治疗提供新思路。
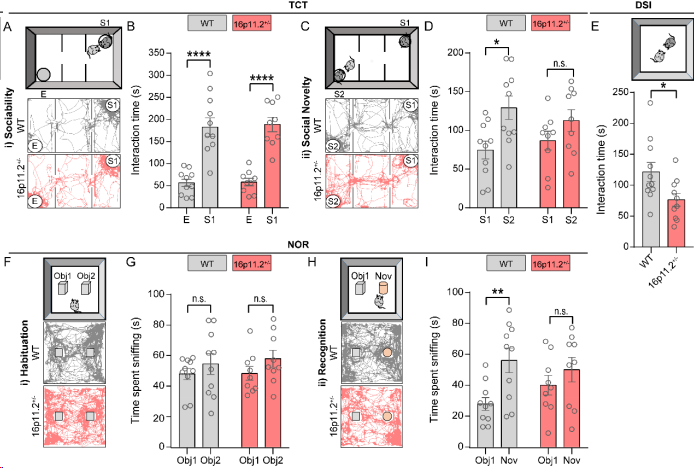
图1:16p11.2+/−小鼠表现出社交新颖性和认知记忆缺陷。
肠道功能紊乱是ASD患者最常见的伴随症状之一,ASD儿童肠道菌群失调也有诸多报道【5,6】。该研究通过16S rDNA测序和代谢组学分析,发现16p11.2+/-小鼠肠道菌群出现结构紊乱,肠道代谢物发生显著改变,其中肠道菌群代谢物吲哚丙酸(indole-3-propionic acid, IPA)的含量显著降低。IPA作为神经保护因子,在改善神经炎症以及抗氧化中起到积极的作用【7】。有趣的是,研究人员发现在对16p11.2+/-小鼠补充IPA后,可显著改善 16p11.2+/-小鼠社交、认知功能障碍并能有效改善抑制性递质失衡。行为学实验表明IPA显著提高了16p11.2+/-小鼠社会互动时间以及认知记忆能力。
IPA能有效降低16p11.2+/-小鼠海马DG区神经元的异常活化状态,增加GABA的合成,从而改善16p11.2+/-小鼠海马DG区神经元的功能(图2)。此外,该研究进一步发现16p11.2+/-小鼠海马Mapk3基因(位于16p11.2区域)表达显著降低,其编码的蛋白ERK1及其磷酸化蛋白p-ERK1水平也显著降低。IPA虽不影响16p11.2+/-小鼠海马Mapk3基因的转录和翻译,但能显著提高ERK1的磷酸化水平,以恢复神经元兴奋抑制失衡。这些发现表明IPA对16p11.2+/-相关的社交和认知记忆行为缺陷和GABA合成减低具有潜在的改善作用。
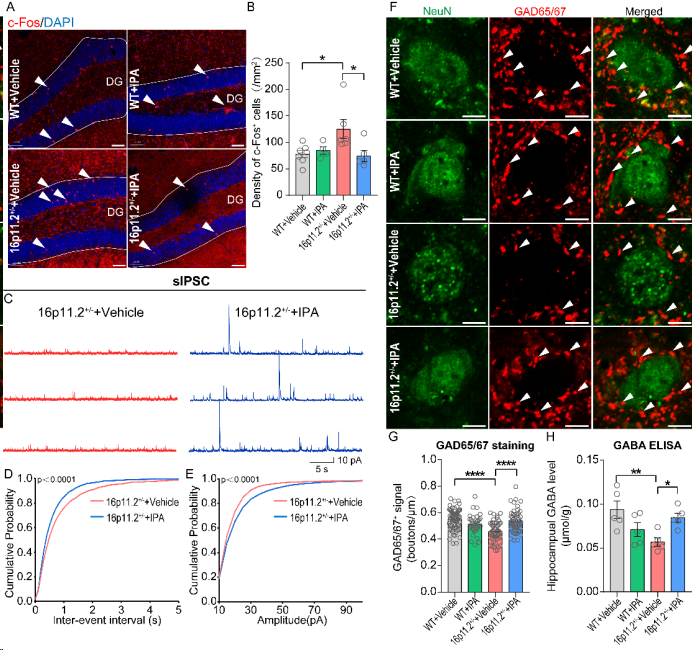
图2:IPA逆转16p11.2+/−小鼠神经元异常激活和抑制性递质传递失衡。
综上所述,该研究表明:IPA通过提高16p11.2区域编码蛋白ERK1的磷酸化水平以及改善与之相关的GABA系统抑制性递质的失衡,能有效改善16p11.2+/-小鼠社交和认知能力的缺陷,为以16p11.2缺失综合征为代表的认知和社交缺陷的治疗提供了新途径(图3)。
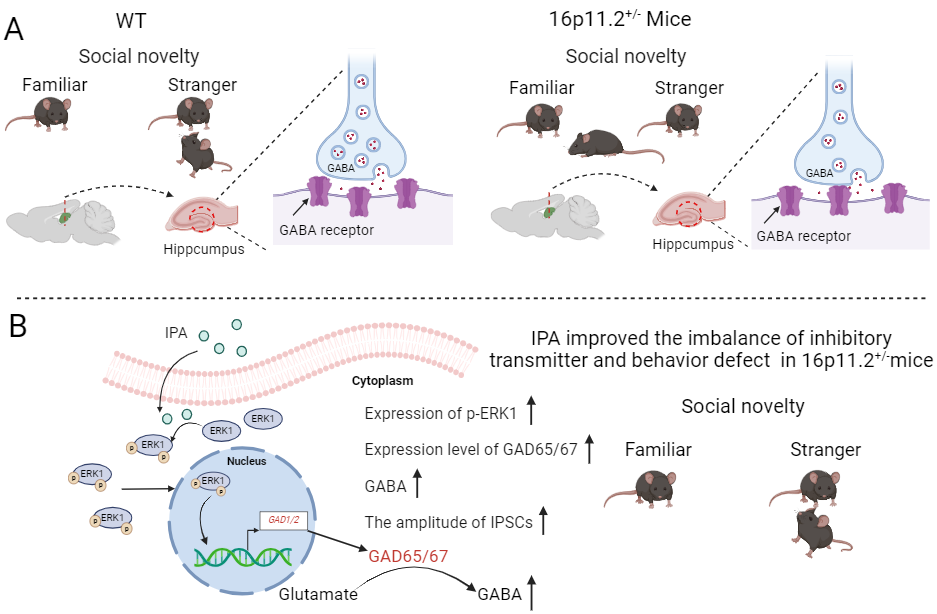
图3:IPA逆转16p11.2+/−小鼠抑制性递质传递失衡和社交行为缺陷。
中山大学附属第七医院李宁宁研究员、英国伦敦大学学院李会良教授和美国罗格斯大学张雪松教授为论文共同通讯作者。中山大学附属第七医院江健博士、王迪龙博士和博士研究生姜友恒为论文共同第一作者。该项目得到国家自然科学基金、深圳市自然科学面上和深圳市三名工程等项目的资助。
原文链接:
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-024-01755-7
参考文献:
1. Lord C, Brugha TS, Charman T, Cusack J, Dumas G, Frazier T, Jones EJH, Jones RM, Pickles A, State MW, et al. Autism spectrum disorder. Nat Rev Dis Primers. 2020;6(1):5.
2. Lord C, Elsabbagh M, Baird G, Veenstra-Vanderweele J. Autism spectrum disorder. The Lancet. 2018;392(10146):508–20.
3.Chung WK, Roberts TP, Sherr EH, Snyder LG, Spiro JE. 16p11.2 deletion syndrome. Curr Opinion Genet Dev. 2021; 68: 49–56.
4. Yang M, Mahrt EJ, Lewis F, Foley G, Portmann T, Dolmetsch RE, Portfors CV, Crawley JN. 16p11.2 deletion syndrome mice display sensory and ultrasonic vocalization defcits during social interactions. Autism Res. 2015;8(5):507–21.
5. Sherwin E, Bordenstein SR, Quinn JL, Dinan TG, Cryan JF: Microbiota and the social brain. Science 2019, 366(6465).
6. Lai KYC, Leung PWL, Hung SF, Shea CKS, Mo F, Che KKI, Tse CY, Lau FLF, Ma SL, Wu JCY et al: Gastrointestinal Problems in Chinese Children with Autism Spectrum Disorder. Neuropsychiatr Dis Treat 2020, 16:1807-1815.
7.Hwang IK, Yoo KY, Li H, Park OK, Lee CH, Choi JH, Jeong YG, Lee YL, Kim YM, Kwon YG et al: Indole-3-propionic acid attenuates neuronal damage and oxidative stress in the ischemic hippocampus. J Neurosci Res 2009, 87(9):2126-2137.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#ASD# #孤独症谱系障碍# #吲哚丙酸#
58