【Mol Cancer】综述:外周T细胞淋巴瘤的治疗挑战
2024-01-13 聊聊血液 聊聊血液 发表于陕西省
《Molecular Cancer》近日发表一篇综述,全面阐述了肿瘤异质性和肿瘤微环境 (TME) 对 PTCL 治疗耐药的显著影响,还分析了导致 PTCL 治疗耐药的分子机制,并讨论了预防和克服 P
外周T细胞淋巴瘤
外周 T 细胞淋巴瘤 (PTCL) 是一组罕见但极具异质性的血液恶性肿瘤,呈侵袭性且预后不良。PTCL占所有非霍奇金淋巴瘤的5-10%,目前对 T 细胞白血病和淋巴瘤的认识落后于 B 细胞肿瘤,很大一部分患者在诊断时已为晚期。历史上对 PTCL 的认识和治疗选择见图1。
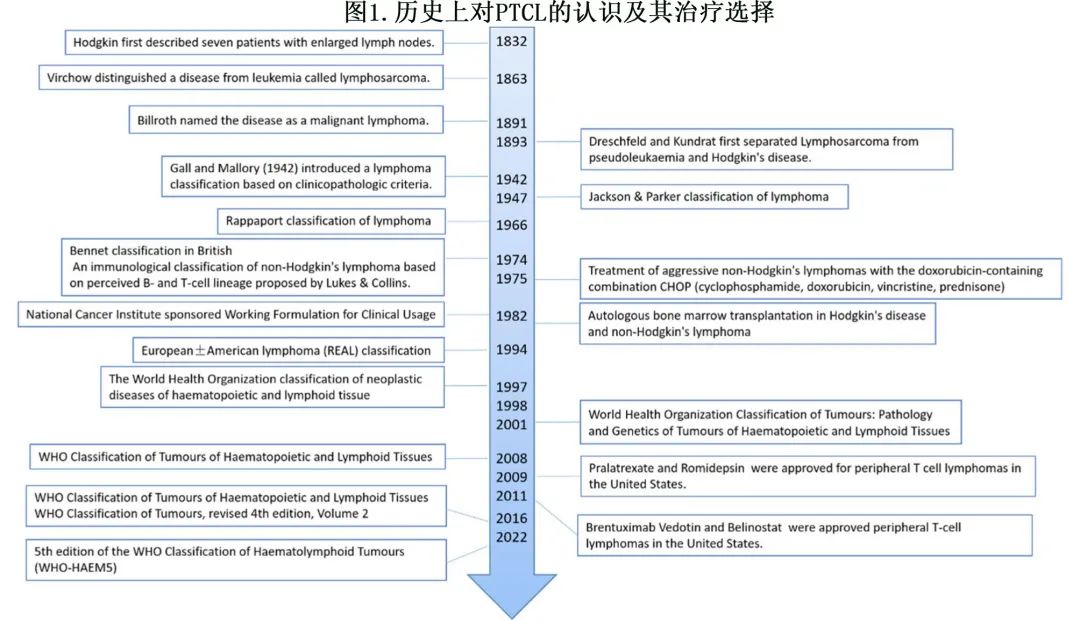
WHO将 PTCL 分为约30种不同类型。从广义上讲,淋巴结型、结外型和白血病型PTCL 通常表现为侵袭性疾病,五年生存率约为30%,而皮肤 PTCL 倾向于生长更缓慢。WHO血液淋巴样肿瘤分类 (WHO-HAEM5) 提供了新的分子和组织病理学结果,有助于对此类肿瘤进行诊断分类。
已成功用于侵袭性 B 细胞淋巴瘤的方案(即以蒽环类药物为基础的多药方案,包括CHOP)治疗T 细胞淋巴瘤的疗效不佳,约70%的 PTCL 患者在一线治疗后发生复发性或难治性疾病。通过“加用”或“替代”蒽环类药物改善结局的尝试也无效,大多数 T 细胞淋巴瘤患者将在诊断后几年内死于淋巴瘤或治疗相关并发症。大多数 T 细胞淋巴瘤存在困难且未满足的医学挑战。
《Molecular Cancer》近日发表一篇综述,全面阐述了肿瘤异质性和肿瘤微环境 (TME) 对 PTCL 治疗耐药的显著影响,还分析了导致 PTCL 治疗耐药的分子机制,并讨论了预防和克服 PTCL 治疗耐药的潜在策略。

PTCL的治疗耐药来源
由于治疗期间发生耐药性,PTCL复发或难治性疾病的发生率很高。尽管有多种治疗选择,但尚无一种能普遍治愈,并且最终可能对现有治疗产生耐药性;固有治疗耐药与获得性耐药可同时存在,但往往有所相区别。具体而言,固有耐药源自疾病本身,容易导致治疗无效,而获得性耐药源自治疗期间通过突变或非突变获得耐药介导特征,通常会导致疾病复发。在 PTCL 中,治疗耐药通常来自于由多种来源组成的癌症生态系统,包括异质性肿瘤细胞本身及其周围肿瘤微环境 (TME)。
肿瘤异质性
PTCL 是一组异质性显著的疾病,其特征为缺乏特有分子标志物和形态学特征。T细胞淋巴瘤由多种罕见疾病组成,可归类为惰性或侵袭性,占所有 NHL 的12%。2016年WHO发布修订后的 T 细胞/NK 细胞淋巴瘤分类,将其分为两个主要亚组:前体 T 细胞肿瘤和成熟 T 细胞肿瘤,后者进一步细分为白血病型、淋巴结型、结外型和皮肤型。此外,淋巴瘤可进一步分为惰性(生长缓慢)和侵袭性,前者的特征为病程长,通常对标准化疗耐药,而侵袭性淋巴瘤通常表现为急性 B 症状(如体重减轻、盗汗和发热)和快速进展。皮肤 T 细胞淋巴瘤 (CTCL) 为惰性,而外周成熟淋巴瘤 (PTCL)中其他亚型为侵袭性。PTCL(非特指型,NOS)是最常见的PTCL,其次为间变性大细胞淋巴瘤 (ALCL) 和血管免疫母细胞性 T 细胞淋巴瘤 (AITL)(图2)。2022年更新的 WHO 血液淋巴样肿瘤分类 (WHO-HAEM5) 包括发病机制和分子遗传学的新见解以及分类的新概念。

T 淋巴细胞白血病/淋巴瘤 (T-ALL/LBL) 可表现为淋巴瘤,常伴有纵隔淋巴结迅速增大和胸腔积液,还可伴有血液和/或骨髓白血病。T-ALL/LBL 中最常见的基因改变为NOTCH1 激活突变(50-70%)。诱导未成熟淋巴前体细胞成熟为 T 细胞需要 NOTCH1 信号传导,通过 NOTCH1 活化导致 MYC 激活。除 NOTCH1 活化外,TAL1活化是肿瘤发生的另一种常见驱动因素,在 T-ALL/LBL 中的发生率为25%-35%。高达70%的 T-ALL/LBL 患者存在CDKN2A/B 基因缺失,部分 T-ALL/LBL 患者还可能发生 NUP214 融合、PTEN和 WT1 缺失或突变、PHF6缺失和其他基因变化。与之不同,早期 T 细胞前体淋巴母细胞白血病 (ETP-ALL)则携带常见于髓系肿瘤的突变,包括 FLT3、NMT3A、NRAS、KRAS、IDH1或IDH2异常,它们在经典型T- ALL/LBL中均罕见。
尽管所有或甚至大多数系统性EBV+ T细胞淋巴瘤 (sEBV+ TNHL) 均无特异性染色体异常,但可存在一些常见特征:发生改变的病例通常具有复杂核型(≥3个染色体改变),且文献中近40%的病例携带add(9)(p24)。此外,超过20%的报告病例存在1、7、11、17、20、21和 X 染色体变异,而20%的慢性活动性 EBV 疾病存在DDX3X、BCOR/BCORL2和TET2。HV-LPD患者中与 CAEBV 相关的染色体改变包括 6q 缺失或 6p gain。这些分子和染色体异常也见于结外鼻型 NK/T 细胞淋巴瘤。一项针对原发 EBV 阳性 T/NK 细胞淋巴瘤的研究显示,约20%的病例存在复发性拷贝数畸变,包括chr14q11.2(100%)、chr3q26.1(67%) 和chr22q11.23(33%) 缺失。
结外 NK/T 细胞淋巴瘤 (ENKTL) 可分为3种不同亚型,具有不同的分子特征和治疗结局(3年 OS 率分别为79.1%、91.7%和38.5%):TSIM(肿瘤抑制/免疫模式)亚型与 JAK/STAT 通路活化、NK细胞来源、TP53突变、基因组不稳定性(包括 6q21 缺失和9p24.1和/或17q21.2 amplifications)和 PD-L1/2 过表达相关;HEA(HDAC9-EP300-ARID1A) 亚型与表观遗传学改变相关,通过HDAC9、EP300和 ARID1A 突变、NF-KB活化、T细胞定向和 T 细胞受体信号激活;最后,MB(MGA-BRDT) 亚型与 MYC 过度表达和预后不良相关。
53%的成人 T 细胞白血病/淋巴瘤 (ATLL) 病例存在 ATXN1 或 CIC 异常,且常见CCR4突变,大多数 ATLL 患者表现出 CCR4 过表达,其与皮肤受累和预后较差相关。10%-20%的病例出现 9p24 扩增伴 PDL1 扩增,16%的病例出现 TP53 突变,两者均与不良预后相关。
间变性大细胞淋巴瘤 (ALCL) 中最常见的易位为t(2;5)(p23;q35),大约85%的ALK+ ALCL中存在NPM1::ALK。ALK+ ALCL的预后优于 ALK- ALCL,5年总生存率(OS)为70-90%。ALK- ALCL 病例具有相当大的遗传异质性,约30%的系统性 ALK 阴性 ALCL 患者携带 DUSP22 基因重排。某些研究提出 ALK- ALCL 的dusp22重排结局较佳,与 ALK+相似;但也有其他研究表明,与 ALK+相比其病程更具侵袭性。约8%的 ALK- ALCL 病例携带 TP63 重排,与不良预后相关,5年总生存率仅为17%,甚至低于PTCL-NOS。
PTCL-NOS是一种不符合任何特异性亚型标准的 T 细胞淋巴瘤,也是最常见的 T 细胞淋巴瘤类型,占所有病例的25-30%。PTCL-NOS的预后依赖于其遗传异质性,因此根据基因表达谱进行分类:一种为 GATA3 高表达 (PTCL-GATA3),另一种为 TBX21 高表达 (PTCL-tbx1)。PTCL-GATA3与 PI3K/mTOR 通路激活相关,表现出更异常的基因组,因此与不良预后相关,5年总生存率为19%;而PTCL-TBX21的特征为 NFKB 通路激活、基因组异常更少和预后更佳,5年总生存率为38%。TP53/CDKN2A异常的 PTCL-NOS 患者显示出相当大的染色体不稳定性和较差的总生存率,表现出与 TFH 标记物表达呈负相关。大多数 PTCL-NOS 病例存在 CDKN2A 纯合性缺失,似乎与不良预后相关。
在最新的 WHO 分类中,Tfh(滤泡辅助性 T 细胞)PTCL包括具有 Tfh 表型的AITL、滤泡性 PTCL 和淋巴结PTCL,其具有相似临床表现、基因表达、DNA拷贝数、异常和突变特征。3、5、21和 X 染色体增加/三体是 AITL 中最常见的细胞遗传学异常,其他可见的染色体异常包括11q13、19或 22q 增加和 13q10 丢失。在AITL 的基因突变大部分与髓样肿瘤的基因突变重叠,47%~83%的 AITL 病例携带 TET2 突变,26%~38%携带 DNMT3A 改变;这些基因参与表观遗传调控,其突变可通过 PTCL 中常见的机制导致5-羟甲基胞嘧啶丢失。20-45%的 AITL 也携带 IDH2 突变,70%的 AITL 携带RHOA p.G17V突变。RHOA和 IDH2 突变仅限于肿瘤细胞这一事实表明,它们可能是多步骤致癌过程中的第二次打击。这些突变也存在于 Tfh 型 PTCL 中,但 IDH2R172 突变(其与 AITL 标记密切相关,且与特定的病理表现相关)和SYK 融合(滤泡 PTCL 中更常见)除外。
肿瘤微环境
淋巴瘤的发生不仅由肿瘤自主过程驱动,还需要肿瘤微环境 (TME) 错综复杂的相互作用。TME包括肿瘤细胞、免疫细胞、基质细胞、血管和肿瘤周围的细胞外基质。TME内基质细胞与肿瘤细胞之间的相互作用以及可溶性因子的分泌是各种肿瘤类型治疗耐药的促成因素。由于 PTCL 相对罕见,对 PTCL TME 的认识仍处于早期阶段,大多数知识来源于 B 细胞 NHL。
PD-L1在 PTCL 的 TME 中表达更明显,见于73%的 CTCL 和39%的其他 PTCL 。PD-L1在恶性细胞中也高度表达,例如鼻 NK/T 细胞淋巴瘤 (NKTCL) 和鼻外NKTCL;几乎所有 EBV 相关淋巴瘤均与 PD-L1 高表达相关。血清 PD-L1 水平与 ENKTCL 的预后相关,例如,肿瘤细胞中 PD-L1 水平升高与血清中 PD-L1 水平升高和 OS 恶化相关,其与免疫逃逸相关。如前所述,PTCL-NOS中的 GATA3 表达与预后不良相关,其特征为2型辅助 t 细胞 (Th2) 相关细胞因子(包括IL-4、IL-5、IL-10和IL-13)促进巨噬细胞极化为替代的 M2 型巨噬细胞。M2巨噬细胞可通过分泌促血管生成细胞因子(如 VEGF)促进血管生成,还分泌 IL-10 和转化生长因子,以自分泌方式上调巨噬细胞上 PD-L1 的表达。PD-L1与 T 细胞上表达的 PD-1 结合可抑制 T 细胞功能,从而产生免疫抑制。临床病理学相关性研究为 T 细胞淋巴瘤中肿瘤相关巨噬细胞的预后意义提供了证据。在64例 T 细胞淋巴瘤中,肿瘤相关巨噬细胞含量与多变量分析中的不良预后相关(高巨噬细胞含量 vs 低巨噬细胞含量,总生存期,OS:28.1% vs 44.3%)。巨噬细胞浸润的程度也与生存期呈负相关,多项研究显示高含量的 CD163 阳性巨噬细胞与低生存相关。
T 细胞淋巴瘤中其他非肿瘤性 T 细胞的浸润也可调节TME。调节性 T 细胞(Tregs) 是 CD4 阳性 T 细胞的一个亚群,可抑制免疫反应,维持免疫耐受;其特征为高水平 CD25 和叉头转录因子FOXP3。淋巴瘤微环境中的Tregs可抑制免疫介导的抗肿瘤反应,从而提高肿瘤细胞的存活。但 Tregs 还可能下调微环境中的炎症反应,促进肿瘤进展,从而抑制肿瘤细胞增殖。Tregs对肿瘤细胞的双向调节作用或可解释 Tregs 对不同类型 T 细胞淋巴瘤明显矛盾的预后作用。在多变量分析中,Tregs的数量仍是独立预后生物标志物,大量 Tregs 浸润与更高生存相关。
多重耐药
耐药是成熟 T/NK 细胞淋巴瘤治疗中的常见和较大障碍,其中多药耐药 (MDR) 表型是其机制之一,MDR是指对多种结构和功能不相关药物的获得性交叉耐药,多与 ATP 结合盒 (ABC) 蛋白家族的药物外排转运蛋白表达增加相关。ABC转运蛋白超家族包含48个 ABC 转运蛋白,根据序列同源性和蛋白质组织分为7个亚家族;其在药物和有毒物质的生理转运和输出中发挥关键作用,可在胞外输出多种化疗药物。T/NK细胞淋巴瘤MDR 蛋白表达频率高。在早期的报道中,ATL患者对化疗反应差的部分原因为P-糖蛋白 (P-gp)或 MDR1 的高表达。在一项研究中,采用免疫组化检测45例成熟 NK/T 细胞淋巴瘤中P-gp、多药耐药相关蛋白1(MRP-1)、乳腺癌耐药蛋白 (BCRP) 和肺耐药蛋白 (LRP) 的表达,结果阳性率分别为31%(13/42)、74%(31/42)、78%(32/41) 和59%(26/44)。一项 T 细胞和 NK 细胞淋巴瘤耐药性研究中报告,治疗失败与总生存期的统计学显著相关性。一项鼻 NK 细胞淋巴瘤患者研究中也报告 P-gp 高表达,表明这些患者的不良预后可能与 P-gp 表达相关。CD56阳性 NK 细胞肿瘤中的 P-gp 表达与不良预后相关。
B 细胞淋巴瘤中R-CHOP 的药物不具有协同作用,但交叉耐药性非常低,表明 R-CHOP 的疗效是由非重叠活性药物联用产生的,而CHOP对 ENKTL 的疗效较差的原因在于多药外排泵 P-糖蛋白/MDR1 的表达。P-糖蛋白在 PTCL 淋巴瘤细胞中高表达,而多柔比星、长春新碱和泼尼松是 P-gp 的底物,由于 P-gp 表达上调,容易诱导药物固有耐药。与正常 NK 细胞相比,人 NK/T 细胞淋巴瘤 YTS 和 SNK-6 细胞中 ABCC4 和 ABCG4 显著上调。总的来说,强调 ABCC4 在耐药性中的作用是重要。基于基因表达调控技术,ABCC4和 ABCG4 过表达可诱导人 NK/T 细胞淋巴瘤 YTS 细胞对表柔比星 (EPI) 和顺铂 (DDP) 耐药,并减少细胞凋亡;此外IL-6、IL-10和 IL13 可介导 T 细胞淋巴瘤中的 ABCC4 耐药性。
PTCL中的信号通路
淋巴瘤的耐药机制与淋巴瘤细胞的信号通路密切相关,最近对 PTCL 的遗传学分析提高了对这种恶性肿瘤发病机制的理解。NF-κB、Notch、JAK/STAT3、RHOA和 PI3K/AKT 信号通路的活化突变在 PTCL 的发病机制中发挥重要作用。ENKTL 中JAK/STAT通路基因的表达上调,JAK3、STAT3和 STAT5B 的突变导致 JAK/STAT 通路激活(约35%的患者中发生于转录因子 JAK3),导致以缺乏 T 和 NK 细胞为特征的重度免疫缺陷。DDX3X是一种 RNA 解旋酶基因,在20%的 PTCL 中发生突变,可导致细胞周期停滞和核因子-κB(NF-κB) 和丝裂原活化蛋白激酶 (MAPK) 通路的转录激活丧失,临床上存在DDX3X突变提示预后不良。PTPRK 可使磷酸化的 stat3 去磷酸化,导致其失活,由于启动子异常超甲基化导致的 PTPRK 缺失和 PTPRK 低表达可引起 STAT3 的组成性活化,导致 PTCL 增殖和发展。在接受类固醇、甲氨蝶呤、异环磷酰胺、左旋门冬酰胺酶和依托泊苷 (SMILE) 方案治疗的患者中,PTPRK下调与晚期疾病和不良结局相关。NF-κB参与多种淋巴恶性肿瘤的促增殖信号转导,虽然机制还需要进一步研究,但GEP研究表明 PTCL 中NF-κB相关基因表达增加,而NF-κB抑制剂可诱导 PTCL 细胞凋亡,从而支持该通路在 PTCL 中发挥重要作用的假设。此外,NF-κB参与噬血细胞作用的发病机制,后者是 PTCL 患者的主要死亡原因(图3)。此外,越来越多的数据表明,病毒组分可参与淋巴瘤细胞的多药化疗耐药,并且部分机制可能与致癌病毒介导的化疗耐药相关,由疾病信号通路的变化而引起。在潜伏 EBV 感染下,细胞内 ROS 的产生通过 STAT1 途径增加 P-gp 的表达,ROS清除剂 NecroX-5 下调ROS,有效减弱 EBV 阳性 NK/T 细胞淋巴瘤中 P-gp 相关的化疗耐药。LMP1和/或其他病毒组分也参与 P-gp 依赖性化疗耐药。

PTCL的表观遗传学
表观遗传学是表达状态的稳定克隆遗传,无法用 DNA 变异来解释。基因表达通常通过组蛋白和非组蛋白的 DNA 甲基化和翻译后甲基化、乙酰化、磷酸化和泛素化来维持。在包括 PTCL 在内的各种恶性肿瘤中均观察到参与表观遗传调控的基因编码蛋白突变,特别是在表达滤泡辅助性 T 细胞 (TFH) 分化标志物的恶性肿瘤中,如血管免疫母细胞性 T 细胞淋巴瘤 (AITL) 和部分PTCL-NOS。DNA甲基化和组蛋白修饰的破坏已成为这些疾病的标志和表观遗传学靶向治疗的基础。随着对表观遗传复杂性的理解不断深入,已发现这些表观遗传调控因子的突变对淋巴瘤发展和药物敏感性具有全面影响,通过调控大量基因同时沉默多个基因使其可导致多基因耐药。
PTCL中的MicroRNA
MicroRNA 是一类长度为19-22个核苷酸的RNA,参与发育、增殖、分化和凋亡等重要生物学过程,多种靶向不同信号通路蛋白/分子的 miRNA 可调控各种 T 细胞亚群的分化,从而启动或抑制/终止分化。不同的 microR-NA 在淋巴 T 细胞中独特表达,通过靶向其靶基因在各种亚型的发生和分化中发挥作用。miRNA的异常表达可参与 T 细胞白血病和淋巴细胞生成,并可能作为肿瘤抑制基因如miR-451、miR-31、miR-150和 miR-29a 或癌基因如miR-222、miR-223、miR-17–92和 miR-155 发挥作用。在 T 细胞白血病和淋巴瘤中,micro-RNA可用作预后和诊断的新型生物标志物,或作为疾病严重程度的指标。
miR-122 的表达增加与晚期蕈样肉芽肿 (MF) 的不良预后有关,miR-21、miR-486和 miR-214 的上调参与促进 SzS 细胞存活,参与 CTCL 细胞系的凋亡抵抗,甚至导致CTCL无法治愈。NK细胞淋巴瘤细胞系中 miR-21 和 miR-155 的表达水平显著高于正常 NK 细胞。血浆 miR-221 水平可能对结外 NK/T 细胞淋巴瘤 (ENKTCL) 具有诊断和预后意义,事实上miR-221表达与其治疗后的总生存期存在间接关系;NKTL 组织中miR-146a低水平表达的患者与化疗耐药和预后不良相关。该miRNA 作为一种肿瘤抑制因子,因此可用于 PTCL 的预后判断。有研究评估 T 淋巴母细胞淋巴瘤/白血病 (T-LBL/ALL) 患者石蜡包埋的淋巴结样本中 miR-16 的表达水平,结果显示高水平 miR-16 患者的总生存期高于低水平患者,证实可作为 T-LBL/ALL患者的预后标志物。外泌体miR-4454、miR-21-5p和 miR-320e 水平升高与总生存率低相关,治疗后复发的患者中水平也升高,且三种 miRNA 在依托泊苷耐药的 PTCL 细胞系中过表达。
R/R PTCL的获批和新兴疗法
PTCL 治疗的探索非常活跃,且治疗发展主要有对疾病生物学理解的进展所驱动。
CD30单抗
CD30 受体在霍奇金病、T细胞淋巴瘤亚群和活化 T 细胞中均表达。在376例 PTCL 患者样本中,58%的PTCL-NOS、63%的 AITL 和几乎100%的 ALCL 表达CD30。因此业内对靶向 CD30 作为 PTCL 的潜在治疗选择越来越感兴趣。维布妥昔单抗 (BV) 是一种抗体-药物偶联物,BV-CHP已在 ALCL 中显示临床获益,使其成为其的首选,并且强烈考虑用于其他CD30+ PTCL。在一项大型前瞻性 II 期研究和另一项大型 III 期随机研究 (ECHELON-2) 中,BV 联合其他化疗药物均具有良好治疗效果,BV单药治疗复发难治性 PTCL 也取得了良好的疗效。在ASH 2022,ECHELON-2 研究的5年更新显示,与 CHOP 相比,一线A + CHP 治疗PTCL患者继续提供临床有临床意义的PFS 和 OS改善且安全性特征可管理,中位随访47.6个月时A+CHP组和 CHOP 组的5年 PFS 率分别为51.4%和43.0%,5年总体生存率分别为70.1%和61.0%,死亡风险降低28%(HR=0.72)。在复发后接受维布妥昔单抗治疗的患者中,A+CHP后 BV 再治疗的客观缓解率为59%,CHOP后维布妥昔单抗再治疗的客观缓解率为50%。且在 ECHELON-2 中,接受A+CHP的>65岁患者的结局显著改善。一项正在进行的2期研究正在探索经典型霍奇金淋巴瘤、sALCL或其他CD30 阳性PTCL再治疗,或可给出额外数据。虽然 BV 在 R/R HL 中具有较好疗效,但大多数患者最终会发生 BV 耐药;抗原下调是任何抗原靶向治疗的潜在耐药机制,但CD30缺失似乎并非 BV 难治性 HL 的常见事件。研究发现,在 BV 难治性 HL 患者的肿瘤样本以及两种独立的 BV 耐药细胞系中均维持 CD30 表达,发现两种细胞系均上调多药耐药基因MDR1,表明 BV 耐药可能部分由 MDR1 活性增加(而非 CD30 丢失)介导。NF-κB活性上调可导致耐药克隆中 MDR1 表达增加。在 BV 治疗的基础上加用 MDR1 抑制剂可能是 PTCL 的一种潜在治疗选择。
普拉曲沙
普拉曲沙 (PDX) 是一种新型抗叶酸药,比甲氨蝶呤更有效,对 T 细胞淋巴瘤有效;其是一种高选择性抗叶酸药,对还原型叶酸载体 (RFC) 具有高亲和力,而RFC是一种调节天然叶酸摄取的蛋白质,在肿瘤细胞中是嘌呤和嘧啶生物合成的必需成分。基于 PROPEL 研究,普拉曲沙是首个获批用于复发/难治性 PTCL 患者的药物。PROPEL研究人群包括所有侵袭性 TCL 亚型的患者,包括被其他研究部分排除的挑战性疾病,例如母细胞性NTKCL、转化型MF 和HTLV-1 ATLL,结果所有亚型中均观察到 PTCL 应答,ORR为29%(研究者评估为39%),18%的患者达到PR,11%达到 CR 或未证实的CR(CRu)。
普拉曲沙获批后,一项 II 期研究探索了一线治疗中交替使用CEOP(环磷酰胺、依托泊苷、长春新碱和泼尼松)与普拉曲沙(30 mg/m2 IV,第15、22和29天),但未显示优于CHOP的历史数据。普拉曲沙治疗患者的总缓解率 (ORR) 约为30%,这对于 T 细胞淋巴瘤并不理想。除固有耐药性外,普拉曲沙还与其他常规细胞毒性化疗药物存在交叉耐药性,并随时间推移而蓄积。此外,其毒性可能显著,最常见的3/4级不良事件为血小板减少 (32%)、粘膜炎 (22%)、中性粒细胞减少 (22%) 和贫血 (18%),因此需要更多的研究来改善这些患者的生活质量和可接受的舒适指数。联合用药似乎在一定程度上了克服对普拉曲沙的固有耐药,其耐药机制与细胞摄取减少和/或 DNMT3B 的过表达有关。表观遗传学改变也在耐药机制中起作用,而DAC联合普拉曲沙具有协同作用,有望提高临床疗效。此外,普拉曲沙还与组蛋白去乙酰化酶抑制剂(如romidispin)和蛋白酶体抑制剂(如硼替佐米)具有显著的协同作用。
PD-1/PD-L1
PD-1可识别肿瘤细胞上的配体如PD-L1,以逃避宿主免疫应答,抑制PD-L1通路已成为治疗肿瘤的一种混杂策略,而NKTCL中的 PD-L1 表达范围为39-100%。在一项包含 R/R 血液恶性肿瘤的 Ib 期研究中,PD-1治疗PTCL患者的 ORR 为40%,但未观察到CR。尽管帕博利珠单抗已用于治疗各种 NHL 亚型,但关于帕博利珠单抗在 NKTCL 患者中疗效的真实世界数据有限。几项研究发表了临床试验数据,但样本量较小,其中有研究表明帕博利珠单抗抑制 PD-1 是治疗难治性或复发性 NKTCL 的有利策略。此外,PD-L1突变和多种基线 T 细胞受体 (TCR) 组库(repertoire)是潜在生物标志物,可用于更好地选择接受抗 PD-1 治疗的 NKTCL 患者;NKTCL患者可在接受免疫检查点抑制剂治疗前进行 PD-L1 突变和 TCR 序列分析,以避免过度经济负担并减少不良事件。
组蛋白去乙酰化酶抑制剂
组蛋白去乙酰化酶抑制剂 (HDACis)具有抗肿瘤活性,其机制与组蛋白和其他参与肿瘤抑制、凋亡和细胞周期调控的蛋白乙酰化有关。Romidepsin于2009年首次获得 FDA 批准用于治疗复发性皮肤 T 细胞淋巴瘤患者,随后基于两项独立的 II 期临床试验获批用于治疗复发性/难治性 PTCL 患者。Ro-CHOP III期研究旨在比较标准 CHOP 与Romidepsin-CHOP 方案用于一线 PTCL 患者,中位随访27.5个月,Ro-CHOP联合方案较CHOP未改善PFS、缓解率或OS,也未增加≥3级治疗相关TEAE。Ro-CHOP组的6个月、1年和2年 PFS 率分别为67.4%、49.8%和43.2%,CHOP组分别为65.9%、44.3%和36.3%;Ro-CHOP组的1年和2年 OS 率分别为78.2%和63.6%,CHOP组分别为77.5%和63.4%。然而Ro-CHOP治疗中 TEAE 的高发生率限制了CHOP 基石的强度。总体而言,Ro-CHOP在既往未经治疗的 PTCL 患者中未显示出获益。基于这项研究,2022年05月06日,FDA正式宣布撤销Romidepsin用于 PTCL 适应症的批准,但仍批准用于治疗接受过至少一种全身治疗的皮肤 T 细胞淋巴瘤患者。
Belinostat 是一种基于泛1类和2类异羟肟酸的 HDAC 抑制剂,目前已获批用于既往接受过至少一线治疗的复发性或难治性 PTCL 患者。西达本胺也在 R/R PTCL 中显示单药治疗活性。
尽管HDAC抑制剂具有促抗淋巴瘤活性,但耐药仍是重要临床问题。Belinoostat耐药细胞对其他 HDAC 抑制剂表现出明显的交叉耐药,包括romidepsin、panobinostat和vorinostat;与对 HDAC 抑制剂的不敏感性一致,耐药细胞未能诱导乙酰化组蛋白的增加。肿瘤细胞对 HDAC 抑制剂的耐药性可能涉及“固有”和“获得性”机制,信号分子的异常表达和修饰也导致癌细胞对 HDAC 抑制剂产生固有耐药。
PI3K/Akt/mTOR 通路抑制剂
在 T 淋巴细胞中,已知响应外源性刺激的磷脂酰肌醇3-激酶 (PI3K)/Akt/雷帕霉素 (mTOR) 通路的哺乳动物靶标的激活可驱动细胞存活和克隆增殖,PI3K激活受到通过 TCR 复合物转导的信号严格控制。因此,在存在稳定 TCR 信号的情况下,主要由 PI3K/Akt/mTOR 通路驱动的共刺激信号导致 T 细胞增殖完全活化,使得抑制该通路和/或 TCR 信号传导成为 PTCL 治疗的合理方法。Duvelisib(IPI-145) 是 PI3K 亚型PI3Kδ和PI3Kγ的口服抑制剂,后者是完整 TCR 信号转导所必需的。在一项开放标签 I 期研究中,16例 R/R PTCL 患者和19例 CTCL 患者接受 duvelisib 治疗,ORR为50%,CR率为19%,中位 PFS 为8.3个月。Copanlisib (bay80-6946) 是一种PI3Kα和δ抑制剂,在 B 细胞淋巴瘤中具有活性,FDA批准其用于治疗滤泡性(B细胞)淋巴瘤,目前正在进一步研究 copanlisib 在 T 细胞淋巴瘤中的疗效。
Aurora A激酶 (AAK) 最近也发现在细胞进入有丝分裂中发挥关键功能,其过表达与许多肿瘤的发生有关,促使探索 AAK 抑制作为包括 PTCL 在内的多种癌症的潜在治疗策略。Alisertib是一种选择性 AAK 抑制剂,在 T 细胞和 B 细胞淋巴瘤的临床前模型以及体内淋巴瘤模型中显示出良好活性。尽管早期活性很有前景,但由于与其他药物相比,PFS更优的几率较差,因此提前停止入组,该结果虽然令人沮丧,但未完全排除 Alisertib 联合方案的未来作用。
其他药物
除上述 FDA 批准的药物外,苯达莫司汀、CCR4抑制剂、ALK抑制剂、DNA甲基转移酶 (DNMT) 抑制剂、CD138单克隆抗体、CD52单克隆抗体、抗病毒药物、免疫调节剂、EZH2和 EZH1 双重抑制剂也在复发性和难治性 PTCL 中非常令人鼓舞的试验性药物。此外,该领域重点是针对复发性或难治性 T 细胞淋巴瘤开展临床试验,表1提供了正在进行的 r/r PTCL 临床试验,其中包括已上市药物的新型组合以及未上市的新开发药物。

结论
大多数 PTCL 亚型具有侵袭性和化疗耐药性,其预后仍然较差,肿瘤异质性、肿瘤微环境和信号通路等多种机制与 PTCL 耐药相关。在过去的几年中,很多学者探索了鉴定致癌通路中的新分子靶点和失调的分子,也有很多正在进行的临床试验探索其他靶向药物、新型细胞治疗和免疫治疗。随着精准医疗的发展,很可能会看到新的治疗方案克服肿瘤耐药,从而提高 PTCL 的治疗疗效。
参考文献
Luan, Y., Li, X., Luan, Y. et al. Therapeutic challenges in peripheral T-cell lymphoma. Mol Cancer 23, 2 (2024). https://doi.org/10.1186/s12943-023-01904-w
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#耐药# #外周T细胞淋巴瘤# #PTCL#
50